構建分子內二硫鍵提升谷氨酰胺轉氨酶熱穩定性
杜建輝,劉松,2*,陸信曜,陳堅*
1(江南大學 生物工程學院,江蘇 無錫,214122) 2(糧食發酵工藝與技術國家工程實驗室(江南大學),江蘇 無錫,214122)
微生物谷氨酰胺轉氨酶(transglutaminase,TGase)是工業中常用的工具酶,能夠催化酰基供體進行脫酰胺和酰基轉移,進而形成共價鍵以完成分子交聯[1]。目前市場上食品級TGase來源于茂原鏈霉菌(Streptomycesmobaraenesis),因具有非鈣離子依賴、發酵成本低等優勢而備受市場青睞[2]。近些年隨著對TGase催化特異性的研究,其在紡織、制藥和材料加工等非食品領域的應用也廣受關注[3-5]。
隨著S.mobaraenesisTGase在工業領域的廣泛應用,其較差的熱穩定性也成為亟待解決的問題。目前,已有隨機突變、DNA改組和飽和突變為基礎的定向進化提高TGase熱穩定性的報道[6-8]。其中,突變體MS(S2P-S23V-Y24 N-S199A-K294L)是目前熱穩定性較優的TGase突變體[9]。與氫鍵等因素相比,二硫鍵可以降低蛋白質中未折疊多肽鏈的熵以提升穩定性,是影響熱穩定性的最重要因素[10]。理性設計形成蛋白質分子內部二硫鍵也是提高酶穩定性的重要手段。ZHANG等[11]對一種嗜熱植酸酶理性設計引入了8組二硫鍵,其中最佳一組突變體60 ℃半衰期提升了3.8倍,同時表現出更強的抗胰蛋白酶及胃蛋白酶降解能力;朱方劍[12]通過理性設計在角質酶中引入二硫鍵成功獲得一個熱穩定性顯著提高的突變體,該突變體70 ℃處理10 min殘余酶活是野生型的1.5倍,80 ℃半衰期可達16 h;王睿等[13]通過理性設計在脂肪酶中引入二硫鍵,最佳一組突變體60 ℃半衰期較原始酶延長了3.5倍,Tm提高4.2 ℃。
本研究以突變體MS為基礎,通過對野生型TGase結構進行虛擬突變和能量優化獲得了MS的模擬構象。應用Disulfide by design 2.0線上分析軟件對潛在的二硫鍵成鍵突變體進行預測,選擇12對二硫鍵突變體,利用大腸桿菌(Escherichiacoli)進行表達、純化及酶學性質分析,并對相關突變體蛋白機理進行了探討。
1 材料與方法
1.1 材料
1.1.1 菌株與質粒
所用大腸桿菌E.coliJM109和E.coliBL21(DE3)由本實驗室保存。E.coliJM109作為克隆宿主,E.coliBL21(DE3)作為構建質粒的表達宿主。編碼突變體MS(S2P-S23V-Y24 N-S199A-K294L)基因由蘇州金唯智(GENEWIZ)合成,并通過酶切位點BlpI、NdeI克隆至的pET-22b(+),得到質粒pET-22b(+)/pro-MS。編碼硫氧還原蛋白TrxA的質粒pET-48b由本實驗室保存。
1.1.2 實驗試劑
DNA工具酶及磷酸化試劑盒(Blunting Kination Ligation Kit),Takara大連寶生物公司;中性蛋白酶,北京索萊寶科技有限公司;5 mL鎳離子親和層析柱、5 mL G-25凝膠層析柱,江蘇千純生物科技有限公司;Bradford蛋白濃度測定試劑盒,碧云天生物技術公司;CBZ-Gln-Gly,Sigma-Aldrich中國;一步克隆試劑盒(Vazyme ClonExpress II One Step Cloning Kit C112),諾唯贊;其他分子生物學試劑,大連寶生物公司。
1.1.3 培養基與緩沖液
LB培養基:酵母提取物5 g/L、胰蛋白胨10 g/L、NaCl 10 g/L,固體培養基添加質量分數2%的瓊脂粉。
TB培養基:酵母提取物24 g/L、胰蛋白胨12 g/L、K2HPO4·3H2O 12.84 g/L、KH2PO42.31 g/L,甘油4 mL/L。
TGase活化液:50 mmol/L Tris-HCl,100 mmol/L NaCl,2 mmol/L CaCl2,1 mmol/L還原型谷胱甘肽、200 g/L中性蛋白酶,調節pH至7.0。
純化緩沖液A液:50 mmol/L Tris-HCl,100 mmol/L NaCl,25 mmol/L咪唑,調節pH至7.8。
洗脫緩沖液B液:50 mmol/L Tris-HCl,100 mmol/L NaCl,500 mmol/L咪唑,調節pH至7.8。
脫鹽緩沖液C液:50 mmol/L Tris-HCl,調節pH至7.8。
二硫鍵還原緩沖液:0.1 mol/L Tris-HCl,8 mol/L脲素,調節pH至7.0。
酶活測試底物:200 mmol/L Tris-HCl,100 mmol/L羥胺,10 mmol/L還原型谷胱甘肽,30 mmol/L CBZ-Gln-Gly,調節pH至6.0。
酶活力測試終止液:將120 g/L三氯乙酸、3 mmol/L HCl、50 g/L FeCl3·6H2O(溶于0.1 mol/L HCl)等體積混合均勻,避光保存。
1.2 實驗方法
1.2.1 軟件分析
通過I-TASSER (https://zhanglab.ccmb.med.umich.edu/I-TASSER) 線上服務器根據野生型成熟TGase構象(PDB:1iu4)對突變體MS構象建模[14]。在此基礎上,通過Rosetta-StructureRelax模塊對MS構象進行優化。將獲得的最終構象上傳至Disulfide by design 2.0(http://cptweb.cpt.wayne.edu/DbD2/)線上服務器進行二硫鍵突變預測[15]。對預測得到的55個突變體根據能量分組,即能量由高到低每9個分為一組(最后一組10個)。在各分組中抽取2個作為實驗對象,進行突變后驗證。
1.2.2 突變體的構建
通過一步克隆構建表達載體pET-22b(+)/TrxA-pro-MS(圖1-a)。以trxa-f和trxa-r為引物,通過PCR從質粒pET-48b擴增得到TrxA片段。以vec-f和vec-r為引物,通過PCR從pET-22b/pro-MS擴增得到pET-22b/pro-MS開環片段。開環片段溶液經DpnI消化后,與TrxA片段通過一步克隆試劑盒連接,產物轉化E.coliJM109,提取質粒測序,篩選得到序列正確的表達載體pET-22b(+)/TrxA-pro-MS。
以ms-s1-f/ms-s1-r、ms-s2-f/ms-s2-r、ms-s3-f/ms-s3-r、ms-s4-f/ms-s4-r、ms-s5-f/ms-s5-r、ms-s6-f/ms-s6-r、ms-s7-f/ms-s7-r和ms-s8-f/ms-s8-r為引物對pET-22b(+)/TrxA-pro-MS進行PCR擴增,分別得到含有MS-P244C-E249C、MS-S293C-N297C、MS-E182C-G185C、MS-A136C-N149C、MS-D118C-K121C、MS-A136C-L150C、MS-L154C-R162C和MS-D86C-R89C的突變基因片段。PCR產物經DpnI消化后回收,用磷酸化試劑盒連接后轉化E.coliJM109并提取質粒測序驗證。以pET-22b(+)/TrxA-pro-MS為模板,通過一步克隆法構建二硫鍵突變體MS-Q206C-I240C、MS-G110C-Y217C、MS-P22C-Q328C和MS-A130C-A195C。膠回收PCR產物并將含有同源臂的片段試劑盒連接,轉化E.coliJM109并提取質粒測序驗證。測序正確的質粒轉化E.coliBL21(DE3),獲得突變體生產菌株。本研究所使用的引物見表1。
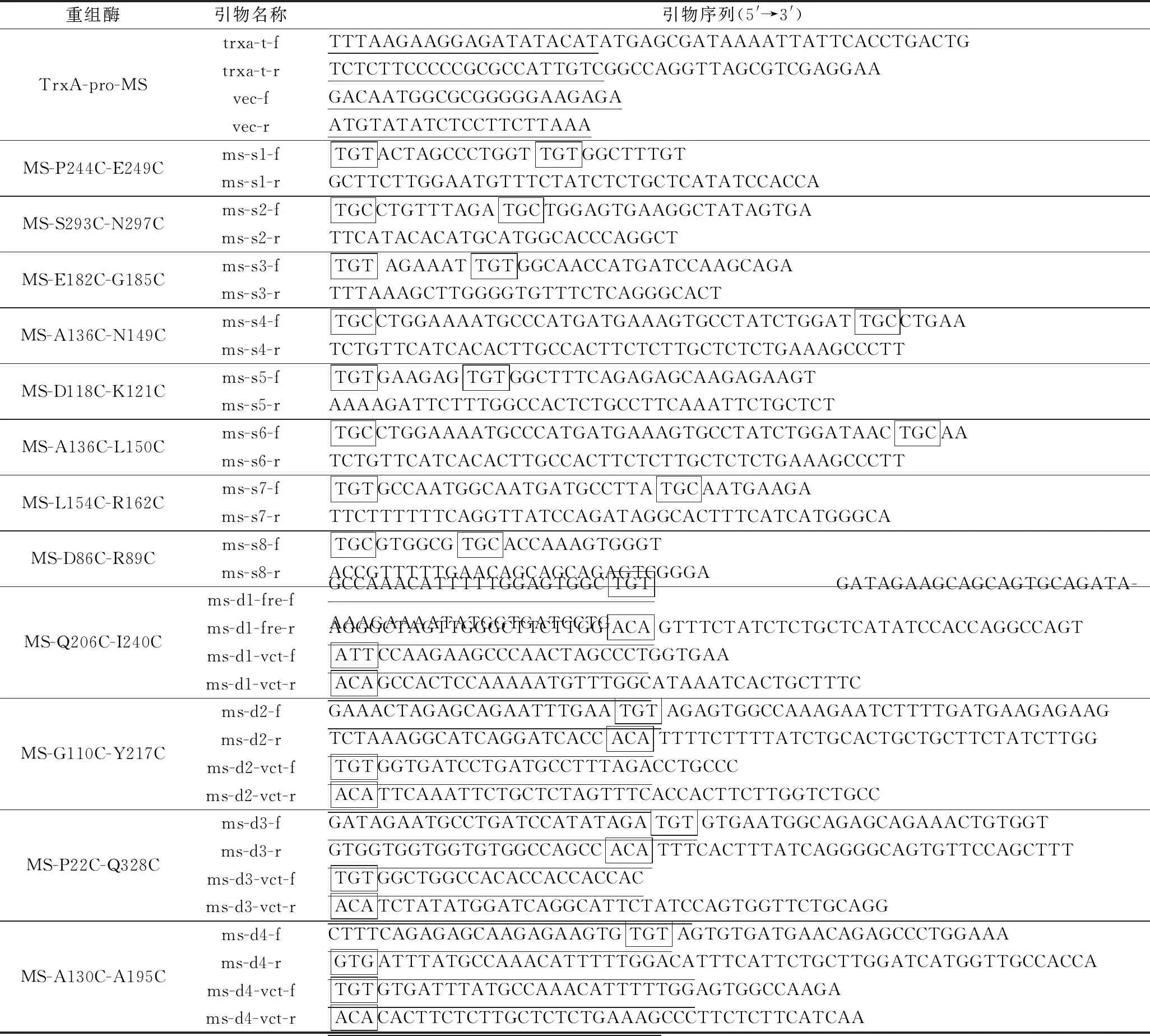
表1 本研究所使用的引物
1.2.3 突變體的誘導表達
陽性轉化子接入氨芐青霉素濃度為0.1 g/L的LB培養基中,37 ℃過夜培養10 h后以2%接種量接于相同質量濃度抗性的TB培養基中,37 ℃培養至OD600=1.0時加入終濃度為0.1 mmol/L IPTG誘導表達,20 ℃培養40 h。
1.2.4 發酵產物回收
發酵液6 000×g離心10 min,收集沉淀以脫鹽溶液C液重懸,冰上預冷后超聲破碎20 min,10 000×g離心20 min,取上清液添加1/5體積TGase活化液,37 ℃水浴孵育30 min后10 000×g離心25 min,收集上清液用于純化。
1.2.5 TGase的純化、脫鹽及蛋白濃度測定
蛋白純化采用鎳柱通過純化緩沖液A液進行平衡,以V(純化緩沖液A)∶V(洗脫緩沖液B液)=7∶3的比例對蛋白樣品進行洗脫。回收蛋白后通過G-25凝膠柱使用脫鹽溶液C液對樣品進行脫鹽。蛋白濃度采用Bradford(碧云天)試劑盒進行測定。
1.2.6 酶活測定
比色法測定TGase酶活力[16],定義1單位TGase酶活力為37 ℃條件每下1 min生成1 μmolL-谷氨酸 γ-單羥肟酸[17]的酶量。
1.2.7 酶半衰期測定
酶溶液稀釋至0.5 g/L,60 ℃水浴,0~10 min內每1 min取樣,10~40 min內每隔2 min取樣,取出的樣品置于10 ℃水浴冷敷。對所取樣品進行酶活力測定,通過Original 2018-Exponential-ExpDec1對殘余酶活力百分比進行非線性擬合,獲得擬合公式(1)后計算出酶活力下降至初始的50%所對應的時間即為半衰期。

(1)
1.2.8 巰基滴定法檢測二硫鍵生成
將蛋白樣品(非還原態TGase)用二硫鍵還原緩沖液稀釋至0.3 g/L,取2 mL TGase樣品與50 μL β-巰基乙醇混合,37 ℃熱處理1 h得到還原態TGase樣品,加入2 mL 三氯乙酸繼續孵育1 h后14 000×g離心10 min,取沉淀加入2 mL緩沖液溶液復溶得到還原態TGase。取1 mL還原態及非還原態TGase加入15 μL 2-對硝基苯甲酸,室溫放置20 min檢測412 nm處吸收光。根據公式(2)計算二硫鍵數量:
(2)
式中:n,二硫鍵數量;Ncys,半胱氨酸殘基數量;A412reduced,還原態TGase樣品在412 nm處吸光值;A412non-reduced,非還原態TGase樣品在412 nm處吸光值。
1.2.9 熔解溫度分析
稀釋TGase純蛋白溶液(溶劑為Tris-HCl,pH=8.0)至質量濃度為2 g/L,通過差示掃描量熱法進行熔解溫度測試。以蛋白所在溶劑作為內參,掃描溫度從40~90 ℃、升溫速率為1 ℃/min,壓力為303.975 kPa。
1.2.10 動力學參數測定
TGase樣品液稀釋至0.05 g/L,配制10份含不同濃度CBZ-Gln-Gly的底物溶液A(CBZ-Gln-Gly含量分別為3、6、9、12、15、18、21、24、27、30 mmol/L)。測定37 ℃反應10 min后各底物溶液A中CBZ-Gln-Gly的轉化量,通過Origin 2018-Growth/Sigmodial-Hill非線性擬合獲得Km和Vmax值,以酶濃度換算獲得kcat值及Km/kcat值獲得酶催化效率。
1.2.11 酶-底物分子對接
以S.mobaraenesisTGase晶體結構(PDB:1iu4)為模板,通過Discovery studio 2016 Macromolecule-Design Protein-Build Mutants模塊分別構建MS及MS-P22C-Q328C結構,利用Minimization模塊中的Smart minimizer對模擬結果進行能量最小化處理。底物CBZ-Gln-Gly構象從PubChem(https://pubchem.ncbi.nlm.nih.gov/compound/Z-Gln-Gly)獲得,并通過Discovery studio 2016轉為pdb文件。應用AutodockTools-1.5.6(ADT)分別對底物與酶進行柔性對接,對接盒子設定為50×50×50 ang。采用ADT對結果進行聚類分析,最終對接構象選擇依據如下:(1)對接構象來源于大類;(2)底物CBZ-Gln-Gly的4-氨基甲酰基團需與酶分子中β-SH基團滿足距離小于3;(3)對接構象在對應聚類中能量最低。
1.2.12 分子動力學模擬
應用Gromacs-2020分別對能量優化后的MS和MS-P22C-Q328C構象進行力場化和溶劑化處理,應用溶劑為水、力場為54a7、分子邊界為1.2 nm[18]。之后對體系進行能量最小化、升溫平衡(達到330 K),并進行10 ns的動力學模擬,溫度設定為330 K,對動力學模擬過程中的蛋白總體RMSD和各氨基酸RMSF進行分析,以獲得突變位點對蛋白結構的影響。
2 結果與分析
2.1 突變位點的選擇及突變體的表達
使用I-TASSER對MS突變體建模,通過Rossetta的StructureRelax進行結構優化,最終獲得的MS構象與野生型TGase構象RMSD相差為0.813。通過Disulfide by design 2.0對該結構進行二硫鍵突變模擬,結果給出55組可能形成二硫鍵的突變對。一般認為,二硫鍵成鍵自由能在一定程度上影響突變體的熱穩定性[19]。基于二硫鍵成鍵自由能的大小,將預測的55個二硫鍵突變體排序分為6組(表2)。前5組每組包含9個突變體,第6組包含10個突變體。每組抽取2個,共12個二硫鍵突變體(圖1-b),以保證其代表性。
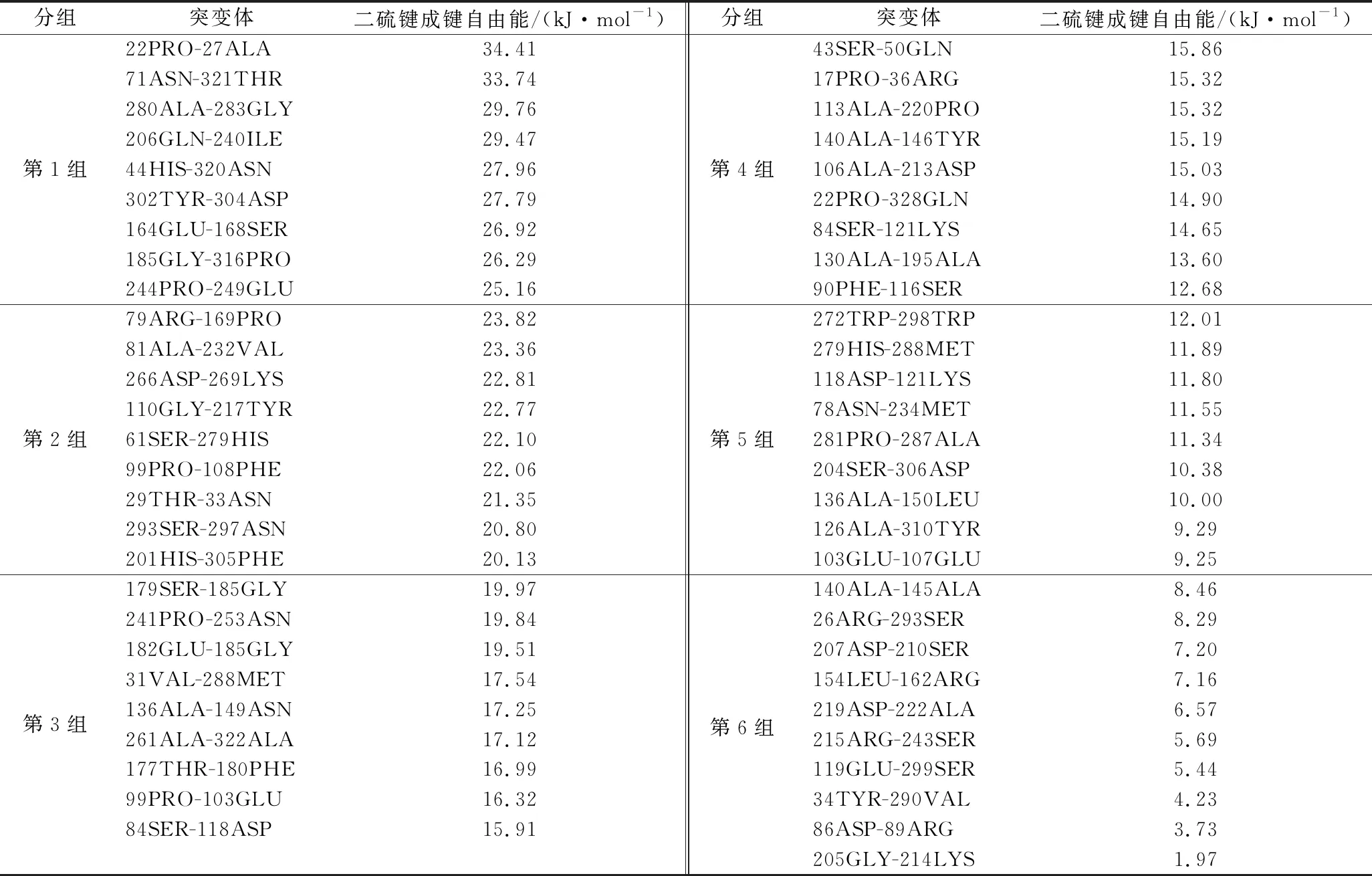
表2 基于成鍵能量對預測的二硫鍵突變體進行分組
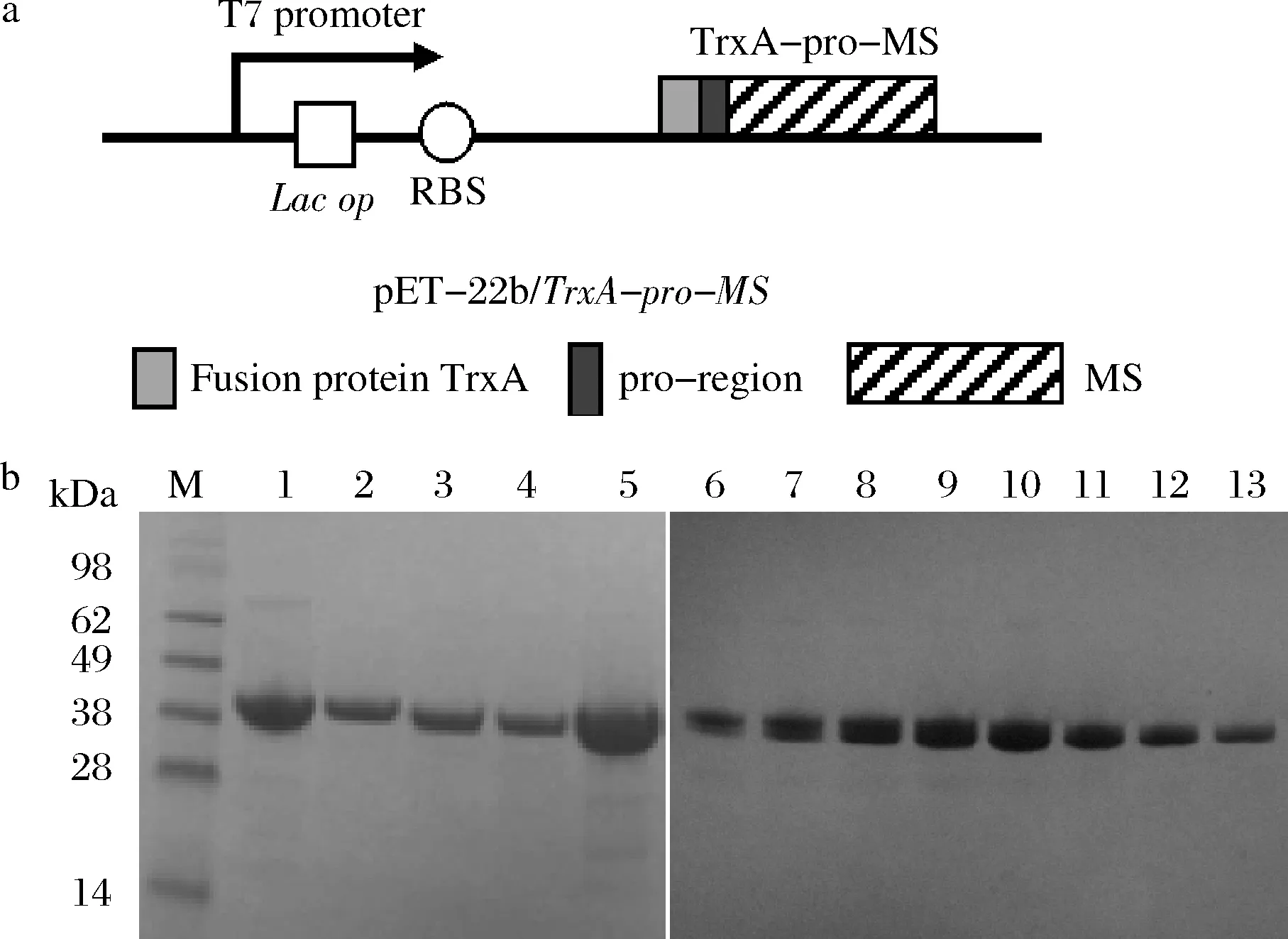
a-突變體pET-22b/TrxA-pro-MS表達框;b-含二硫鍵突變體純化后電泳圖
由于大腸桿菌E.coliBL21不利于二硫鍵的形成,故本研究在構建TGase表達框時選擇硫氧還原蛋白TrxA與pro-TGase進行共表達以促進二硫鍵的形成及TGase的正確折疊(圖1-a)。對挑選出的12對突變體進行構建、轉化及搖瓶發酵,對獲得的重組菌胞內可溶TGase進行體外活化及鎳柱純化得到TGase純蛋白。SDS-PAGE分析顯示,純化后的TGase蛋白條帶均一(圖1-b)。
2.2 高熱穩定型TGase 突變體的初篩及二硫鍵驗證
熱穩定性分析顯示,突變體MS于60 ℃水浴處理20 min后殘余酶活力32.9%。對12對突變體進行熱穩定性實驗,共有6對突變體殘余酶活力有所升高。其中,突變體D118C-K121C、P244C-E249C和P22C-Q328C殘余酶活力分別為58.36%、56.45%和62.86%,相較于MS分別提升了77.39%、71.58%和91.06%。突變體MS-P244C-E249C和MS-P22C-Q328C的比酶活略有下降(圖2)。

圖2 TGase突變體初始比酶活力及熱處理 (60 ℃ 20 min)后殘余酶活力
對熱穩定性提升最明顯的3對突變體,進行二硫鍵還原反應測定。結果如圖3所示,橫坐標表示突變體,縱坐標表示二硫鍵的數量,3種突變體均成功形成了分子內二硫鍵。后續實驗中,以熱穩定性提升最高的突變體MS-P22C-Q328C為研究對象,研究其穩定性提升狀態、催化效率變化及穩定性提升機制。

圖3 突變體二硫鍵測定
2.3 TGase突變體MS-P22C-Q328C酶學性質分析
2.3.1 突變體MS-P22C-Q328C半衰期和溫度穩定性測定
為進一步研究TGase突變體MS-P22C-Q328C的穩定性提升效果,進行半衰期及熔解溫度測定。2種蛋白在60 ℃水浴前5 min內殘余酶活力下降均比較快,之后殘余酶活力百分比差距逐漸增大(圖4-a)。經分析發現,突變體MS-P22C-Q328C的t1/2(60 ℃)達到了34.61 min,較MS(11.31 min)提升了2.06倍。差示掃描熱量測定,發現MS-P22C-Q328C的tm相較于MS提高了1.06 ℃(圖4-b)。
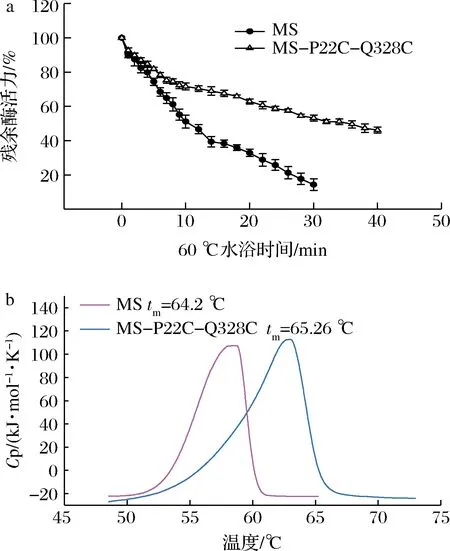
a-TGase突變體的半衰期曲線;b-TGase突變體的熔解溫度曲線
2.3.2 突變體MS-P22C-Q328C酶促反應動力學測定
本研究分別測試了TGase突變體MS及MS-P22C-Q328C的酶促反應動力學參數。通過梯度稀釋得到含不同濃度CBZ-Gln-Gly的底物溶液A,測試TGase突變體對不同濃度CBZ-Gln-Gly的轉化率。結果發現,MS對于低濃度CBZ-Gln-Gly具有較高的轉化效果,即Km值較低,而在實際催化效率上,即kcat差距不是很明顯(表3)。結果表明突變體的底物結合能力受到了一定的影響。
表3 TGase突變體的酶促反應動力學參數測定
2.3.3 突變體MS-P22C-Q328C突變位點分析
基于S.mobaraenesisTGase晶體結構,分別構建了MS和MS-P22C-Q328C的模擬結構。如圖5所示,MS-P22C-Q328C分子中的二硫鍵位于酶分子長Loop結構上。研究表明,強化蛋白質分子的loop區域的剛性可顯著提高其熱穩定性[20]。因此,在突變體MS-P22C-Q328C中,二硫鍵可能限制了Loop環擺動,從而提高了其熱穩定性[21]。值得注意的是,該Loop結構位于底物進入酶分子的通道[1],其剛性的增強可能影響了酶與底物結合,導致了MS-P22C-Q328C底物親和力和活性的下降的下降(表3)。

a-MS結構;b-MS-P22C-Q328C結構
為進一步解釋突變體MS-P22C-Q328C較MS活性下降的原因,以CBZ-Gln-Gly為底物進行對接分析。如圖6-a和圖6-b所示,MS及MS-P22C-Q328C與底物的結合能分別為-17.96和-17.50 kJ/mol,表明前者較后者與底物結合更緊密。事實上,MS與CBZ-Gln-Gly對接時CBZ基團指向酶分子的催化三聯體(C64-D255-H274)(圖6-c)。在MS-P22C-Q328C中,底物分子的CBZ基團則指向催化三聯體(圖6-d)。因此,MS-P22C-Q328C中二硫鍵可能改變了其底物結方式,降低了結合力。
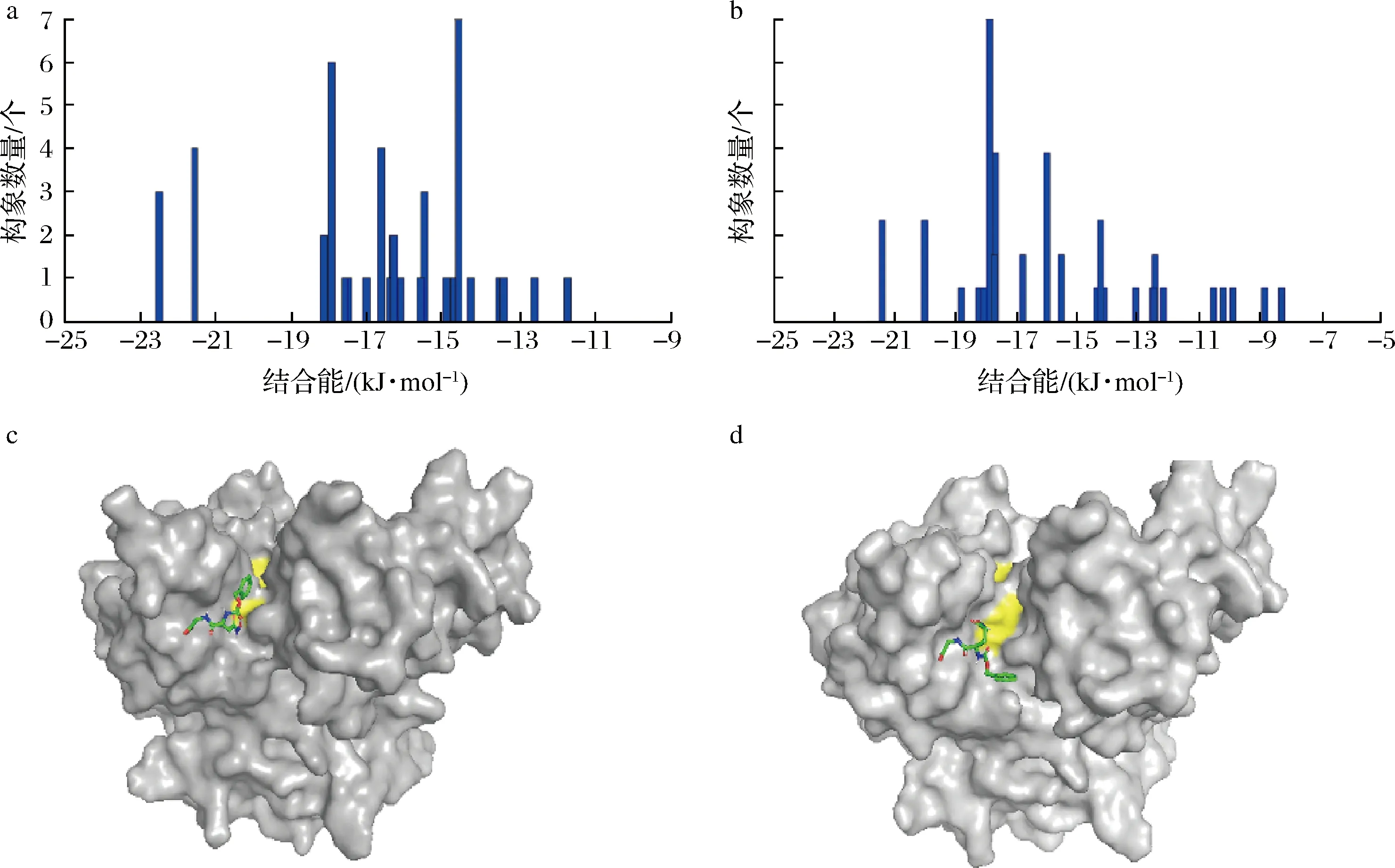
a-MS與底物對接聚類分析;b-MS-P22C-Q328C與底物對接聚類分析;c-MS與底物對接最終構象;d-MS-P22C-Q328C與底物對接最終構象
2.3.4 突變體MS-P22C-Q328C分子動力學模擬
分子動力學模擬作為反映蛋白分子運動的一個重要方法,可以用來解釋蛋白穩定性成因、蛋白與底物對接機制等。通過分子動力學中的升溫動力學分析TGase突變體在體系中運動的情況,基于MS對突變體MS-P22C-Q328C進行建模,并對兩者同時進行能量最小化處理和熱量平衡。后在330 K條件下進行動力學模擬10 ns。經動力學模擬后觀察TGase突變體的RMSD變化,發現突變體MS-P22C-Q328C的RMSD整體變化低于MS,說明其在高溫狀態下剛性更強,不易于變性(圖7-a)。通過對動力學模擬過程中,TGase突變體的各氨基酸位移變化分析,發現突變體MS-P22C-Q328C蛋白中區域15-32及311-330中氨基酸整體位移降低,即RMSF低于MS(圖7-b)。因此,可以推斷突變氨基酸對P22C-Q328C可有效地提高區域的剛性程度,從而提高蛋白整體穩定性。

a-TGase突變體動力學模擬過程中RMSD變化曲線;b-TGase突變體動力學模擬過程中RMSF變化曲線
通過對突變體MS-P22C-Q328C進行的酶學性質測定、分子結構分析及分子動力學模擬,可以認為發生在突變體MS結構中Loop環上P22C-Q328C兩處突變形成了二硫鍵,從而在一定程度上提升了TGase的剛性,有效提高了蛋白質的熱穩定性,同時保留了大部分的催化活性(MS-P22C-Q328C比酶活力為43.36 U/mg,相比于MS的50.01 U/mg僅降低13.29%)。
3 結論
為進一步提高TGase的熱穩定性,基于高穩定性TGase突變體MS構建了酶分子內二硫鍵,共獲得了3個穩定性明顯提升的二硫鍵突變體。60 ℃處理20 min,P244C-E249C、D118C-K121C和P22C-Q328C殘余酶活力分為56.45%,58.36%和62.86%。其中,MS-P22C-Q328C較MSt1/2(60 ℃)提高2.06倍,tm提高1.06 ℃。值得注意的是,P244C-E249C、D118C-K121C和P22C-Q328C成鍵自由能分別為25.16、11.80和14.90 kJ/mol。突變體二硫鍵成鍵自由能大小與蛋白質熱穩定性的相關性不明顯。
在理性設計二硫鍵的過程中,除了考慮二硫鍵成鍵自由能的大小,還需要結合可能形成二硫鍵的突變位點空間位置的距離(即成鍵后側鏈偏轉角度)以及原始氨基酸的柔性[15]。在預測二硫鍵過程中,成鍵自由能并不是影響突變體熱穩定性的主要因素。隨機抽取不同成鍵自由能的二硫鍵突變體進行構建后,發現最終對于TGase穩定性提高較明顯的二硫鍵突變體成鍵能適中,后續的基于構建分子內二硫鍵提升蛋白穩定性過程中還有其他重要因素有待挖掘。

