基于Arduino及其外圍傳感器控制高壓脈沖發生器用于細胞不可逆電穿孔實驗
張科,王杰
1 南京醫科大學,南京市,210029
2 江蘇省人民醫院 介入科,南京市,210029
0 引言
不可逆電穿孔(irreversible electroporation,IRE)是利用高壓脈沖電場使細胞膜出現不可逆性的穿孔造成細胞內外穩態失衡的現象,從而導致細胞凋亡[1]。2011年,美國Angio Dynamics公司利用這一原理研發出了商業化的IRE系統NanoKnife?(納米刀)用于腫瘤消融。IRE消融不同于射頻和微波利用連續的高頻電流產生的熱量消融,而是利用上千伏的微秒級間斷高壓脈沖電場消融,不會導致大量的熱量積累,被稱為非熱消融。常被應用于胰腺癌、前列腺癌、腦腫瘤等熱消融禁區,展示出不可替代的優勢和良好的療效[2]。
目前國內重慶、上海、天津等地相繼研發出相對成熟的IRE設備和控制系統[3-5],但出于知識產權的保護暫不對外提供相關硬件和技術支持,而美國IRE設備價格又過于高昂。面向臨床設計的IRE系統功率大、體積大、不便攜且參數專為人體特定腫瘤設計,往往不適合應用于實驗室和小動物等臨床前實驗。為此常需要自主研發實驗用機[6-7],無疑增加了研發難度、研發成本和周期。為了滿足現階段擬開展IRE基礎研究工作人員的需求[8-9],提出了一種過渡性的、可快速實現、簡易有效、低成本便攜式小型IRE測試和控制系統方案。該方案硬件系統包括一臺市售的成品小型脈沖高壓發生器、一塊Arduino開發板和一個外圍脈搏及溫度傳感器模塊。軟件平臺通過對Arduino編程實現心電觸發和溫度反饋功能,控制高壓脈沖按照IRE算法進行發放。進行了人肺癌細胞學體外測試,驗證了非熱IRE的發生,達到了實驗要求。
1 高壓脈沖發生器選型
實驗所用成品高壓脈沖發生器定制購自于大江方波科技公司,型號:IGBT-897G,價格只需400元左右。具體參數:功率800 W,輸入電壓:12 V DC,脈沖輸出電壓:600~1 200 V可調,最大輸出電流65 A,脈寬20 μs~2 ms可調,釋放頻率50~300 Hz可調。脈沖釋放方式:輕觸開關手動觸發。該機型前級采用高頻PWM驅動芯片將輸入的直流電逆變為交流電,經變壓器升壓后再整流濾波電容儲能,后級采用IGBT驅動芯片驅動IGBT管釋放高壓方波脈沖。具有過流保護、短路保護、過熱保護、穩壓輸出等功能。這種結構的高壓脈沖發生與商業化IRE設備結構和原理類似,方波輸出效率高、機器質量輕、功率和電流儲備充足。接實驗負載,示波器波形驗證,電壓輸出穩定在設定值,方波波形規則,如圖1所示。頻率和脈寬參數均符合出廠預設值。

圖1 高壓方波脈沖波形Fig.1 High voltage square wave pulse waveform
2 脈沖釋放的控制
由于定制的高壓脈沖發生器和市售大部分該類小功率高壓脈沖發生器一樣,只能手按開關在出廠預設固定頻率內連續釋放脈沖串,不僅導致產生的熱量不可控,也不符合IRE算法臨床治療中一個心電周期在R波有效安全不應期內釋放一個脈沖的要求[10]。因此,需要對這臺高壓脈沖源加裝熱反饋和心電觸發控制系統。使其能夠按照IRE算法進行釋放脈沖,同時增加溫度閉環反饋,監測目標區溫度實現超溫停止釋放脈沖。通過這種方式,可以根據需求對市面帶有手動釋放開關的、不同功率參數的成品高壓脈沖發生器實現控制。該控制系統的程序設計流程,如圖2所示。
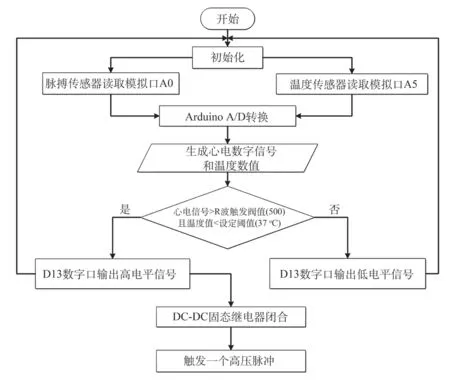
圖2 脈沖控制程序流程Fig.2 Programme flow diagram of pulse control
選擇Arduino UNO R3開發板作為控制單元是因為其開源化的硬件和軟件平臺[11-12]。硬件內置A/D轉換,支持豐富的外圍傳感器。Arduino IDE軟件支持相關庫文件調用和例程參考,在此基礎上進行二次開發,大大縮短了研發周期。
實驗選用的脈搏傳感器模塊型號為PulseSensor XD-58C。實物如圖3所示。其本質是一種反射式光電信號傳感器。其原理是通過檢測綠色LED發出的光隨血管容積的變化,光的吸收量也發生變化,從而得到了脈搏波[13],輸出波形如圖4所示。模塊為三線制,分別為模擬信號輸入端、5 V供電端和GND端。模擬口采集到的光電模擬信號經A/D轉換成0~1 024之間的數值,以模塊推薦的550作為R波觸發條件,兼顧靈敏和準確性。但實際上大于550的觸發時間長達數十毫秒,在此時間范圍內,會造成多個脈沖的發放。為了精準發放一個脈沖,采用Delay延時函數控制Arduino數字口觸發電平高低時間繼電高壓脈沖控制開關時間。例如,在高壓脈沖發生器釋放頻率300 Hz的條件下,即一個周期約為3.33 ms。將有效高電平時間控制在3.33 ms內即可實現每次觸發釋放一個脈沖。將Arduino D13 I/O口作為高電平信號觸發輸出端,可以通過板載LED的閃爍頻率和時間長短觀察搏動周期和觸發時間,與高壓脈沖發生器受控端口通過3~50 V DC-DC固態繼電器相連,即可實現心電信號控制一個脈沖的發放。

圖3 光電式脈搏傳感器實物圖Fig.3 Figure of photoelectric pulse sensor

圖4 脈搏傳感器串口輸出波形Fig.4 Serial output waveform of pulse sensor
實驗選用的溫度傳感器模塊型號為YL-38,如圖5(a)所示。原理是利用一個10 kΩ NTC熱敏電阻和10 kΩ電阻串聯后利用熱敏電阻探頭上的分壓模擬量轉換為數字量,再通過 Steinhart-Hart方程轉換為溫度數值。該模塊有四個端口,分別為模擬量輸入口、數字量輸入口、5 V供電端和GND端,數字量輸入口通過模塊上LM393比較器超溫可觸發其LED點亮,可以不接。目前IRE熱效應檢測主要采用光纖測溫設備[14],因光纖探頭不導電,可以避免電磁干擾,但設備價格過于高昂。該方案溫度傳感器為防止電磁干擾造成溫度測量不準和電場不均勻,需替換原有10 kΩ熱敏探頭,更換為直徑0.8 mm珠型高靈敏環氧塑封絕緣探頭(上海領技公司,R=10 kΩ,B=3 950,精度1%),如圖5(b)所示。引線延長加絕緣處理,如圖5(c)所示。

圖5 溫度傳感器及其替換探頭Fig.5 Temperature sensor and replacement of probe
接入Arduino寫入測溫程序,用4~100oC之間的水溶液多次測試,溫度響應迅速,和熱電偶、電導率儀以及水銀溫度計測得的溫度誤差在0.5oC以內。脈沖釋放中工作穩定,溫度隨脈沖的發放呈鋸齒狀上升。脈沖按心率釋放時測試液溫度曲線,如圖6所示。溫度傳感器將實時采集的溫度數據反饋給Arduino,協同脈搏傳感器一同控制脈沖發放。未達溫度閾值上限時,滿足脈搏傳感器觸發條件時D13口置高電平觸發脈沖釋放。超過溫度上限時,置低電平停止觸發,待溫度降至閾值以下時再次觸發。該實驗在常溫下28oC下進行,可選擇37~40oC之間作為溫度上限,從而保證細胞不會因為熱效應致死,便于評估IRE的殺傷效應。

圖6 脈沖按心率釋放時測試液溫度曲線Fig.6 Temperature curve of test fluid when pulse releasedaccording to heart rate
3 細胞學體外測試驗證
將體外培養的人肺癌細胞A549培養基和磷酸鹽緩沖液等比例混合制成細胞懸液,測得混懸液電導率為0.8 S/m。取400 μL混懸液加樣至48孔細胞培養板中,采用5 mm間距電極針放入各孔連接高壓脈沖發生器輸出端,輸入觸發電平控制端接入Arduino開發板和脈搏、溫度傳感器,各硬件之間連接,如圖7所示。
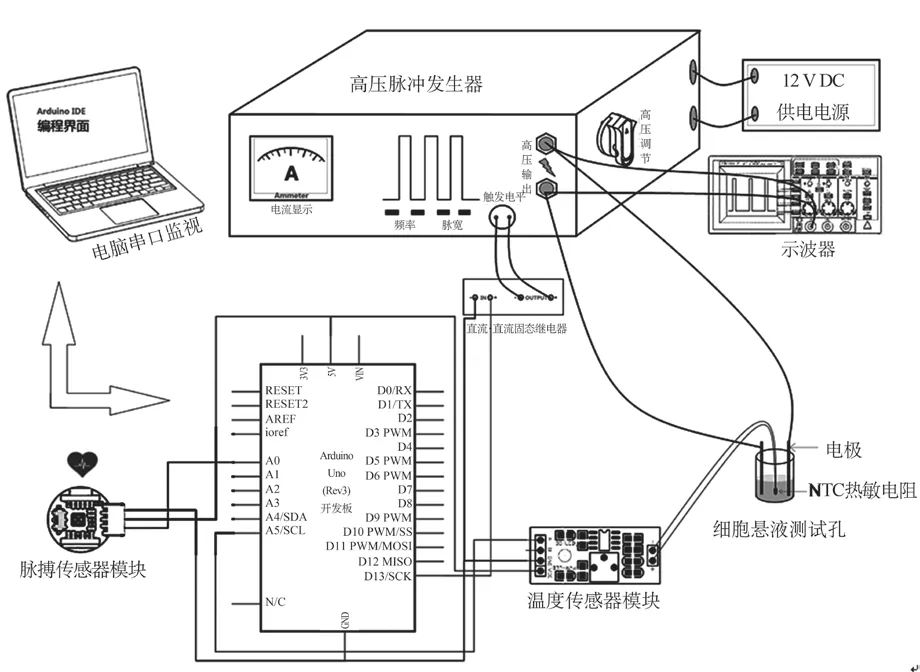
圖7 硬件連接示意圖Fig.7 Hardware connection diagram
上電后高壓脈沖發生器按照心電觸發和溫度反饋控制程序釋放脈沖,記錄電壓、脈寬、脈沖個數等數據。脈沖電場處理后的細胞繼續培養24 h排除部分細胞可逆性的穿孔,然后進行臺盼藍染色和活死細胞計數篩選最佳參數條件。臺盼藍活死細胞染色原理:活細胞細胞膜完整,臺盼藍染料拒染;死細胞細胞膜穿孔,染料進入細胞內將細胞染成藍色。應用Countstar IC1000型自動細胞計數儀實現對活死細胞的計數,重復測試20孔,計算細胞穿孔率的平均值。在Arduino及其傳感器控制和反饋下,高壓脈沖發生器在電壓600 V、場強1 200 V/cm,釋放100個脈寬100 μs的脈沖的參數下,95%以上的細胞出現非熱性的IRE,如圖8所示,(a)為處理前活細胞拒染,(b)為處理后大部分細胞穿孔被染色。

圖8 脈沖電場處理前后的細胞染色Fig.8 Cell staining before and after pulsed electric field treatment
4 結語
本實驗提出的Arduino聯合其外圍傳感器控制高壓脈沖發生器并用于IRE實驗的方案實現簡單,所需硬件皆為成品,易于購得,成本低廉。控制反饋程序簡單,無需額外開發上位機軟件。經體外實驗測試,系統運行平穩,按照目前應用于臨床的IRE算法實現了非熱IRE。本小型系統具有輕便可移動、開源易實現、算法可調便于二次開發等優點,尤其適用于資源和資金缺乏的高校醫學及生物醫學工程專業研究生IRE研究入門和改進。在方案基礎上進一步完善和優化,使其不但能夠應用于不同細胞IRE參數篩選和優化、三維細胞組織膠IRE電場量效關系研究、電化學、電熱效應、電誘導免疫學、組織病理學、組織阻抗和電導率等IRE相關體外實驗,也能進一步安全有效地應用于動物體內小病灶IRE組織消融方面的實驗研究。

