紅景天苷對人肺腺癌PC9細胞的上皮-間質轉化作用*
張鵬,孫婉瑾,李嫚,徐玉婷
(1.湖北省中醫院藥事部,武漢 430074;2.湖北省腫瘤醫院中西醫結合科,武漢 430079)
肺癌仍是目前死亡率最高的惡性腫瘤之一。許多肺癌患者在就診時已發生轉移,多數肺癌患者死亡是由癌細胞轉移引起[1],最近研究[2-3]表明上皮-間質轉化(epithelial-mesenchymal transition,EMT)在腫瘤侵襲轉移過程中起重要作用。EMT是指上皮細胞失去其上皮特征,獲得間質特性的過程,它不僅參與胚胎形態的形成、心臟的發育和慢性退行性纖維化,而且促進腫瘤侵襲轉移[4-5]。
紅景天苷(Salidroside)的化學名為對羥基苯乙基-β-D-葡萄糖苷,其苷元為對羥基苯乙醇,即酪醇。紅景天苷具有廣泛的生物活性,如抗炎、抗腫瘤、免疫調節,促進骨骼肌生長、抗氧化、增體質、抗疲勞、抗肌萎縮,保護肝臟、神經、肺、呼吸道、心臟以及降血糖、調血脂、抗肥胖等作用。WANG等[6]證實了紅景天苷對肺癌A549細胞的抑制作用是抑制了胞內氧化應激反應與磷酸化p38的表達。但紅景天苷對肺癌細胞的研究鮮有報道。本研究以非小細胞肺癌PC9細胞為研究對象,以一定濃度的轉化生長因子β1(Transforming growth factor-β1,TGF-β1)處理后,給予不同濃度紅景天苷處理,觀察其對肺腺癌PC9細胞EMT的影響。
1 材料與方法
1.1材料及試劑 人肺腺癌PC9細胞為上海肺科醫院肺癌免疫研究室常規傳代培養;小鼠抗人上皮細胞鈣粘蛋白(E-cadherin)、神經型鈣粘蛋白(N-cadherin)、波形蛋白(Vimentin)、平滑肌肌動蛋白-α(α-SMA)、β-連環蛋白(β-catenin,美國Abcam公司,批號分別為Ab76055,Ab18203,Ab8978,Ab7817,Ab32572)。羊抗小鼠IgG(武漢Bioswamp公司,批號:PAB150009);DMEM(美國Hyclone公司,批號:SH30022.01B);TGF-β1(美國Peprotech公司,批號:100-21);纖維連接蛋白(FN)(北京Solarbio公司,批號:F8180);紅景天苷(北京Solarbio公司,批號:SS8080,純度HPLC≥98%)。紅景天苷用DMSO溶解后,作用于細胞的濃度現配(1,5,10 和20 μg·mL-1)。
1.2儀器 酶標儀(美國Thermo公司,型號:Multiskan FC),恒溫培養箱(美國Thermo公司,型號:311),顯微鏡(日本Nikon公司,型號:TS100-F),流式細胞儀(美國Beckman公司,型號:FC500 MCL)。
1.3細胞培養 肺腺癌PC9細胞在37 ℃、5% CO2、飽和濕度條件下用含10%新生牛血清、100 U·mL-1青霉素、100 μg·mL-1慶大霉素、低糖-DMEM培養基中培養。用0.25%胰酶消化傳代。細胞培養至融合70%~80%后,用無血清培養基饑餓過夜,再加入TGFβ1誘導細胞上皮間質轉化處理48 h,按實驗要求分為6組:對照組,TGF-β1刺激組,刺激+紅景天苷組1 μg·mL-1(sali 1 μg·mL-1組),刺激+紅景天苷組5 μg·mL-1(sali 5 μg·mL-1組),刺激+紅景天苷組10 μg·mL-1(sali 10 μg·mL-1組),刺激+紅景天苷組20 μg·mL-1(sali 20 μg·mL-1組),肺腺癌PC9細胞在5 ng·mL-1的TGF-β1刺激30 min后,再給予紅景天苷干預,分別在干預后24,48,72 h后進行MTT檢測,在各時間段顯微鏡下觀察細胞形態,并攝像記錄。
1.4MTT繪制生長曲線 取對數生長期的細胞,接種于96孔板,每孔細胞密度約1.0×104個,放入CO2培養箱中培養24 h。每孔內加入MTT(5 mg·mL-1)10 μL,培養箱內孵育4 h,棄去每孔的液體,并以每孔150 μL的計量加入二甲亞砜,震蕩5~10 min,使甲臜顆粒充分溶解。使用酶標儀檢測490 nm及570 nm的吸光度(A)值,以時間為橫坐標,A值為縱坐標繪制生長曲線。
1.5流式檢測細胞凋亡 取對數生長期的人肺腺癌PC9細胞,制成單細胞懸液,按每孔1.0×104個,將細胞均勻的接種到6孔板中,37 ℃、5%CO2飽和濕度條件培養過夜;用不含EDTA的0.25%胰酶消化細胞,終止消化后收集細胞,1000 r·min-1,離心5 min,去上清液,PBS重懸潤洗2次;1000 r·min-1,離心5 min,去上清液,PBS重懸細胞100 μL,緩慢加入預冷的80%乙醇700 μL,使乙醇終濃度為70% 4 ℃固定4 h以上,1000 r·min-1,離心5 min,預冷PBS潤洗2次,加入100 μL RNase(50 μg·mL-1),37 ℃水浴30 min加入PI(50 μg·mL-1)400 μL,4 ℃避光染色30 min流式細胞儀檢測。
1.6Western blotting 分析 冰面上RIPA蛋白裂解液裂解細胞,每5 min振蕩1次,裂解 20 min,4 ℃下15 000 r·min-1,離心30 min,吸取上清液獲取總蛋白。根據BCA蛋白定量結果上樣,10% SDS-PAGE凝膠電泳2.5 h,轉膜后NC膜TBS稍蕩洗,5% 脫脂奶粉室溫封閉1 h,4 ℃下分別孵育E-cadherin、N-cadherin、Vimentin、a-SMA、β-Catenin一抗過夜,TBST洗10 min×3次,室溫孵育二抗1 h,TBST洗10 min,重復3次,曝光顯影;采用 BIO-RAD Image Lab 版統計軟件進行灰度值分析。
1.7統計學方法 使用SPSS17.0版統計軟件處理數據,計量組間比較采用單因素方差分析,以P<0.05為差異有統計學意義。
2 結果
2.1細胞生長曲線 與Con組比較,TGF-β1組細胞增殖能力顯著上升(t=207.277,P<0.05)。與TGF-β1組比較,sali 1 μg·mL-1、sali 5 μg·mL-1組、sali 10 μg·mL-1組和sali 20 μg·mL-1組的細胞增殖力均顯著降低(F=1665.398,P<0.05)。見圖1。

圖1 細胞生長曲線
2.2細胞凋亡 與Con組[(4.58±0.27)%]比較,與TGF-β1組[(6.21±1.61)%]的凋亡率上升,但差異無統計學意義(t=1.741,P>0.05)。與TGF-β1組比較,sali 1 μg·mL-1組[(7.33±1.11)%]凋亡率差異無統計學意義(t=0.987,P>0.05);sali 5 μg·mL-1組[(13.71±1.66)%],sali 10 μg·mL-1組[(26.15±0.83)%]和sali 20 μg·mL-1組[(28.33±1.11)%]的細胞凋亡率均顯著升高(F=180.969,P<0.05),且在一定范圍內,凋亡率隨著藥物劑量的增加而增加。sali 10 μg·mL-1組和sali 20 μg·mL-1組細胞凋亡率均顯著高于sali 5 μg·mL-1組和sali 1 μg·mL-1組。見圖2。
2.3細胞形態觀察 Con組細胞形態多成橢圓形或者圓形,而經過TGF-β1處理后,大部分細胞形態都明顯拉長,細胞呈梭形,相鄰細胞間連接也變得疏松。sali 1 μg·mL-1組的細胞形態和TGF-β1組形態相似,而sali 5 μg·mL-1組,sali 10 μg·mL-1組和sali 20 μg·mL-1組的細胞形態均多半呈橢圓形,細胞之間連接緊密。見圖3。
2.4相關標記蛋白的表達 與Con組比較,TGF-β1組的N-cadherin、FN、Vimentin、α-SMA的表達顯著上升(t=66.452,403.664,161.580,136.670,P<0.05),而E-cadherin、β-catenin的表達顯著降低(t=261.827,154.260,P<0.05)。與TGF-β1組比較,sali 1 μg·mL-1組、sali 5 μg·mL-1組、sali 10 μg·mL-1組和sali 20 μg·mL-1組的N-cadherin、FN、Vimentin、α-SMA的表達均顯著降低(F=53 988.214,82 179.748,33 362.584,64 734.791,P<0.05),而E-cadherin、β-catenin的表達顯著升高(F=54 726.455,63 095.118,P<0.05)。見圖4和表1。

圖2 6組細胞凋亡率

圖3 6組細胞形態
3 討論
腫瘤細胞的侵襲和轉移是惡性腫瘤發展的重要步驟,是導致惡性腫瘤患者死亡率高的重要原因[7]。因此,為了控制惡性腫瘤的轉移,研究腫瘤轉移的機制和特點十分有必要。腫瘤轉移是復雜的過程,首先腫瘤細胞脫離原發病灶,通過血管生成和基底膜重建進入循環系統,經淋巴管、血管,抵達靶器官,形成轉移腫瘤[8-9]。進入循環系統的腫瘤細胞要到達靶器官要克服循環系統的種種障礙,而EMT能令上皮細胞表型和表面抗原均發生改變,增強細胞的遷徙能力,促進腫瘤細胞的轉移[10]。上皮細胞之間連接緊密,游離面和基底面均有顯著極性,且高度有序,形態相對穩定一致[11-12];EMT的發生使細胞間緊密的連接被打破,失去了原有的有序性,穩定性和極性,呈現出形態各異,排列松散的間質細胞特性。本研究首先探討了紅景天苷對肺腺癌PC9細胞增殖和凋亡影響,發現sali 5 μg·mL-1組,sali 10 μg·mL-1組和sali 20 μg·mL-1組的細胞增殖力下降且凋亡率顯著升高,表明紅景天苷可以抑制肺腺癌PC9細胞的增殖并促進凋亡;進一步,筆者通過細胞形態觀察發現,Con組細胞形態多成橢圓形或者圓形,經過TGF-β1處理后,相鄰細胞間連接也變得疏松。而經過紅景天苷處理的細胞形態多半呈橢圓形,細胞之間連接較緊密,提示紅景天苷減少肺腺癌PC9細胞EMT的發生。

1.Con組;2.TGF-β1組;3.sali 1 μg·mL-1組,4.sali 5 μg·mL-1組,5.sali 10 μg·mL-1組,6.sali 20 μg·mL-1組。
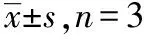
表1 6組相關標記蛋白的相對表達量
在腫瘤惡性程度進展的過程中上皮細胞表面標記蛋白E-cadherin下調,表明腫瘤細胞的粘附能力下降,運動和浸潤能力增強[13-15],而在神經系統和間質細胞中表達的N-cadherin上調[16]。Vimentin和α-SMA是間質樣細胞的標志性分子,通常在上皮細胞中不表達。具有高侵襲性的非小細胞肺癌(NSCLC)細胞則通常伴有Vimentin和α-SMA的高表達,而將細胞中Vimentin或α-SMA沉默之后,細胞明顯減弱甚至失去侵襲遷移能力[17-18]。在本研究中,sali 5 μg·mL-1組,sali 10 μg·mL-1組和sali 20 μg·mL-1組的Vimentin和α-SMA的表達均顯著降低,而E-cadherin的表達顯著升高,N-cadherin顯著降低,提示TGF-β1組的細胞發生上皮細胞向間質細胞的轉化,經不同濃度紅景天苷處理后,sali 5 μg·mL-1組,sali 10 μg·mL-1組和sali 20 μg·mL-1組的Vimentin,FN,α-SMA表達下調,提示細胞的EMT減弱,紅景天苷能明顯減少肺腺癌PC9細胞EMT的發生,預防腫瘤細胞的遷移和侵襲,與形態學觀察的結果一致。
β-catenin蛋白肽鏈中部arm區域,可以和E-cadherin、上皮生長因子受體(EGFR)等蛋白結合而發揮多種功能[19]。β-catenin對細胞的轉移和EMT有關鍵的調控作用,同時也是Wnt信號通路中的關鍵蛋白[20],其在細胞質中的濃度直接影響著Wnt信號通路。在正常的上皮細胞中,細胞核內β-catenin含量較少,大量的外源性轉錄因子并不能引發細胞的EMT現象,而在腫瘤細胞中,由于β-catenin的調控系統障礙使β-catenin在核內聚集,外源性的轉錄因子可以誘導細胞發生的EMT改變。另一方面,β-catenin和E-鈣黏素胞內區相連,形成β-catenin/E-cadherin復合體,該復合體在維持上皮極性,穩定性和完整性中發揮重要作用[21]。本研究中sali 20 μg·mL-1組β-catenin表達顯著升高,說明紅景天苷通過上調β-catenin抑制細胞中EMT的發生。
綜上所述,TGF-β1可誘導肺癌細胞上皮細胞向間質細胞轉變,紅景天苷可能通過上調β-catenin抑制肺癌細胞中EMT的發生,減少間質細胞的數量,延緩腫瘤細胞的遷移。

