分子對接和光譜法研究原兒茶醛和阿魏酸與牛血清白蛋白的互作機理
呂艷芳,梁倩倩,郭雨晴,李學鵬,劉欣欣,沈 琳,勵建榮,
(1.渤海大學食品科學與工程學院,遼寧 錦州 121013;2.上海交通大學分析測試中心,上海 200240;3.大連東霖食品股份有限公司,遼寧 大連 116007)
多酚是指存在于植物體內、化學結構中包含多個酚羥基的一類化合物的總稱。多酚類物質是重要的功能性成分,具有抗氧化、抗菌和抗癌等多種功能,而這些功能可能是由于多酚與體內的蛋白質、脂質等靶分子直接或間接相互作用所致[1]。目前,關于多酚的研究報道有很多,Chen Xiaowei等[2]研究了蘆丁對大豆蛋白界面性能和乳液穩定性的影響。黃淵等[3]分別研究了白藜蘆醇、表沒食子兒茶素(epigallocatechin,EGC)和沒食子酸酯(epigallocatechin gallate,EGCG)對鰱魚肌球蛋白(silver carp myosin,SCM)空間結構的影響。
原兒茶醛(protocatechuic aldehyde,PCA)的結構如圖1A所示,化學名稱為3,4-二羥基苯甲醛,多見于烏蕨、四季青和丹參的根葉部,具有多種生理活性。近年來,對于PCA的研究主要集中在醫藥領域。祝友文等[4]和高麗[5]分別研究發現PCA對環磷酰胺引起雄性小鼠的生殖損傷和順鉑介導的小鼠急性腎臟損傷具有保護作用。張寒等[6]發現PCA具有舒張血管的功能。另外,PCA也是合成其他香料和藥物的中間體[7]。PCA由于具有鄰二酚母核結構而展現出顯著的抗氧化活性,Bountagkidou等[8]通過研究添加5 種天然多酚防腐劑的木桶裝紅酒的抗氧化活性,發現只有PCA在所有測定環境中均對紅酒表現出高抗氧化活性,因此有望將其用作食品抗氧化劑,但目前PCA在食品領域的研究及應用都比較少,這可能與其作用機制不明有一定關系。
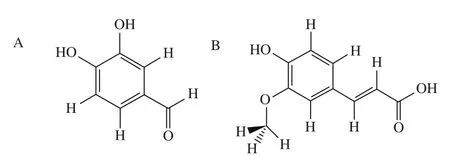
圖1 PCA(A)、FA(B)結構式Fig.1 Chemical structures of PCA (A) and FA (B)
阿魏酸(ferulic acid,FA)的結構如圖1B所示,化學名稱為4-羥基-3-甲氧基肉桂酸,主要存在于麥麩等谷物和川芎等中草藥中。FA的熱穩定性和化學穩定性良好,且毒性較低,又因其具有良好的藥理作用和生物活性,越來越多的國家開始將其用于食品、醫藥等各個領域。李黎云[9]發現在待宰育肥豬的日糧中添加FA,會增加豬肉產品的嫩度,且延長保質期。魏延玲等[10]發現,FA能夠抑制風干鱸魚中N-二甲基亞硝胺的生成以及微生物的生長繁殖,并能有效清除鱸魚中殘留的亞硝酸鹽,從而降低人類患高血壓、癌癥等疾病的機率。饒文婷等[11]發現FA能夠調節腸道菌群。近年來,FA的多功能性使其成為食品添加劑領域的研究熱點[12],因此對其作為食品添加劑的安全性進行評估至關重要,通過研究FA與生物大分子的相互作用,從而深入理解FA結構變化對其毒理性質和功能特性的影響,對新型天然食品添加劑的開發有重要的意義。
人血清白蛋白(human serum albumin,HSA)是血液中的多功能轉運蛋白,能可逆結合小分子物質并將其運送到人體需要的各個部位。牛血清白蛋白(bovine serum albumin,BSA)在序列和構象上與HSA具有高度同源性和相似性,且價格相對比較便宜,因此被廣泛應用于小分子物質與血清蛋白的研究中[13]。隨著計算機模擬技術的迅速發展以及更多蛋白質三維結構的解析,分子對接已經成為研究小分子物質與蛋白質相互作用的重要手段。Cheng Hao等[14]應用光譜法結合分子對接技術對比研究了順式、反式白藜蘆醇與BSA的相互作用。Das等[15]應用該技術研究了EGCG與牛血紅蛋白(hemoglobin,HGB)的相互作用。
利用分子對接技術研究蛋白質與多酚間的相互作用,并同光譜實驗的結論進行分析、比較從而互相驗證、補充,進而能夠從實驗和理論研究其相互作用。目前,關于PCA和FA與大分子相互作用的機理研究較少,并且在食品領域的應用范圍也較小,為使其在食品加工、貯藏保鮮等多個領域中像EGCG、茶多酚和白藜蘆醇等多酚一樣被廣泛應用,本實驗應用紫外光譜、熒光光譜、同步熒光光譜以及分子模擬技術綜合分析PCA和FA與BSA相互作用的機制,有助于在分子水平上了解其與蛋白質的相互作用,最終為PCA和FA在食品領域的廣泛應用提供參考。
1 材料與方法
1.1 材料與試劑
PCA、FA(純度≥99%) 上海阿拉丁生化科技股份有限公司;BSA(純度≥98%) 美國Sigma公司;磷酸二氫鉀、磷酸氫二鈉(均為分析純) 上海國藥集團化學試劑有限公司。
1.2 儀器與設備
MS105DU電子分析天平、FiveEasy Plus FE28 pH計瑞士梅特勒-托利多公司;KX-1990超聲波清洗儀 北京科璽有限公司;DK8D電熱恒溫水浴鍋 上海一恒科技有限公司;UV2550紫外-可見分光光度計 日本島津公司;FluoroMax-4熒光光度計 法國HORIBA公司。
1.3 方法
1.3.1 紫外光譜法測定PCA和FA與BSA的相互作用
于7 支試管中分別移取質量濃度2.5×10-3g/mL的BSA溶液0.5 mL和濃度為1.0×10-4mol/L的PCA、FA溶液分別0.00、0.25、0.50、0.75、1.00、1.25、1.50 mL,最后用磷酸鹽緩沖溶液(phosphate buffered saline,PBS)(0.067 mol/L,pH 7.4)稀釋,使多酚的終濃度分別為0、5×10-6、10×10-6、15×10-6、20×10-6、25×10-6、30×10-6mol/L,BSA終質量濃度為2.5×10-4g/mL,充分混勻后,于298 K靜置10 min,使用紫外分光光度計進行光譜掃描200~800 nm的范圍,以濃度為0 mol/L的PCA、FA溶液作為對照。
1.3.2 熒光光譜法測定PCA和FA與BSA的相互作用
取3 組試管,每組8 支,分別加入質量濃度為2.5×10-3g/mL的BSA溶液0.5 mL和1.0×10-4mol/L的PCA、FA溶液分別為0、0.25、0.50、0.75、1.00、1.25、1.50、1.75 mL,以PBS(0.067 mol/L,pH 7.4)定容,使多酚終濃度分別為0、5×10-6、10×10-6、15×10-6、20×10-6、25×10-6、30×10-6、35×10-6mol/L,BSA終質量濃度為2.5×10-4g/mL,充分混勻后,將第1組混合溶液于298 K靜置10 min,第2組于310 K恒溫水浴10 min,第3組于320 K恒溫水浴10 min,使用熒光光度計進行光譜掃描,在激發波長281 nm、狹縫寬度5 nm、掃描范圍280~450 nm的條件下檢測,并以PCA、FA濃度均為0 mol/L的溶液作為對照。
1.3.3 熒光猝滅計算
通過Stern-Volmer方程(1)計算猝滅常數的變化,以判斷PCA和FA對BSA的熒光猝滅類型;采用雙對數方程(2)計算PCA和FA分別與BSA相互作用的結合常數Ka和結合位點數n;使用熱力學方程(3)和(4)計算PCA和FA分別與BSA相互作用的熱力學參數[16]。
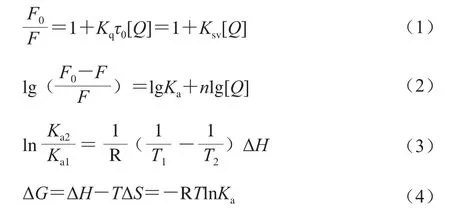
式中:F0為對照組的熒光強度;F為PCA和FA濃度為Q時BSA的熒光強度;[Q]為PCA和FA的濃度/(mol/L);Ksv為動態猝滅常數/(L/mol),可由F0/F對[Q]的斜率求得;Kq為猝滅速率常數/(L/(mol·s));τ0為猝滅劑不存在時生物大分子的平均熒光壽命(約為10-8s);ΔG為自由能變/(kJ/mol);ΔH為焓變/(kJ/mol);ΔS為熵變/(J/(mol·K))。
1.3.4 同步熒光光譜法測定PCA和FA與BSA的相互作用
BSA和多酚溶液處理方法同1.3.1節所敘述的方式。以波長差(Δλ)分別為15 nm和60 nm、狹縫寬度:1 nm、掃描范圍:200~400 nm的條件進行同步熒光檢測。
1.3.5 分子對接
從PDB數據庫(http://www.rcsb.org/pdb)搜索ID編號:“4F5S”的BSA晶體結構并下載[17],利用PyMol軟件對BSA進行去亞基、去水和刪除小分子配體等操作,并保存成PDB格式;從PubChem數據庫(https://pubchem.ncbi.nlm.nih.gov/)獲取PCA(CID:8768)和FA(CID:445858)的二維結構[18],運用ChemDraw軟件對其進行能量優化并保存成PDB格式,然后利用AutoDock軟件對BSA、PCA和FA進行加氫、計算電荷等前處理步驟后,保存成PDBQT格式,最后使用AutoDock-vina軟件進行分子對接,對接結果采用Discovery Studio 2017 R2 Client、PyMol軟件進行處理。
2 結果與分析
2.1 PCA和FA與BSA相互作用的紫外光譜分析
298 K時不同濃度的PCA和FA分別與BSA相互作用的紫外光譜結果如圖2所示,當PCA和FA為0 mol/L時,BSA在276 nm波長處有一強吸收峰,這主要是由BSA的酪氨酸(tyrosine,Tyr)、色氨酸(tryptophan,Trp)殘基的苯環π→π*躍遷產生[19]。PCA和FA濃度在0~30×10-6mol/L的范圍時,隨著PCA和FA濃度的增加,BSA在276 nm波長處的吸收峰強度不斷增大,且波長從276 nm紅移至280 nm,說明PCA和FA的加入使BSA分子內部的Trp、Tyr殘基裸露于水相中,疏水殘基間的疏水作用力減弱,從而與BSA形成復合物,導致BSA的共軛程度增強,產生了新的π→π*躍遷,最終引起BSA紫外吸收強度增大,吸收峰紅移[20]。動態猝滅不引起蛋白質吸收峰波長改變,而靜態猝滅則會導致吸收峰波長改變[21]。因此,初步判斷PCA和FA對BSA的猝滅過程均為靜態猝滅。
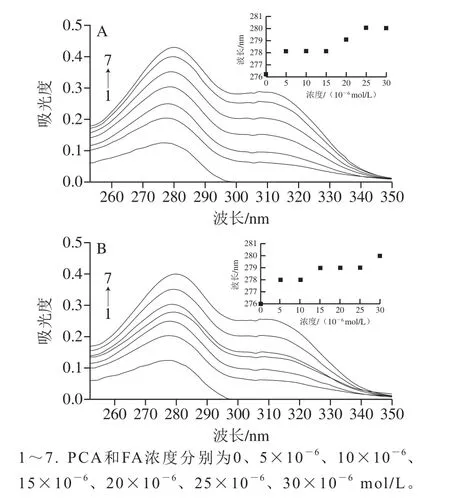
圖2 298 K時PCA(A)、FA(B)與BSA相互作用的紫外吸收光譜Fig.2 UV absorption spectra of PCA-BSA (A) and FA-BSA (B)interactions at 298 K
2.2 PCA和FA與BSA相互作用的熒光光譜分析
298、310、320 K時,不同濃度的PCA與BSA相互作用的內源熒光光譜如圖3所示,當激發波長為281.0 nm時,BSA分別在347.0、349.0、345.0 nm波長處有1 個強熒光發射峰。Aprodu等[22]發現,Trp的最大熒光發射波長(λem)在308.0~352.0 nm范圍內,而Tyr的最大熒光發射波長為304.0 nm,因此可以推斷BSA的內源熒光主要來源于Trp殘基。由圖3、4可知,PCA和FA濃度在0~35×10-6mol/L時,隨著PCA和FA濃度的增加,3 種溫度下的BSA內源熒光強度都呈下降趨勢,說明PCA和FA都可以與BSA結合,使其內源熒光發生猝滅。BSA的內源熒光猝滅程度隨著FA、PCA各自濃度增加而加劇,且PCA對BSA的猝滅效果比FA更明顯,其可能是因為PCA和FA結合在BSA的Trp134殘基或Trp213殘基附近。沈亮亮[23]利用熒光光譜法研究苦丁茶中紫莖女貞苷A和紫莖女貞苷B與BSA的相互作用時發現,紫莖女貞苷A對BSA內源熒光的猝滅效果比紫莖女貞苷B更明顯,說明紫莖女貞苷A更接近BSA的Trp殘基。由此可以推測,PCA和FA分別與BSA作用時,PCA距離BSA的Trp134或Trp213殘基更近一些。如圖3所示,隨著PCA濃度的增大,BSA的最大熒光發射波長發生明顯紅移,其在298 K時從347.0 nm紅移到366.5 nm;其在310 K時從349.0 nm紅移到366.5 nm;其在320 K時從345.0 nm紅移到367.0 nm。由圖4可知,隨著FA濃度的增大,BSA的最大熒光發射波長也發生明顯紅移,其在298 K時從347.0 nm紅移到351.0 nm;其在310 K時從349.0 nm紅移到350.0 nm;其在320 K時從345.0 nm紅移到349.0 nm,此結果說明PCA和FA的加入均會使BSA的Trp134或Trp213殘基周圍的極性增強,疏水性減弱,表明Trp134殘基或Trp213殘基逐漸從BSA內部的疏水環境中暴露出來、肽鏈逐漸伸展、發生去折疊現象[24],也說明PCA、FA對BSA的猝滅均可能是靜態猝滅。另外,比較BSA分別與PCA和FA結合后最大熒光發射波長的變化,可以發現BSA與PCA相互作用后的最大熒光發射波長紅移更明顯,這可能與其結構有關,PCA的分子質量低于FA的分子質量,且PCA比FA多1 個酚羥基,所以極性更大的PCA可更大程度地增強Trp134殘基或Trp213殘基周圍的極性,使BSA的肽鏈更加伸展,從而更深入地插到BSA的疏水區域中[23]。
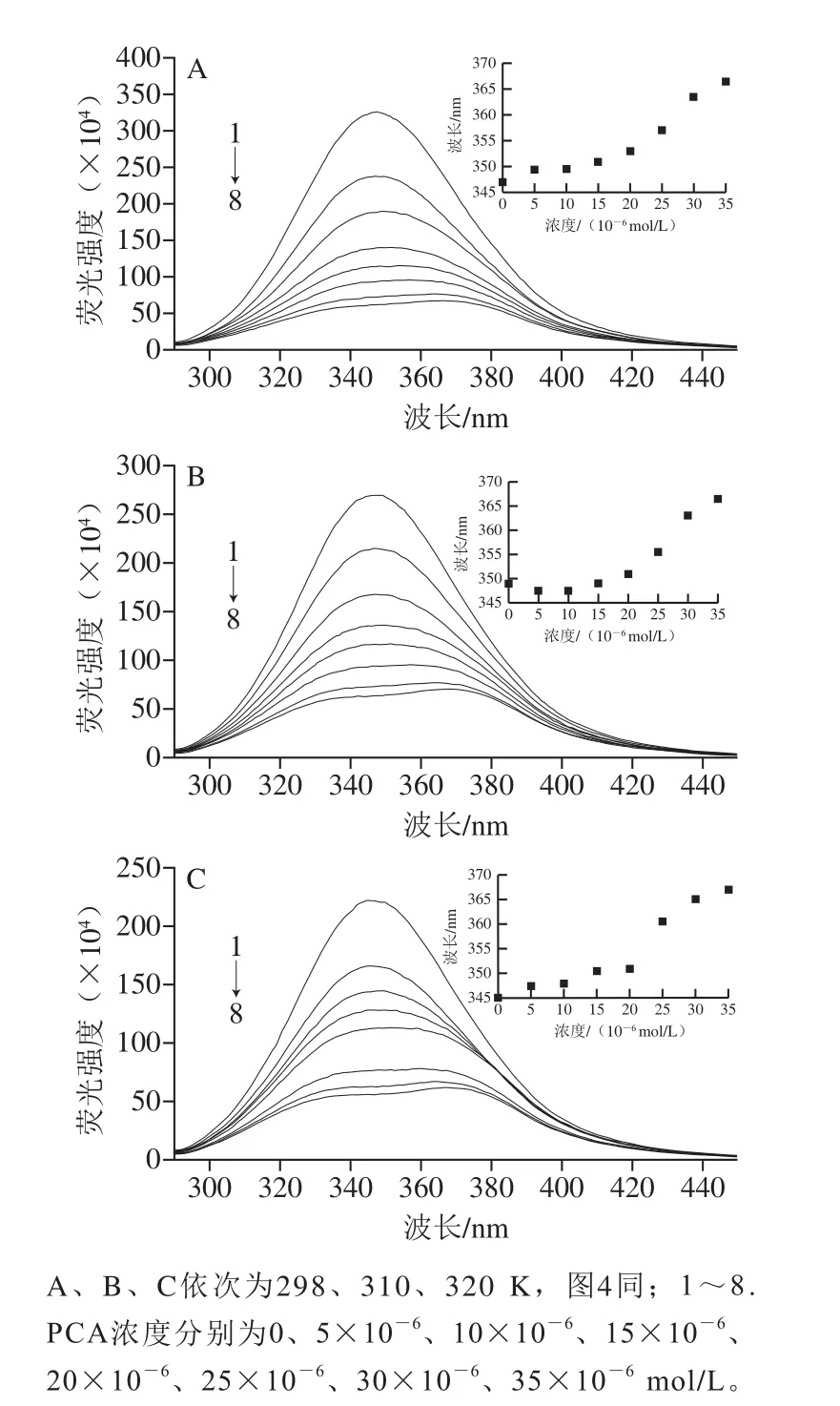
圖3 不同溫度下PCA與BSA相互作用的熒光光譜Fig.3 Fluorescence spectra of PCA-BSA interactions at different temperatures
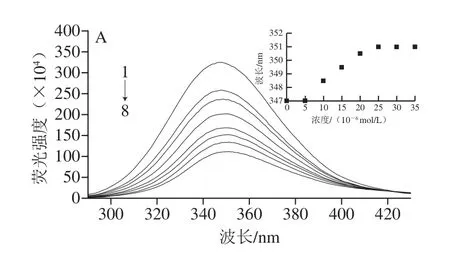
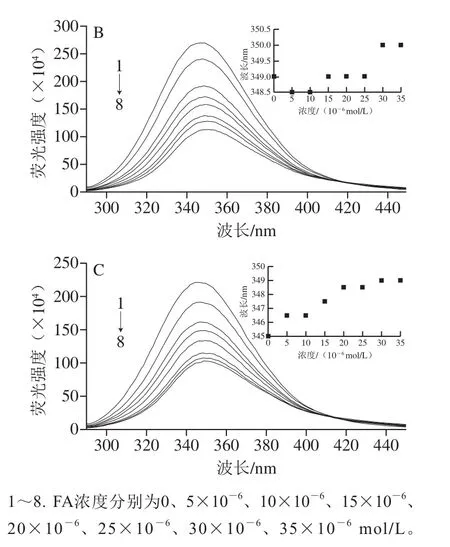
圖4 不同溫度下FA與BSA相互作用的熒光光譜Fig.4 Fluorescence spectra of FA-BSA interactions at different temperatures
2.3 熒光猝滅機理
2.3.1 PCA和FA對BSA的熒光猝滅類型
298、310、320 K時,PCA和FA與BSA相互作用的Stern-Volmer擬合結果如圖5所示,F0/F和[Q]之間存在良好的線性關系。PCA和FA與BSA相互作用的Ksv、Kq值如表1所示,隨著溫度從298 K升高到320 K,PCA與BSA相互作用的Ksv值從1.015×105L/mol減小到6.939×104L/mol,FA與BSA相互作用的Ksv值從4.863×104L/mol減小到3.430×104L/mol,而且在不同的溫度條件下,PCA和FA與BSA相互作用的Kq值均遠大于最大動態猝滅速率2.0×1010L/(mol·s)[25],說明PCA和FA都分別與BSA形成了大分子復合物,且其均為靜態猝滅過程[17]。此外,在同一溫度下,PCA與BSA相互作用的Kq值均大于FA與BSA相互作用的Kq值,因此與FA相比,PCA對BSA的內源熒光猝滅程度更大。
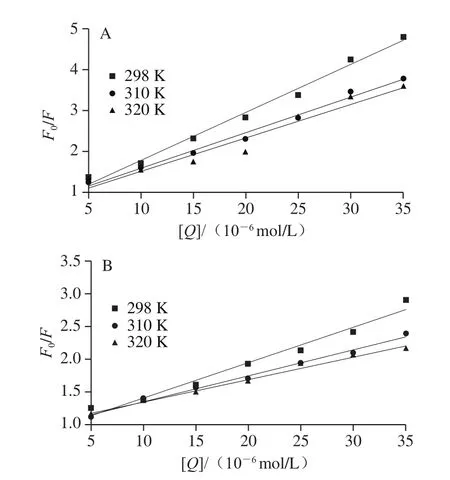
圖5 不同溫度下PCA(A)和FA(B)與BSA相互作用的Stern-Volmer擬合圖Fig.5 Stern-Volmer plot of PCA-BSA (A) and FA-BSA (B)interactions at different temperatures
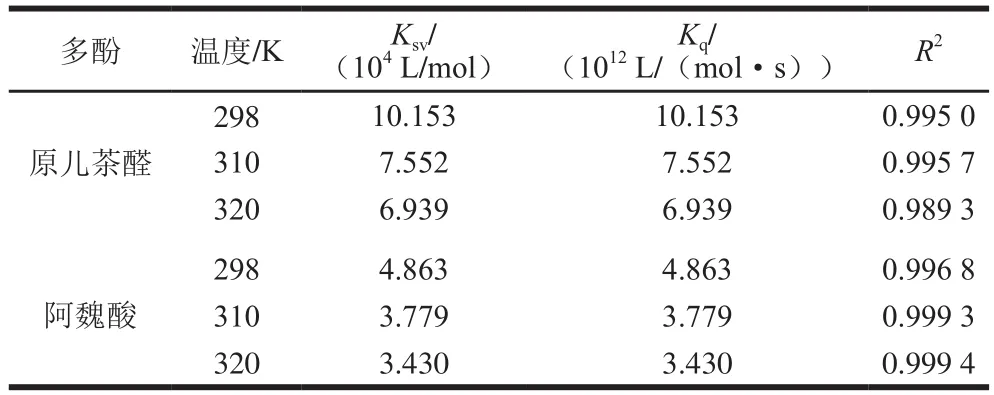
表1 不同溫度下PCA和FA與BSA相互作用的猝滅常數Table 1Quenching constants for PCA-BSA and FA-BSA interactions at different temperatures
2.3.2 PCA和FA與BSA相互作用的結合常數和結合位點數
298、310、320 K時,PCA和FA與BSA相互作用的雙對數結果如圖6所示,PCA和FA與BSA相互作用的Ka、n值如表2所示,隨著溫度從298 K升高到320 K,PCA與BSA相互作用的Ka值從1.011×106L/mol減小到1.818×105L/mol,FA與BSA相互作用的Ka值從8.322×105L/mol減小到4.881×104L/mol,均達到104數量級,說明PCA和FA與BSA相互作用的熒光猝滅類型均以靜態猝滅為主、動態猝滅可忽略不計,進一步說明PCA和FA均能與BSA形成穩定的復合物[26],其與2.1、2.2、2.3.1節所得結論一致。不同溫度條件下,PCA和FA與BSA相互作用的n值均接近1.000,說明PCA和FA與BSA的結合比例約為1∶1。此外,溫度相同時,PCA與BSA相互作用的Ka值均大于FA與BSA的Ka值,說明PCA與BSA之間的結合力大于FA與BSA的結合力,這可能是因為PCA的極性強于FA的極性。楊淑玲等[27]研究發現,在36~37 ℃時黃體酮(progesterone,PROG)與BSA相互作用的Ka值為1.423×104L/mol,推測PROG進入人體后能與HSA較好地互作,從而被HSA運輸到靶器官。310 K時PCA、FA與BSA相互作用的Ka值分別為9.005×105、2.553×105L/mol,遠大于104L/mol,因此也可推測,PCA和FA均能與HSA在人體環境中進行較好地相互作用,且PCA比FA更容易被HSA貯存、運輸。
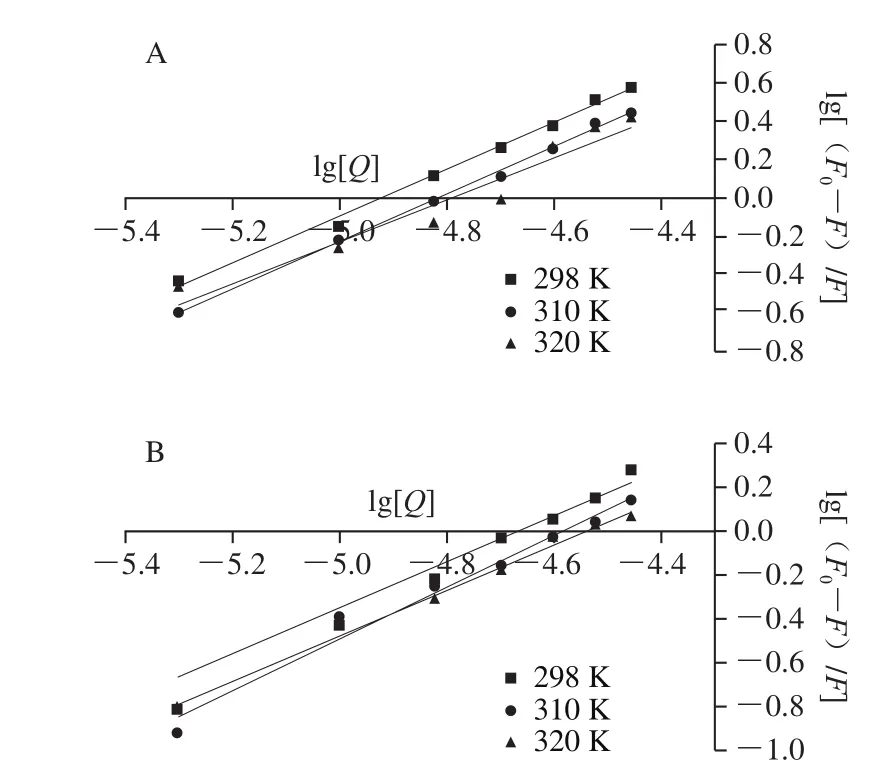
圖6 不同溫度下PCA(A)和FA(B)與BSA相互作用的雙對數圖Fig.6 Double logarithmic plots for PCA-BSA (A) and FA-BSA (B)interactions at different temperatures
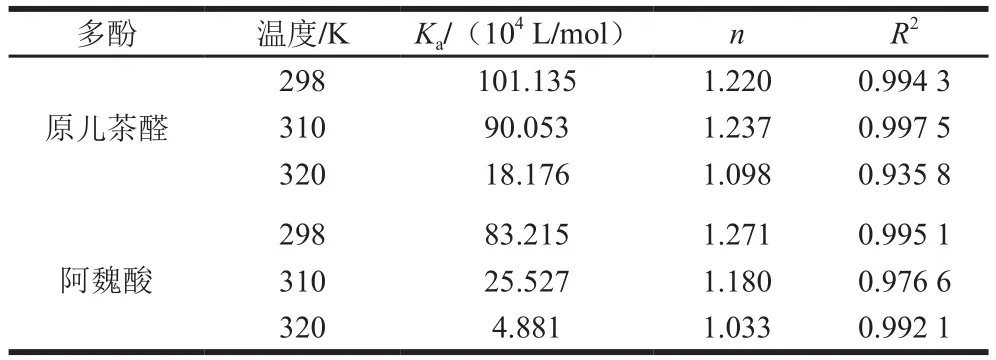
表2 不同溫度下PCA和FA與BSA相互作用的結合常數和結合位點數Table 2Binding constants and binding site numbers for PCA-BSA and FA-BSA interactions at different temperatures
2.3.3 PCA和FA與BSA相互作用的作用力類型
PCA和FA與BSA相互作用的ΔG、ΔH、ΔS值如表3所示,在298、310、320 K共3 種不同溫度條件下,PCA和FA與BSA相互作用過程中的ΔG均小于0,說明PCA和FA與BSA的結合過程是自發進行的。PCA與BSA相互作用的ΔS、ΔH值分別為-107.186 J/(mol·K)、-67.088 kJ/mol,FA與BSA相互作用的ΔS、ΔH值分別為-284.251 J/(mol·K)、-23.332 kJ/mol,其均小于0,說明PCA和FA與BSA相互作用過程中的主要作用力均為氫鍵和范德華力[28]。這與吳雨杭[29]研究染料木素、金雀花堿與BSA分別相互作用過程和黃朝波等[18]研究紅斑紅曲胺與BSA相互作用過程的作用力一致。
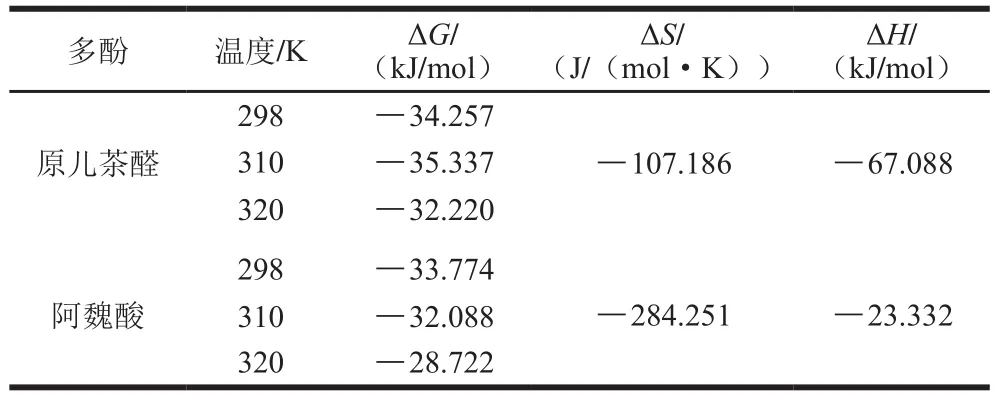
表3 PCA和FA與BSA相互作用的熱力學參數Table 3Thermodynamic parameters for PCA-BSA and FA-BSA interactions
2.4 PCA、FA與BSA相互作用的同步熒光光譜分析
同步熒光常用來分析小分子物質對蛋白質構象的影響,Δλ1=15 nm和Δλ2=60 nm時,同步熒光光譜分別顯示蛋白質中Tyr、Trp殘基的特征信息[30]。由圖7A、8A可知,隨著PCA和FA的加入,Tyr殘基的熒光發生略微藍移,說明PCA和FA會使Tyr殘基周圍的極性降低,疏水性增強[3];由圖7B、8B可知,隨著PCA的加入,Trp殘基的熒光基本未發生移動;而FA的加入,使Trp殘基的熒光發生略微紅移,說明FA使Trp殘基周圍的極性增加,疏水性減弱。由圖7、8可知,BSA中的Tyr、Trp殘基分別在303、346 nm處有最大特征吸收峰,Trp的熒光強度遠大于Tyr,其對應關系約為10∶1,這主要是因為蛋白質中熒光強度比約為Trp∶Tyr∶Phe=100∶9∶0.5[18]。隨著PCA和FA濃度的增加,Tyr和Trp的熒光均呈現降低趨勢,且Trp的熒光猝滅效率大于Tyr的熒光猝滅效率,結合2.2節得出的結論:加入PCA和FA導致BSA的內源熒光紅移現象的發生,可以推斷PCA和FA導致BSA發生熒光猝滅的主要原因是Trp殘基的熒光發生了猝滅。庹潯等[31]研究發現,小分子物質與主要結合在BSA的IIA或IIIA結構域中,IIA結合域含有Trp213、Tyr262殘基,IIIA結構域含有Tyr400、Tyr410、Tyr451、Tyr496殘基。2.3.2節發現,PCA和FA與BSA均只有1 個結合位點,結合同步熒光的結果,PCA和FA使BSA熒光發生猝滅的原因主要是導致Trp殘基的熒光發生猝滅,推測PCA和FA與BSA的結合位點可能在IIA結構域的Trp213殘基附近。
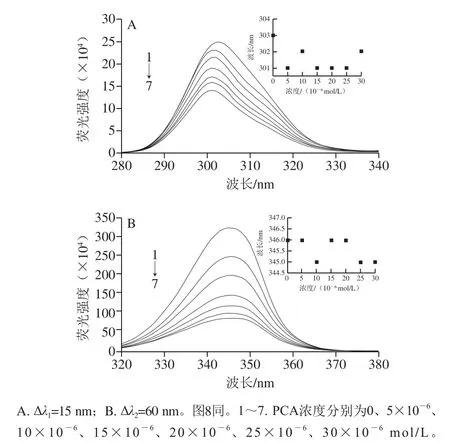
圖7 PCA與BSA相互作用的同步熒光光譜及λem的變化Fig.7 Synchronous fluorescence spectra of PCA-BSA interactions and λem shift
圖9、10分別為PCA、FA與BSA相互作用的分子模擬結果圖,結合能量分別為-5.1、-6.3 kcal/mol。由圖9A可知,PCA與BSA形成了4 個常規氫鍵(O···H—X),其包括:PCA酚羥基的氫與Asp450的羧基氧形成氫鍵,鍵長為3.04 ?;PCA的2 個酚羥基氧與Ser343側鏈的羥基的氫分別形成2 個氫鍵,鍵長分別為4.31、4.32 ?;PCA醛基的氧與Trp213吲哚基上的氨基的氫形成氫鍵,鍵長為5.12 ?,這4 個氫鍵加強了相互作用過程中非共價結合的強度,穩定了PCA與BSA復合物的空間構象[32]。同時,PCA的苯環與BSA的疏水性氨基酸Val342的丙基側鏈形成了疏水鍵,鍵長為5.03 ?,有利于維持PCA和BSA作用部位的空間構象。另外,PCA的苯環分別與Arg194帶正電荷的胍基和Asp450帶負電荷的羧基基于π-陽離子和π-陰離子作用而結合,鍵長分別為6.30、4.07 ?。此外,PCA與BSA的Leu197、Arg198、Ala341、Glu449、Ser453、Leu454殘基形成了范德華力,也對復合物的空間構象有很大的支持作用。
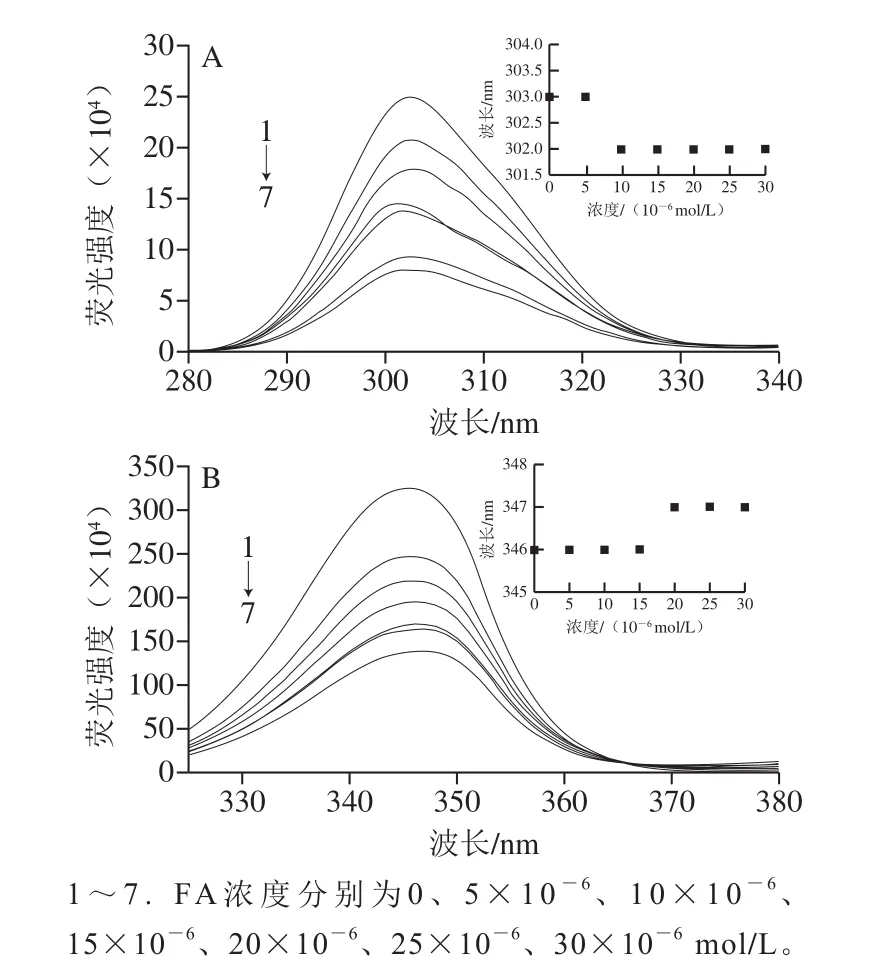
圖8 FA與BSA相互作用的同步熒光光譜及λem的變化Fig.8 Synchronous fluorescence spectra of FA-BSA interactions and λem shift
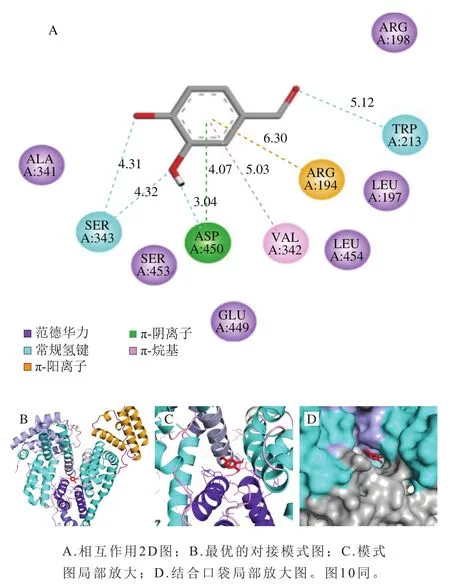
圖9 PCA與BSA相互作用的分子對接圖Fig.9 Molecular docking diagram of PCA with BSA
2.5 分子對接結果分析
由圖9A、10A可知,PCA和FA主要靠氫鍵和范德華力與BSA結合,與2.3.3節所得結論一致。由圖9B、10B可知,PCA和FA在BSA上的最佳結合位點在IIA結合域和IIIA結合域之間,且距離IIA結合域更近,這與2.4節的推測一致。PCA和FA分別與Trp213靠氫鍵作用而結合,如圖9D、10D所示,其結合在Trp213及其周圍的疏水性殘基形成的疏水口袋中,此現象解釋了PCA和FA導致BSA內源熒光發生猝滅的原因,進一步驗證了光譜實驗的結論。另外,由圖9A、10A還可知,PCA比FA距離BSA的Trp213更近,其對應關系為0.512 nm<0.518 nm,根據Forster[33]的非輻射能量轉移機理可知,雖然PCA和FA均可被BSA貯存、轉運,但PCA更容易被BSA貯存并運輸。
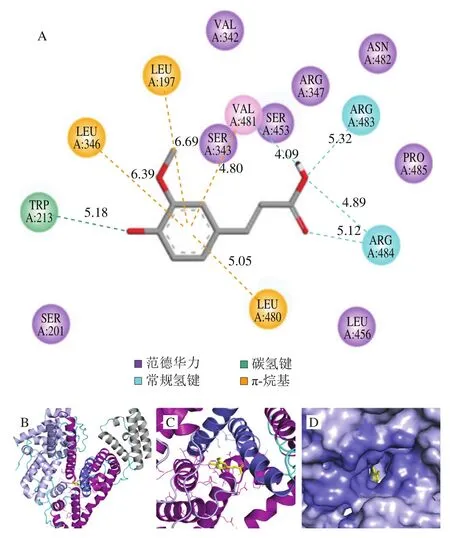
圖10 FA與BSA相互作用的分子對接圖Fig.10 Molecular docking diagram of FA with BSA
由圖10A可知,FA與BSA分子形成了4 個常規氫鍵(O···H—X)包括:FA的羧基氫與Val481的羧基氧形成氫鍵,鍵長為4.09 ?;FA的羧基氧分別與Arg483、Arg484的氨基氫形成氫鍵,鍵長分別為5.32、4.89 ?;FA的羰基氧與Arg484的氨基氫形成氫鍵,鍵長為5.12 ?。同時,FA酚羥基上電負性的氧與Trp213吲哚基上的雙鍵碳形成了碳氫鍵(O···CH2=CH2),鍵長為5.18 ?。4 個氫鍵對維持FA與BSA形成復合物的穩定起關鍵作用。另外,FA的苯環分別與BSA的疏水性氨基酸Leu197、Leu346、Leu480、Val481的烴基側鏈形成了4 個疏水鍵,鍵長分別為6.69、6.39、5.05、4.80 ?,其減少了疏水性氨基酸與水的作用,有助于維護FA與BSA形成復合物的三維結構。此外,FA與BSA的Ser201、Val342、Ser343、Arg347、Ser453、Leu456、Asn482、Pro485殘基形成了范德華力。
3 結 論
實驗利用光譜法和分子對接技術研究了PCA和FA分別與BSA的相互作用。紫外光譜發現,298 K時PCA和FA均會導致BSA的特征吸收峰強度和波長發生改變。熒光光譜的研究表明PCA和FA均會導致BSA的內源熒光發生靜態猝滅,λem紅移,且PCA對BSA的作用更明顯;PCA和FA在BSA上均只有1 個結合位點,且PCA與BSA之間的結合能力強于FA與BSA的結合;由于ΔG、ΔS、ΔH值均小于0,所以PCA和FA主要靠氫鍵和范德華力與BSA形成穩定復合物,且此過程自發進行。同步熒光光譜的結果說明,PCA和FA的加入均會影響BSA的Tyr殘基或Trp殘基的微環境,并導致Tyr和Trp的熒光發生猝滅,且Trp的熒光猝滅效率大于Tyr的熒光猝滅效率。分子對接進一步驗證了光譜實驗的結果,并發現PCA、FA在BSA上的最佳結合位點在IIA、IIIA結合域之間的疏水空腔中,且距離IIA結合域更近,同時因為PCA比FA距離BSA的Trp213更近,其對應關系為0.512 nm<0.518 nm,由此推測PCA更容易被BSA貯存運輸。

