二甲苯藍FF-三乙醇胺-雙氧水體系催化光度法測定痕量鎳
*趙悌軍 張斌
(1.臨沂市泰爾化工科技有限公司 山東 276005 2.臨沂市宇恒機械化工有限公司 山東 276005)
引言
鎳廣泛的應用于鋼鐵、國防、冶金、化學、蓄電池、陶瓷、電子、原子能和電鍍工業。近年來,由于各種新方法、新儀器和新試劑的使用,鎳的分析有了新的進展。目前鎳的測定方法有原子吸收和原子光譜法、電分析法、熒光法、光度法等。分光光度法是鎳分析中應用最廣的方法,隨著新顯色劑與表面活性劑等的應用,使得分光光度法應用更加廣泛。催化動力學光度法以其靈敏度高、檢出限低備受人們青睞。
作者發現,對于H2O2氧化二甲苯藍FF褪色的指示反應,在NaOH堿性條件下,痕量鎳與三乙醇胺具有協同阻抑作用,并且吸光度與鎳的含量呈線性關系,基于該原理建立了負催化光度法測定痕量鎳的新方法。
1.試驗儀器與步驟
(1)試驗儀器和試劑
CM-5型分光光度計(柯尼卡美能達儀器有限公司);超級恒溫水浴鍋(北京市醫療設備廠);電子天平(上海精密科學儀器有限公司)。
1.0g·L-1鎳標準儲備溶液:準確稱取0.4954gNi(NO3)2·6H2O(A.R純)置于小燒杯中,用二次去離子水溶解后定量轉移至100mL容量瓶中并定容,標準工作溶液以二次去離子水逐級稀釋成1μg·mL-1。
0.10g·L-1二甲苯藍FF溶液:準確稱取0.2520g二甲苯藍FF(A.R純)置于小燒杯中,用95%無水乙醇溶解并定量轉移至250mL容量瓶中并定容。
H2O2(A.R純)9.0×10-2mol·L-1溶液;1.0×10-3mol·L-1三乙醇胺(A.R純)溶液;0.20mol·L-1NaOH(A.R純)溶液;試劑配制均采用二次去離子水。
(2)試驗步驟
在兩支25.00mL刻度一致的比色管中,一支作為負催化反應加入定量鎳標準工作溶液,另一支作為非催化反應不加鎳標準工作液,分別加入0.20mol·L-1NaOH溶液1.20mL,1.0×10-3mol·L-1三乙醇胺溶液1.40mL,0.10g·L-1二甲苯藍FF溶液4.60mL,9.0×10-2mol·L-1雙氧水溶液0.60mL,用二次去離子水定容至刻度,搖勻。將二只比色管均同時放入沸水的水浴鍋中加熱4min,迅速取出并立即用大量流水冷卻4min,然后在610nm處用1cm比色皿,以水為參比測定負催化體系吸光度A和非催化體系的吸光度A0,計算ΔA(ΔA=A-A0)。
2.結果與討論
(1)吸收光譜
選取不同波長并依照試驗步驟,分別測定負催化體系(曲線1)和非催化體系(曲線2)的吸收光譜,結果見圖1。從圖1看出,在氫氧化鈉堿性條件下,過氧化氫氧化二甲苯藍FF褪色快,當存在痕量鎳時,對過氧化氫氧化二甲苯藍FF褪色反應痕量鎳與三乙醇具有胺協同阻抑。在波長為610nm處負催化反應體系和非催化反應體系的吸光度均有最大吸收峰。故選擇610nm為測定波長,表觀摩爾吸光系數為1.2×105L·mol-1·cm-1。

1.負催化體系;2.非催化體系圖1 吸收光譜1.Negative catalytic system;2.Non-catalytic systemFig.1 Absorption spectra
(2)試劑用量對反應速率的影響
①氫氧化鈉用量
于5支比色管中分別配置氫氧化鈉含量依次增加,其它試劑量與試驗方法相同的緩沖介質,按試驗方法操作,考察氫氧化鈉溶液用量對反應速率的影響(見圖2),由圖2可以看出,當氫氧化鈉溶液的用量在0.40~1.60mL范圍內變化時,在體積為1.20mL處試驗的△A達到最大值,因此試驗選用1.20mL 0.20mol·L-1NaOH溶液。
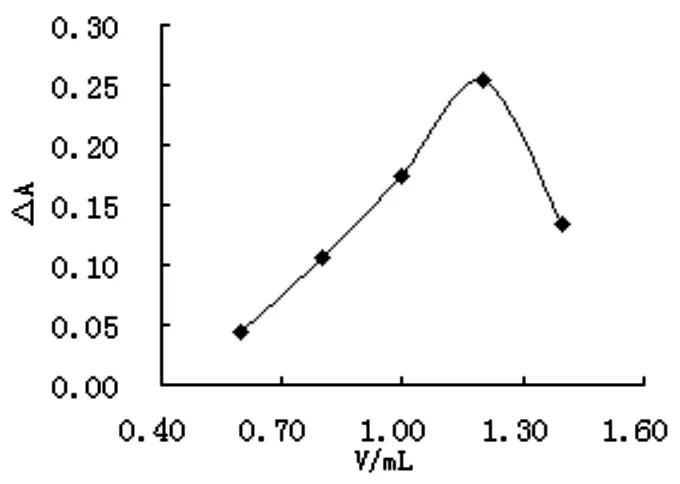
圖2 氫氧化鈉用量的影響Fig.2 The Influence of the amount of sodium hydroxide
②二甲苯藍FF溶液用量
同樣方法只改變二甲苯藍FF用量考察其對反應速率的影響(見圖3),由圖3可以看出,當二甲苯藍用量在4.20~5.00mL范圍內變化時,在體積為4.60mL處,試驗的△A達到最大值且穩定,因此實驗選用4.60mL 1.0g·L-1二甲苯藍FF溶液。

圖3 二甲苯藍FF用量的影響Fig.3 The Influence of the amount of xylene cyanole FF
③H2O2溶液用量
同樣方法考察H2O2溶液用量對反應速率的影響(見圖4),由圖4可以看出,當H2O2用量在0.20~1.00mL范圍內變化時,在體積為0.60mL處,試驗的△A達到最大值,因此實驗選用0.60mL 9.0×10-2mol·L-1H2O2溶液。

圖4 H2O2溶液用量的影響F ig.4 The Influence of the amount of hydrogen peroxide
④三乙醇胺溶液用量
按相同方法考察了1.0×10-3mol·L-1三乙醇胺溶液用量對反應速率的影響(見圖5),由圖5可以看出,對于H2O2氧化二甲苯藍FF褪色的指示反應,加入少量三乙醇胺溶液能夠加快反應速度。當三乙醇胺溶液用量為1.40mL時,鎳對H2O2氧化二甲苯藍FF阻抑作用最大。故選用三乙醇胺溶液1.40mL。

圖5 三乙醇胺用量的影響Fig.5 The Influence of the amount of triethanolamine
(3)反應溫度及體系的穩定性
按試驗方法配置5份各試劑量相同的試液,分別在不同的溫度下處理,考察了溫度對反應的速率的影響(見圖6),由圖6可以看出負催化反應在室溫下非常緩慢,幾乎不進行,故用流水冷卻即可終止此反應。當溫度高于75℃時,反應速度逐步加快,ΔA逐級增大;當100℃反應時間在1~4min之間時,ΔA值與反應時間呈線性關系,在4min時ΔA達到最大值,流水冷卻4min后體系的ΔA至少在1h內保持不變。為便于控制試驗條件,試驗選擇在沸水浴中加熱,反應時間為4min。

圖6 反應溫度的影響Fig.6 The Influence of temperature
(4)線形范圍
鎳的檢量線見圖7。其線形回歸方程為:ΔA=0.0096cNi(μg·mL-1)+0.1266,其相關系數r=0.9908。根據11次空白實驗的標準偏差,由三倍法求得本方法的檢測限為3.75μg·mL-1。25mL溶液中鎳為1.0~9.0μg時與ΔA呈良好的線性關系。
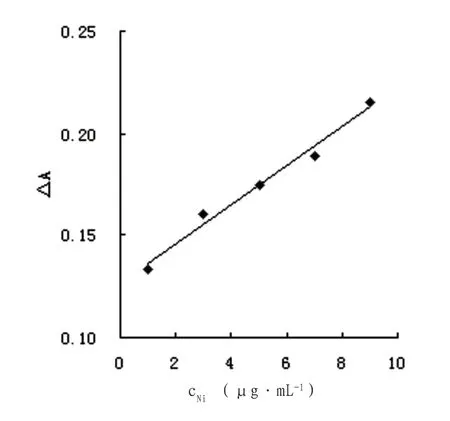
圖7 鎳的工作曲線Fig.7 The standard curve of nickel content
(5)共存離子的影響
采用25mL溶液中含3.0μgNi的標準工作液,試驗了常見陽離子對方法的干擾情況,結果表明,當相對誤差不超過±5%時,Bi3+、Mn2+和Ag+最大量為30μg,Co2+、Zn2+、Fe3+、Fe2+和Cu2+最大量為0.45mg,Al3+、Ca2+、Mg2+、K+和Na+最大量為3mg時基本無干擾。如果水樣中Bi3+、Mn2+和Ag+濃度較高,應萃取分離消除影響。
3.樣品分析
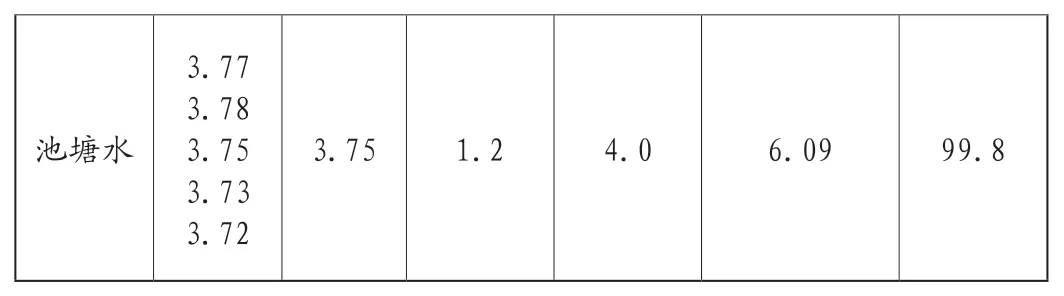
取臨沂大學池塘水樣進行分析。分析處理如下:移取池塘水水樣500mL至一燒杯中,然后在電爐上加熱煮沸濃縮至250mL,冷卻至室溫,用活性炭凈化。按試驗方法進行測定,同時作回收率試驗,測定結果見表1。測得池塘水中鎳的質量濃度為3.75μg·mL-1,相對標準偏差RSD為1.2%,加入標準回收率為99.8%。

表1 樣品中鉬的測定結果與回收率(n=5)Tab.1 Results for determination of molybdenum in samples and recycle ratio(n=5)