三維斑點追蹤技術評估缺血性二尖瓣反流患者左心功能
楊道玲 王戲丹 吳玉蓮 陳靜婉
缺血性二尖瓣反流(ischemic mitral regurgitation,IMR)是由于慢性冠狀動脈出現病變導致機體左室整體或局部病理重塑的并發癥[1-2],長期IMR會對人體心功能產生較大影響,使左房承受過大壓力及負荷,導致患者左房體積和射血分數增加,左室受到不良影響,機體心排血量不足,引起多種臨床癥狀[3]。研究[4]表明,IMR患者預后較差,病變進展過程中可出現心力衰竭、中風及死亡等不良結局,因此監測IMR患者左房應變功能對評估其預后有著重要意義。三維斑點追蹤(three-dimensional speckle tracking imaging,3D-STI)技術是評估心肌功能的重要手段之一,既往有學者[5]應用3D-STI評估2型糖尿病、腎病患者左房功能,本研究旨在探討3D-STI評估IMR患者左心功能變化的應用價值。
資料與方法
一、研究對象
選取2018年10月至2020年5月我院收治的冠狀動脈粥樣硬化性心臟病(以下簡稱冠心病)患者104例,根據其有無繼發于二尖瓣反流分為單純冠心病患者40例(單純冠心病組)和IMR患者64例(IMR組),IMR組進一步根據美國超聲心動圖學會制定標準[6]分為輕度反流23例、中度反流22例、重度反流19例。納入標準:①均為心絞痛或心肌梗死患者;②冠狀動脈造影顯示狹窄程度>75%;③心電圖為竇性心律;④均行3D-STI檢查;⑤臨床及影像學檢查資料完整。排除標準:①合并高血壓病、先天性心臟瓣膜病、先天性心臟病、心肌病、心力衰竭或內分泌疾病的患者;②圖像質量不佳者;③妊娠期及哺乳期婦女。單純冠心病組中男22例,女18例,年齡45~74歲,平均(56.31±8.22)歲,體質量指數(body mass index,BMI)18.3~31.0 kg/m2,平均(25.22±5.38)kg/m2;IMR組中男34例,女30例,年齡46~73歲,平均(56.89±8.12)歲,BMI 18.0~32.0 kg/m2,平均(24.73±5.56)kg/m2。另選同期于我院體檢的健康成人42例為對照組,男22例,女20例,年齡42~70歲,平均(57.64±8.26)歲,BMI 18.5~32.0 kg/m2,平均(24.92±5.61)kg/m2,均接受超聲心動圖和3D-STI檢查。各組性別比、年齡、BMI、血壓、心率、血脂及血糖等一般資料比較差異均無統計學意義。本研究經我院醫學倫理委員會批準,所有受檢者均知情同意。
二、儀器與方法
1.儀器:使用Philips EPIQ 7C彩色多普勒超聲診斷儀,S5-1探頭,頻率1~5 MHz;X5-1探頭,頻率1~5 MHz;配備Tom-Tec工作站。
2.方法:受檢者取左側位,先行常規超聲心動圖掃查,測量左室收縮、舒張末期內徑(LVIDS、LVIDD)及收縮末期左房前后徑(LAD),脈沖多普勒測量左室舒張早期與晚期二尖瓣環運動速度峰值的比值(Em/Am)、血流速度比(E/A);使用Simpson法測量左室射血分數(LVEF)。然后切換至3D全容積掃描模式,待心尖四腔心切面顯示清晰后連接心電圖,設置為“Full Volume”顯像,囑受檢者呼氣后屏住呼吸,獲取3個以上心動周期圖像并存儲,對三維圖像進行脫機定量分析。記錄患者左房整體縱向應變(GLS)、圓周應變(GCS)及徑向應變(GRS),計算各應變達峰時間標準差(TLS-SD、TCS-SD、TRS-SD),同時獲得受檢者心動周期各時相中左房最大、最小、收縮前容積(LAVmax、LAVmin、LAVp),計算左房總射血分數(LAEF)、被動排空分數(LApEF)及主動射血分數(LAaEF)。
三、統計學處理
應用SPSS 22.0統計軟件,計量資料以±s表示,兩組比較行t檢驗,多組比較采用單因素方差分析;計數資料以頻數表示,行χ2檢驗。3D-STI指標與LAEF的相關性采用Pearson相關分析法;繪制受試者工作特征(ROC)曲線分析TLS-SD、TCS-SD、TRS-SD評估左房功能改變的效能。P<0.05為差異有統計學意義。
結果
一、常規超聲心動圖檢查結果
各組LVIDD、LVIDS、LAD、Em/Am、LVEF比較,差異均有統計學意義(均P<0.05);其中LVIDS、LVEF各組間兩兩比較,差異均有統計學意義(均P<0.05)。見表1。
表1 各組常規超聲心動圖指標比較(±s)

表1 各組常規超聲心動圖指標比較(±s)
與對照組比較,*P<0.05;與IMR組比較,#P<0.05。LVIDD:左室舒張末期內徑;LVIDS:左室收縮末期內徑;LAD:左房前后徑;Em/Am:左室舒張早期與晚期二尖瓣環運動速度峰值的比值;E/A:血流速度比;LVEF:左室射血分數
LVEF(%)58.35±4.31*#51.64±6.07*65.73±3.51102.116<0.001組別單純冠心病組IMR組對照組F值P值LVIDD(cm)5.20±0.65*5.26±0.63*4.62±0.5415.354<0.001 LVIDS(cm)3.35±0.51*#3.87±0.48*3.04±0.1252.473<0.001 LAD(cm)3.93±0.45*3.96±0.42*3.53±0.1418.985<0.001 Em/Am 0.63±0.52*0.58±0.49*0.82±0.243.8760.023 E/A 0.85±0.50*0.82±0.53*0.91±0.110.5280.591
二、3D-STI檢查結果
各組3D-STI指標LAVmin、LAVp、LAEF、LAaEF、GLS、GCS、GRS、TLS-SD、TCS-SD、TRS-SD比較,差異均有統計學意義(均P<0.05);其中LAVmin、LAEF、LAaEF、GLS、GCS、GRS、TLS-SD、TRS-SD各組間兩兩比較,差異均有統計學意義(均P<0.05)。見表2和圖1~3。
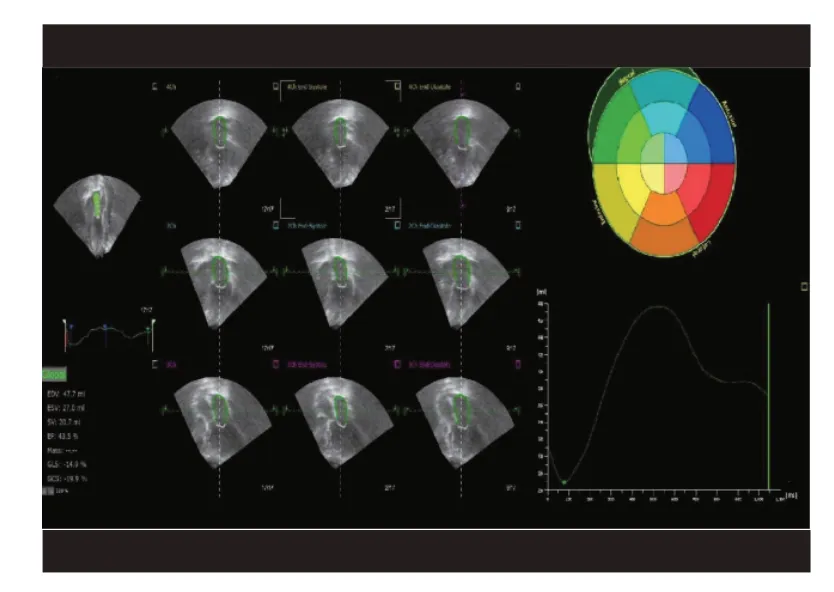
圖1 IMR組3D-STI圖像
表2 各組3D-STI指標比較(±s)
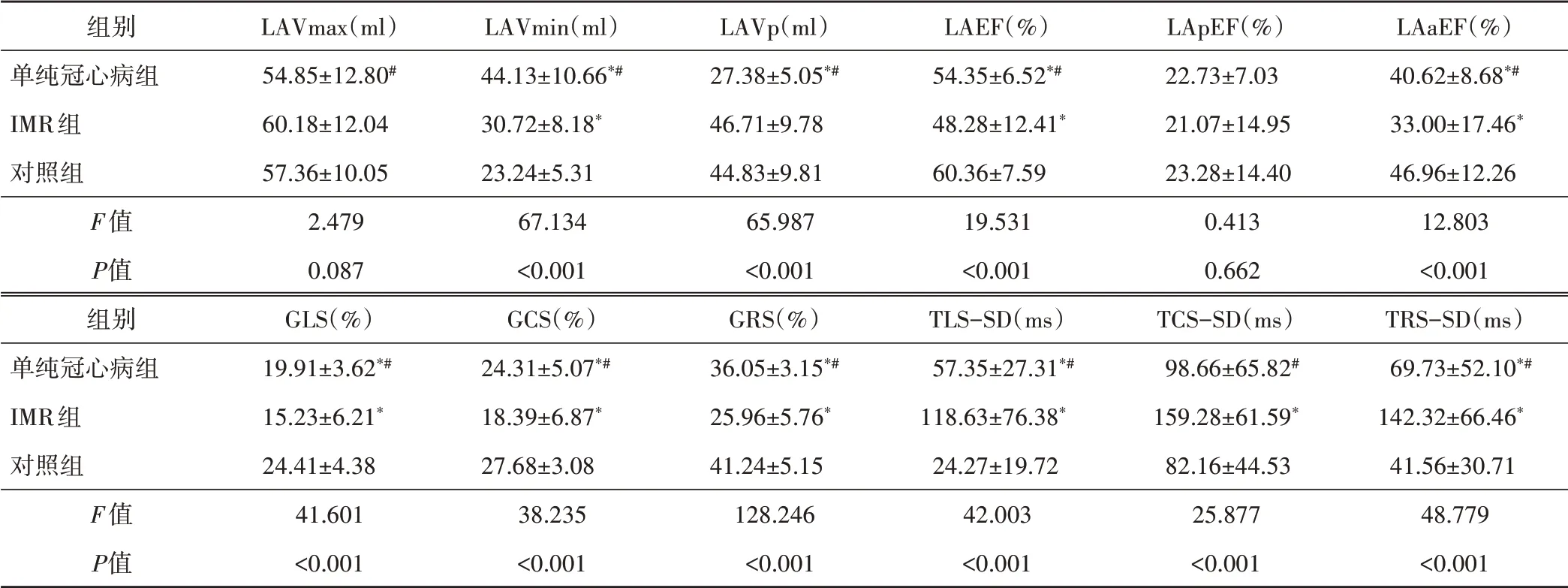
表2 各組3D-STI指標比較(±s)
與對照組比較,*P<0.05;與IMR組比較,#P<0.05。LAVmax、LAVmin、LAVp:分別為左房最大、最小、收縮前容積;LAEF:左房總射血分數;LApEF:被動排空分數;LAaEF:主動射血分數;GLS、GCS、GRS:分別為左房整體縱向應變、圓周應變、徑向應變;TLS-SD、TCS-SD、TRS-SC:分別為縱向應變、圓周應變、徑向應變達峰時間標準差
LAaEF(%)40.62±8.68*#33.00±17.46*46.96±12.2612.803<0.001 TRS-SD(ms)69.73±52.10*#142.32±66.46*41.56±30.7148.779<0.001組別單純冠心病組IMR組對照組F值P值組別單純冠心病組IMR組對照組F值P值LAVmax(ml)54.85±12.80#60.18±12.0457.36±10.052.4790.087 GLS(%)19.91±3.62*#15.23±6.21*24.41±4.3841.601<0.001 LAVmin(ml)44.13±10.66*#30.72±8.18*23.24±5.3167.134<0.001 GCS(%)24.31±5.07*#18.39±6.87*27.68±3.0838.235<0.001 LAVp(ml)27.38±5.05*#46.71±9.7844.83±9.8165.987<0.001 GRS(%)36.05±3.15*#25.96±5.76*41.24±5.15128.246<0.001 LAEF(%)54.35±6.52*#48.28±12.41*60.36±7.5919.531<0.001 TLS-SD(ms)57.35±27.31*#118.63±76.38*24.27±19.7242.003<0.001 LApEF(%)22.73±7.0321.07±14.9523.28±14.400.4130.662 TCS-SD(ms)98.66±65.82#159.28±61.59*82.16±44.5325.877<0.001
三、相關性分析
IMR患者GLS、GCS、GRS與LAEF均呈正相關(r=0.210、0.383、0.381,均P<0.05)。
四、ROC曲線分析
ROC曲線分析結果顯示,TLS-SD、TCS-SD、TRSSD截斷值分別為53.9 ms、139.3 ms、89.2 ms時,其評估左房功能改變的曲線下面積分別為0.862、0.841、0.924,敏感性分別為70.3%、65.6%、78.1%,特異性分別為100%、90.5%、100%。見圖4。
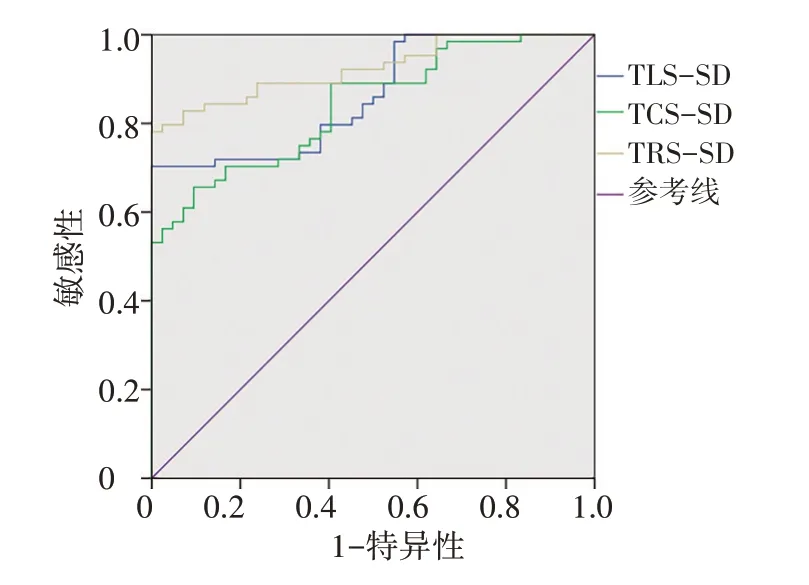
圖4 TLS-SD、TCS-SD、TRS-SD評估左房功能改變的ROC曲線圖

圖2 單純冠心病組3D-STI圖像
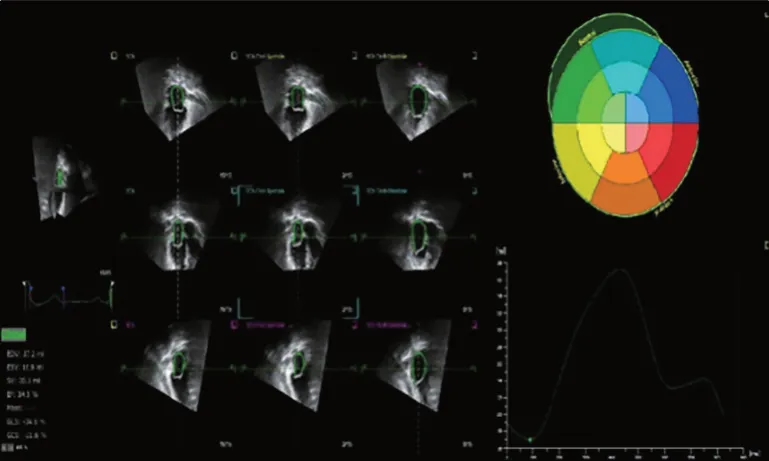
圖3 對照組3D-STI圖像
討論
IMR患者除二尖瓣功能改變外,還常伴左室、乳頭肌、瓣環等多種組織異常[7]。研究[8]顯示,超聲心動圖在心功能定量評估中有一定作用,但該方法測量心臟形態變化或重構患者左房大小可能有一定誤差,臨床應用有一定局限。3D-STI可對人體空間層面上心肌斑點的運動進行追蹤,評估受檢者心肌三維動態容積指標,能多方位評價心室的收縮及應變功能,該技術不受不同時點上心肌運動軸改變的影響,無角度依賴性,可以實時獲取心肌空間應變指標,在左房功能的評估及早期異常監測中更加準確[9-10]。人體左房主要作用是儲存、管道及輔助泵等,儲存是指左房排空的血容量,以LAEF表示;管道作用即肺靜脈血液流入左房內,然后于左室舒張開始則輸入左室內,以LApEF表示;輔助泵則是指左室收縮完成后左房心肌開始收縮,將血液泵入左室內,以LAaEF表示。當機體出現生理或病理改變,則可通過左房來調節左室工作,使機體保持其自身所需的心搏量。
本研究常規超聲心動圖檢查結果顯示,IMR組患者LVIDD、LVIDS、LAD均較單純冠心病組和對照組增大,Em/Am、LVEF均降低(均P<0.05),可能與IMR患者冠狀動脈出現病變使機體心肌供血異常、心室壁運動出現相應改變有關,導致其左室收縮功能受到影響。各組E/A比較差異無統計學意義,分析原因可能為IMR患者左室收縮期血液反流至左房內,使機體左房充盈,左室開始舒張時其房室壓差值升高,導致血流變快,E峰偏高,表明IMR患者房室血流變化會對其左室舒張產生影響,評估左室功能可能不夠準確[11]。本研究3D-STI檢查顯示,IMR組LAVmin、LAEF、LAaEF、GLS、GCS、GRS、TLS-SD、TRS-SD與單純冠心病組和對照組比較,差異均有統計學意義(均P<0.05);IMR組患者LAVmin較對照組增高,LAEF、LAaEF均較對照組降低,差異均有統計學意義(均P<0.05);而兩組LAVmax和LApEF比較差異均無統計學意義,提示IMR患者左房儲存及輔助泵能力均下降,分析原因為IMR患者左房主動收縮時,其血流動力學出現異常且心肌運動會減弱,LAVmin升高、LAEF降低,雖然患者左室舒張能力降低,但其舒張時反流及肺靜脈流經左房血液均會經開放的二尖瓣到達左室,故LApEF(管道功能)無明顯改變,但長期冠狀動脈病變會導致心肌功能損害,再加上房室血流動力的變化會對房壁運動有一定影響,使患者輔助泵能力降低[12]。
人體左房心肌走行為縱向分層,而機體心臟工作過程中各層心肌的運動方向也各不一致,深層主要包括縱向運動和圓周運動,淺層則為較薄的心肌組織,主要是徑向走行[13]。本研究3D-STI檢查顯示,IMR組患者GLS、GCS、GRS與對照組和單純冠心病組比較,差異均有統計學意義(均P<0.05),說明冠狀動脈病變會導致患者心房壁運動異常,而IMR持續時間較長,心臟血流動力學出現異常,因此IMR患者在縱向、圓周及徑向運動上均受到限制,心肌收縮及左房整體應變能力受到影響。另外,本研究相關性分析結果顯示,IMR患者GLS、GCS、GRS與LAEF均呈正相關(r=0.210、0.383、0.381,均P<0.05),表明IMR患者心肌應變多呈下降趨勢,進而導致左房容積出現相應改變,儲蓄和收縮能力下降。本研究IMR組TLS-SD、TCS-SD、TRS-SD均高于對照組(均P<0.05),提示IMR患者多存在左房心肌運動不同步現象,分析原因為人體左房心肌同步收縮主要取決于電生理傳導和細胞收縮耦聯過程,IMR患者多有左房負荷較大或心肌功能異常,在該耦聯過程中受到阻礙,使心肌出現代償做功,心房發生重構,心肌運動同步性受到影響,收縮出現不協調,最終影響左室功能[14]。本研究ROC曲線分析顯示,TLS-SD、TCS-SD、TRS-SD評估左房功能改變的曲線下面積分別為0.862、0.841、0.924,表明上述指標對左房心肌功能的改變均有較高的評估價值,與姜婧璇等[13]研究結論一致。
本研究的局限性:①樣本量較小;②3D-STI成像受較多因素影響,對心內膜顯示要求高,若心臟體積過大、內膜顯像不佳或患者聲透性差則很難獲得清晰的心內膜影像,對其評估有一定影響;③未對IMR患者進行隨訪,無法分析其預后,患者心底大血管、左心耳對左房可能產生的影響也無法避免,需今后進一步完善和分析。
綜上所述,3D-STI能準確評估IMR患者左房容積及心肌應變的變化,在左房功能評估中具有較高的應用價值,對臨床干預有重要作用。

