天然來源的二酰甘油酰基轉移酶抑制劑的研究進展
熊大璽,崔 龍
天然來源的二酰甘油酰基轉移酶抑制劑的研究進展
熊大璽,崔 龍*
北華大學藥學院,吉林 吉林 132000
二酰甘油酰基轉移酶(diacylglycerol acyltransferase,DGAT)是三酰甘油合成最后一步的催化酶,也是唯一的限速酶。該酶與脂肪代謝、脂類在組織中沉積有很大關系。天然產物因其存在許多結構新穎,活性強,毒副作用小的化合物成為抑制劑的首選。為了尋找有效的天然來源的DGAT抑制劑,對天然產物中含有較好DGAT抑制活性的化合物種類進行綜述。
天然產物;二酰甘油酰基轉移酶;構效關系;肥胖;糖尿病
隨著當今社會經濟的發展,肥胖人群的數量也不斷增加[1]。肥胖能誘發多種疾病,如血壓升高、血脂異常、心血管并發癥、2型糖尿病、腦血管損傷等疾病[2]。雖然人們主觀上已經提高了對肥胖的重視,但客觀上仍缺少有效措施阻止肥胖進一步流行和發展。盡管市場上出現了各種各樣的減肥藥物,卻因各種不良反應而無法長期服用[3]。因此,迫切地需要一種毒副作用小、效果好、選擇性高的調脂藥物。
三酰甘油(triglyceride,TG)的合成方式有2種[4]:(1)磷脂酸在磷脂酸磷酸酶作用下,水解釋放出無機磷酸轉變為二酰甘油(diacylglycerol,DG),在二酰甘油酰基轉移酶(diacylglycerol acyltransferase,DGAT)的作用下酯化生成TG;(2)脂酰輔酶A在單酰基甘油酯酰轉移酶作用下酯化生成DG,DG與脂酰輔酶A在DGAT作用下酯化生成TG。無論哪種方式,DGAT都作為TG合成中的唯一限速酶[5]。所以,抑制DGAT活性進而阻止機體合成脂肪成為現在治療肥胖的首要選擇。本文主要對天然來源的DGAT抑制劑的研究進展進行綜述。
1 DGAT的作用機制及分類
DGAT是一種微粒體酶,根據其結構、定位的差異可分為4種類型[6]:DGAT1、DGAT2、雙功能酶(wax ester synthase,WS/DGAT)和胞質內DGAT(CytoDGAT)。其中DGAT1屬于酰基輔酶A-膽固醇酰基轉移酶基因家族,DGAT2屬于單酰基甘油酯酰轉移酶家族。研究發現二者催化相同的酶促反應,并且在脂肪組織、小腸和肝臟中,這2種酶都普遍表達,但不具有任何顯著的氨基酸序列相似性[7]。WS/DGAT和CytoDGAT是近幾年才發現的亞型,WS/DGAT是一種雙功能酶,其主要功能是催化蠟酯的合成,同時也參與少量TG的合成[8]。CytoDGAT是一種可溶性酶,目前在花生等作物中被發現[9]。Conte等[10]研究發現敲除小鼠基因后,小鼠在出生不久后死亡,并且發現基因表達減少50%并不能有效地抑制TG的合成;敲除基因的小鼠仍能正常存活,腸道內還能繼續合成TG,但不在組織中沉積[11]。綜上所述,抑制TG的合成需要抑制DGAT的活性,而由于DGAT2輕微的抑制作用并不能阻止TG的合成,過度抑制又會產生不良反應,所以抑制DGAT1的活性成為治療肥胖的一個方向。
2 天然來源的DGAT1抑制劑
2.1 黃酮類
黃酮類的天然產物廣泛存在于自然界,Oh等[12]從豆科植物補骨脂Linn.中分離得到了2個黃酮類化合物,分別命名為bavachin(1)和bavachinin(2),2個化合物的半數抑制濃度(median inhibition concentration,IC50)分別為(78.5±1.7)、(80.1±1.3)μmol/L。Yin等[13]分離出了2個黃酮類化合物,分別命名為neo-bavaiso?avone(3)和corylifol A(4),2個化合物的IC50值分別為(94.1±1.4)、(96.2±1.1)μmol/L,化學結構見圖1。上述4個化合物均對DGAT1有良好的抑制活性,且對DGAT2均無抑制活性。通過對比化合物1、2發現,化合物2中7′′位的羥基被甲氧基取代,從而導致其活性減弱。化合物4的活性弱于化合物3,原因是化合物4僅比化合物3多了1個異戊烯基,從而降低了其對DGAT1的抑制活性。
2.2 木脂素類
Li等[14]從五加科植物刺五加(Rupr. Maxim. ) Harms.的甲醇提取物中分離得到7個木脂素類化合物,分別命名為(7, 7′,7″,8,8′,8″)-4′,5″-dihydroxy-3,5,3′,4″-tetramethoxy-7,9′:7′,9-diepoxy-4,8″-oxy-8,8′-sesquineo-lignan-7″,9″- diol(5)、(7,7′,7″,8,8′,8″)-4′,3″-dihydroxy-3,5, 3′,5′,4″-pentamethoxy-7,9′:7′,9-diepoxy-4,8″-oxy-8,8′-sesquineo-lignan-7″,9″-diol(6)、(7,7″,8,8′,8″)-3′,4″- dihydroxy-3,5,4′,5″-tetramethoxy-7,9′:7′,9-diepoxy- 4,8″-oxy-8,8′-sesquineo-lignan-7″:9″-diol(7)、4′,4″-dihydroxy- 3,5,3′,5′5″-pentamethoxy-7,9′:7′,9-diepoxy-4,8″-oxy-8,8′- sesquineo-lignan-7″,9″-diol(8)、7″configuration(9)、7″configuration(10)和acanthopanax A(11)。隨后測定了這7個化合物的DGAT1抑制活性,化合物5~10的IC50值分別為(74.1±1.2)、(61.1±1.3)、(79.1±1.1)、(82.4±1.5)、(97.1±1.1)、(91.3±1.3)μmol/L,化合物11的IC50>200 μmol/L。化合物5比化合物9、10有更好的DGAT1抑制活性。此外,化合物6表現出比化合物8更好的DGAT1抑制活性,表明R4處的甲氧基在抑制DGAT1活性中起重要作用。化合物7表現出比化合物9、10更強的DGAT1抑制活性,這表明4′-OCH3可以增強這種作用。化合物9、10對DGAT1表現出相似的活性,表明7″的構型對DGAT1的抑制作用較弱。化合物11對DGAT1無明顯抑制活性,對DGAT2的IC50值為(93.2±1.2)μmol/L,這可能與呋喃環有關。上述具有DGAT1抑制活性的木脂素類化合物的化學結構見圖2。
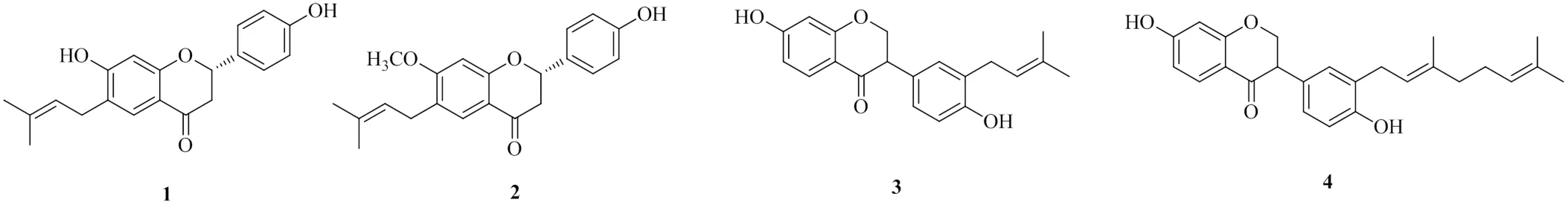
圖1 具有DGAT1抑制活性的黃酮類化合物的化學結構

圖2 具有DGAT1抑制活性的木脂素類化合物的化學結構
2.3 三萜類
Zhang等[15]在樺木科植物白樺SUK.皮中分離得到10個三萜類化合物,分別命名為lupenone(12)、lupeol(13)、betulinicacid(14)、betulinaldehyde(15)、betulin(16)、3-deoxybetulonicacid(17)、glochidonol(18)、lup-20/29-ene-1β/3β-diol(19)、3α-hydroxylup-20(29)-en-23,28-dioicacid(20)和3α, 11α-dihydroxy-23-oxo-lup-20(29)-en-28-oicacid(21)。用體外DGAT1抑制試驗測得這10個化合物的IC50值分別為:>100、>100、(11.2±0.3)、(18.6±0.9)、(38.6±1.2)、(13.2±1.1)、>100、>100、(15.2±0.2)、(20.2±1.5)μmol/L。化合物13在C-28處有甲基取代基,其抑制活性明顯低于相同位置取代的羧基、醛基和甲醇基團的化合物14~17。化合物14~17相比,R2的取代基不同,但是化合物14、17、20都有很高的DGAT1抑制活性,表明羥基取代基無明顯增DGAT1活性的能力,且R3位置的基團變化無法引起DGAT1抑制活性的改變。上述具有DGAT1抑制活性的三萜類化合物的化學結構見圖3。
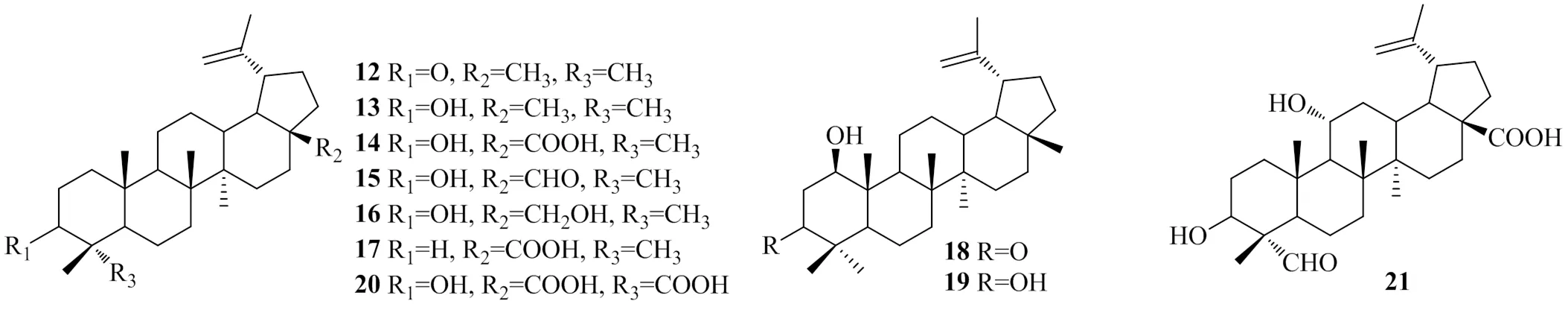
圖3 具有DGAT1抑制活性的三萜類化合物的化學結構
2.4 補骨脂酚類
Latha等[16]研究發現補骨脂的乙醇提取物具有抗高血糖和氧化的作用。Wu等[17]和Lin等[18]分別從中分離得到補骨脂酚類化合物,將其命名為12,13-dihydro-12,13-dihydroxybakuchiol(22)和Δ11-12-hydroxy-12-dimethylbakuchiol(23)。體外活性顯示,這2個化合物的IC50值分別為(135.1±1.2)、(73.4±1.3)μmol/L。化合物23相比于化合物22有更好的抑制活性,對比結構發現,兩者支鏈尾部的羥基異丙基官能團相同,化合物23少了1個亞甲基碳信號,多了1個C-11處的雙鍵碳信號。說明了羥基異丙基對DGAT1的抑制活性并無太大影響。所以推測是結構中C-11位置上存在雙鍵,可以增強此類化合物對DGAT1的活性。具有DGAT1抑制活性的補骨脂酚類化合物的化學結構見圖4。
2.5 香豆素類
Chai[19]從補骨脂的醋酸乙酯提取物中分離純化得到3個香豆素類化合物,分別命名為bavacoumestan D(24)、bavacoumestan C(25)和bavacoumestan B(26)。測定了這3個化合物對DGAT1的抑制活性,其IC50值分別為(65.2±1.1)、(52.3±1.3)、(116.5±1.2)μmol/L,其中化合物25對DGAT2的IC50值為(154.1±1.5)μmol/L,化合物24、26對DGAT2均無抑制活性。化合物26的抑制活性明顯小于化合物25,是由于C-1′′位置的羥基造成的,而這個羥基也對抑制DGAT2的活性起重要作用。具有DGAT1抑制活性的香豆素類化合物的化學結構見圖5。

圖4 具有DGAT1抑制活性的補骨脂酚類化合物的化學結構
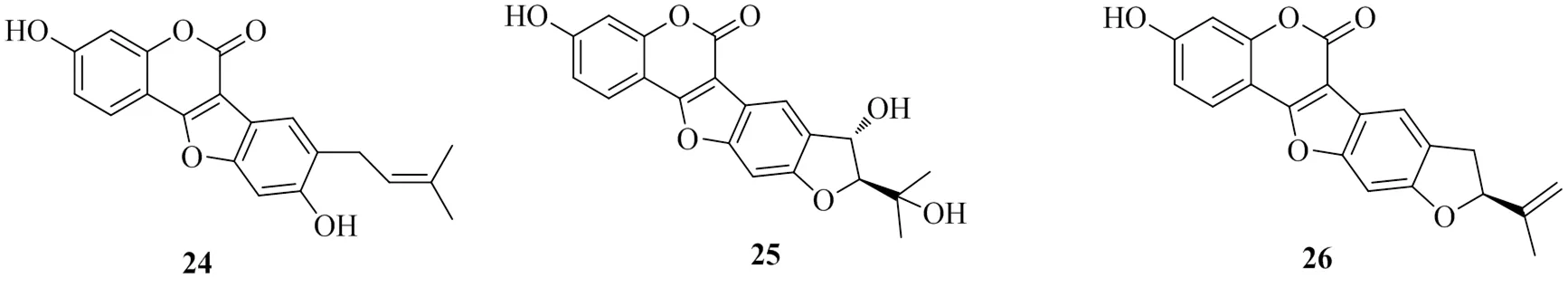
圖5 具有DGAT1抑制活性的香豆素類化合物的化學結構
2.6 二萜二聚體類
Liu等[20]從楝科植物大葉山楝(Wall.) R. N. Parker.中分離純化得到了4個全新的二萜二聚體類化合物。這是從楝科植物中分離出的新的碳骨架的非對映異構體,4個化合物分別命名為aphadilactone A(27)、aphadilactone B(28)、aphadilactone C(29)和aphadilactone D(30)。對這4個化合物進行體外DGAT1活性測試,其中化合物29[IC50為(0.46±0.09)μmol/L]是迄今為止發現的天然產物中活性最強的DGAT1抑制劑,且其對DGAT2抑制活性的IC50>100 μmol/L,無明顯抑制活性。Liu等[20]檢測了這4個化合物在10 μmol/L下的DGAT1抑制活性,發現化合物27、29分別對DGAT1活性的抑制率為25.5%、85.9%,而其他類似物無明顯抑制活性。實驗結果也表明,11′構型,對該活性至關重要,且化合物29中的11構型,使DGAT1的抑制活性增加。結構-活性關系分析表明,DGAT1抑制劑的活性結合位點對底物的立體化學具有很高的選擇性。具有DGAT1抑制活性的二萜二聚體類化合物的化學結構見圖6。
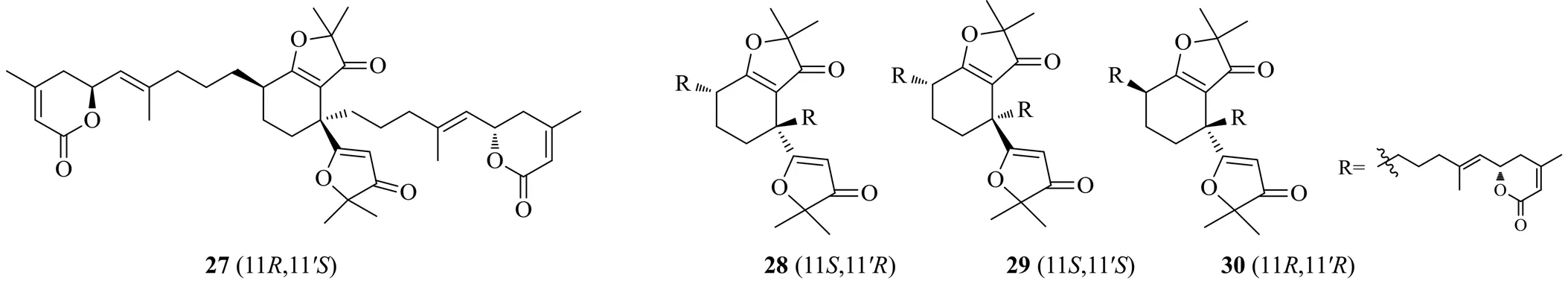
圖6 具有DGAT1抑制活性的二萜二聚體類化合物的化學結構
2.7 醌類
Jung等[21]在玉米L.籽粒中分離出了玉米圓斑病菌,在馬鈴薯蔗糖瓊脂平板上培養2周后,用C18固相萃取柱進一步純化后得到2個醌類化合物,將其命名為cochlioquinone A(31)和cochlioquinone A1(32)。Lee等[22]對這2個化合物進行體外DGAT1活性檢測,其IC50值分別為5.6、6.3 μg/mL。觀察化合物32的化學位移后,發現它是化合物31的衍生物類似物,C-7上的羰基被取代,這2個化合物都有較好的DGAT1抑制活性,可為治療肥胖藥物的研發提供依據。具有DGAT1抑制活性的醌類化合物的化學結構見圖7。
2.8 雜萜類
Lee等[23]從青霉屬F1959中分離得到3個雜萜類化合物,分別命名為phenylpyropenes A(33)、phenylpyropenes B(34)和phenylpyropenes C(35)。測得這3個化合物的IC50值分別為(78.7±1.6)、(21.7±0.2)、(11.04±0.2)μmol/L。隨后用乙酰輔酶A為底物進行了測定DGAT酶動力學參數的實驗,結果表明,與對照組相比,化合物35使最大反應速率分別降低了48%(30 μmol/L)、66%(10 μmol/L)。化合物35的米氏常數(m)為8 μmol/L,抑制常數(i)為10.4 μmol/L,表明化合物35有很強的非競爭抑制性。為了進一步確定化合物35對細胞中TG形成的影響,在完整的細胞分析中使用肝癌HepG2細胞測量了乙酸對細胞脂質的影響。實驗結果表明化合物35以劑量相關性地方式抑制乙酸在TG中的摻入,IC50值為(27.8±7.4)μmol/L,且化合物35在10、30 μmol/L時沒有顯示出細胞毒性。上述具有DGAT1抑制活性的雜萜類化合物的化學結構見圖8。
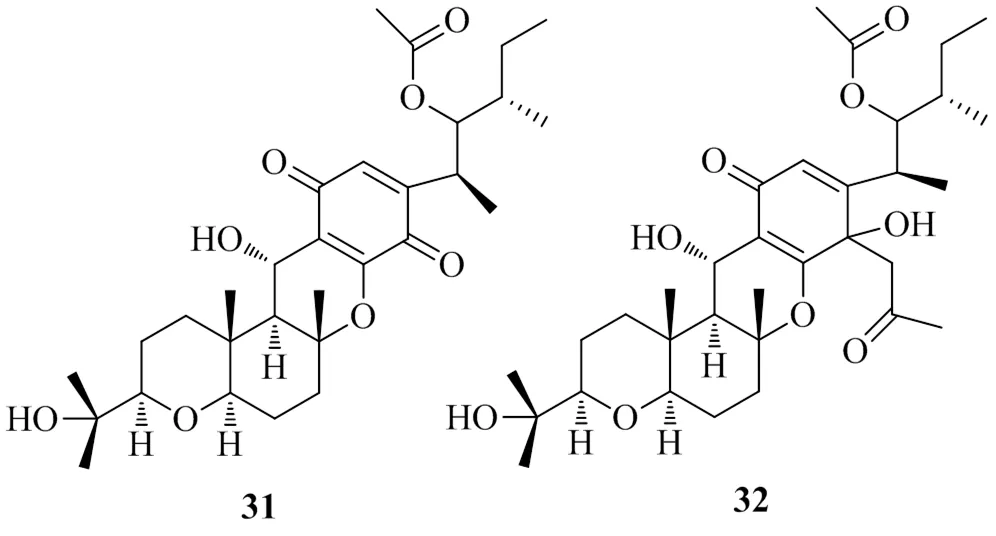
圖7 具有DGAT1抑制活性的醌類化合物的化學結構
2.9 聚乙炔類
Lee等[24]使用大鼠肝臟微粒體作為酶源,通過體外實驗篩選,發現五加科植物人參C. A. Meyer.根的石油醚提取物對DGAT活性具有相對較強的抑制作用。采用硅膠、中低壓制備色譜儀、掃描電鏡和反相高效液相色譜法對人參根的石油醚提取物進行了分餾,分離得到了2個聚乙炔類化合物,根據其1H-NMR、13C-NMR和HMBC數據,結構確定為 (9,10)-epoxyheptadecan-4,6-diyn-3-one(36)和1-methoxy-(9,10)-epoxyheptadecan-4,6-diyn-3-one(37)。測得這2個化合物的IC50值分別為9、32 μg/mL。具有DGAT1活性的聚乙炔類化合物見圖9。
2.10 酚酸類
Inokoshi等[25]從腐質霉屬sp. FO-2942的培養液中分離鑒定了5個三縮酚酸類化合物,分別命名為amidepsines A~E(38~42),其IC50值分別為10.2、19.2、51.6、17.5、124 μmol/L。對比推測,由于R2位置的羥基起作用,當羥基被取代時,該類化合物的抑制活性減弱。上述具有DGAT1活性的酚酸類化合物的化學結構見圖10。
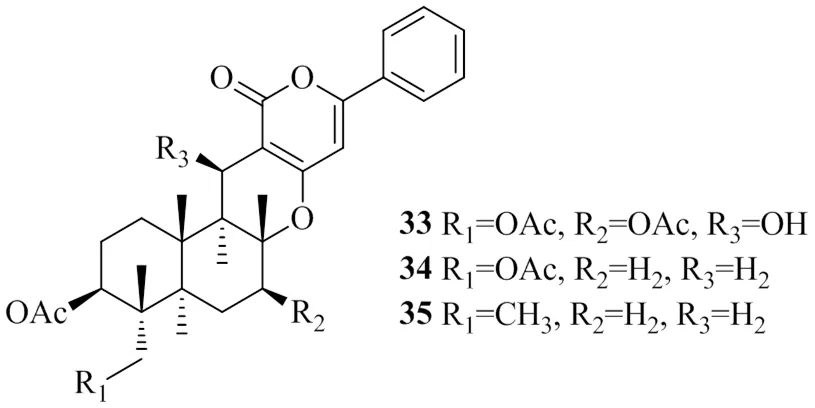
圖8 具有DGAT1抑制活性的雜萜類化合物的化學結構
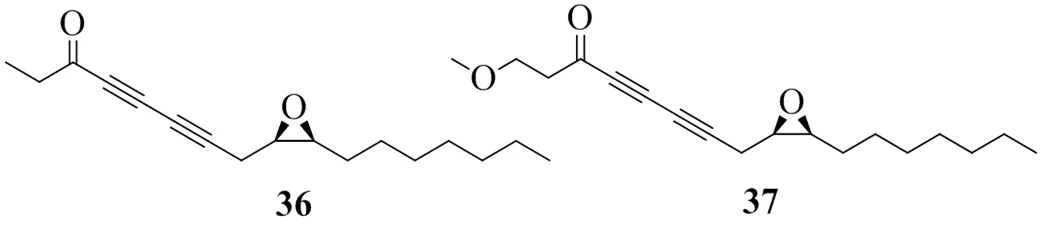
圖9 具有DGAT1抑制活性的聚乙炔類化合物的化學結構
2.11 酰胺類
Lee等[26]從雙子葉植物胡椒L.中分離出5個酰胺類化合物,分別命名為retrofractamide C(43)、(2,4,8)--[9-(3,4-methylenedioxyphenyl)- 2,4,8-nonatrienoyl]piperidine(44)、pipernonaline(45)、piperrolein B(46)和dehydropipernonaline(47),其IC50值分別為900、(29.8±2.4)、(37.2±3.8)、(20.1±1.5)、(21.2±2.1)μmol/L。這5個化合物都是含有不飽和鏈的結構,但是化合物43幾乎沒有DGAT1抑制活性,而化合物44~47具有較好的DGAT1抑制活性。對比發現,它們在支鏈末端的結構不同,具有異丙基結構的支鏈活性明顯小于具有哌啶結構的化合物。由此可知,對于此類化合物,哌啶結構取代異丙基結構會顯著提高其對DGAT1的抑制活性。上述具有DGAT1活性的酰胺類化合物的化學結構見圖11。
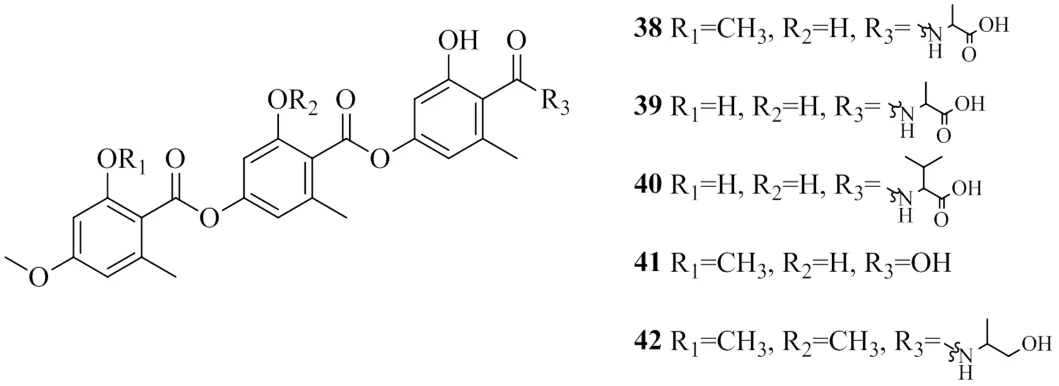
圖10 具有DGAT1抑制活性的酚酸類化合物的化學結構
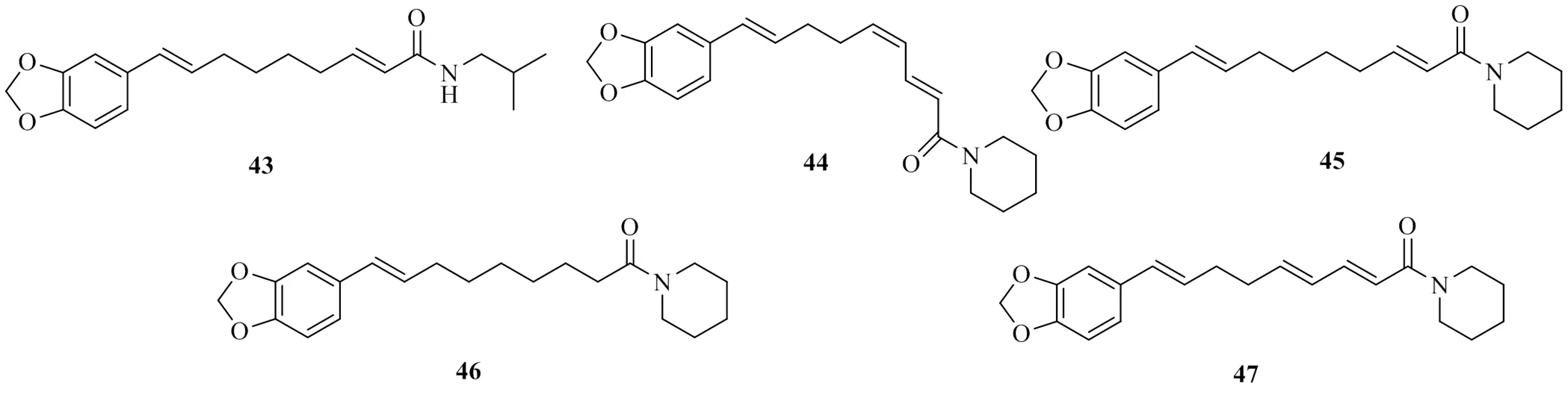
圖11 具有DGAT1抑制活性的酰胺類化合物的化學結構
2.12 倍半萜類
Park等[27]在尋找天然的DGAT1抑制劑時發現菊科植物款冬花L.花蕾的乙醇提取物抑制了大鼠肝臟微粒體蛋白酶DGAT1的活性,IC50值為86.2 μg/mL。將其乙醇提取物進行分離純化,得到4個倍半萜類化合物,分別命名為tussilagonone(48)、tussilagone(49)、7β-(3-ethyl-cis-crotonoyloxy)-1α-(2-methylbutyryloxy)-3,14-dehydro-- notonipetranone(50)和bisabolane-typesesquiterpenoid- 8-angeloyloxy-3,4-epoxy-bisabola-7(14),10-dien-2-one(51)。測定了它們對DGAT1的抑制活性,其IC50值分別為99.2、18.8、47.0、211 μmol/L。對比后發現,化合物49有良好的DGAT1抑制活性。進一步研究化合物49對TG合成的影響,實驗發現,化合物49 20、30 μmol/L對細胞TG的合成的抑制率分別為49%、59%。且HepG2細胞在研究濃度下細胞活力沒有下降,證明抑制作用并不是細胞毒性導致的。上述具有DGAT1抑制活性的倍半萜類化合物的化學結構見圖12。
2.13 苷類
Tabata等[28]從粉紅粘帚霉KF-1040的代謝產物中分離出了4個具有DGAT1抑制活性的苷類化合物,分別命名為roselipin 1A(52)、roselipin 1B(53)、roselipin 2A(54)和roselipin 2B(55)。對其進行體外DGAT1活性檢測后發現,它們的IC50值分別為17、15、22、18 μmol/L。實驗表明,該類化合物在生物體內模擬DG分子與DGAT1相結合從而達到抑制作用。推測此類化合物的DGAT1抑制活性可能跟脂肪酸鏈和阿拉伯糖醇有關。
Meng等[29]從菊科植物墨旱蓮L.中分離得到了6個苷類化合物,根據其1H-NMR,13C-NMR和HMBC數據,分別確定為eprostrata Ⅰ(56)、(5)-trideca-1,5-dien-7,9,11-triyne-3,4-diol-4-β-glucopyranoside(57)、3-β-glucopyranosyl-1-hydroxy-4,6-tetradecene,8,10,12-triyne(58)、2-β-glucosyltrideca-3,11-dien-5,7,9-triyne-1,2,13-triol(59)、2-β--glucosyltrideca-3,11-dien-5,7,9- triyne-1,2-diol(60)和2-β-glucosyltrideca-3,11- dien-5,7,9-triyne-3-1,2-diol(61)。測得其IC50值分別為(93.1±1.2)、(92.4±1.3)、(87.1±1.1)、(81.3±1.3)、(74.4±1.3)、(101.1±1.1)μmol/L,對DGAT2均無抑制活性。上述具有DGAT1活性的苷類化合物的化學結構見圖13。
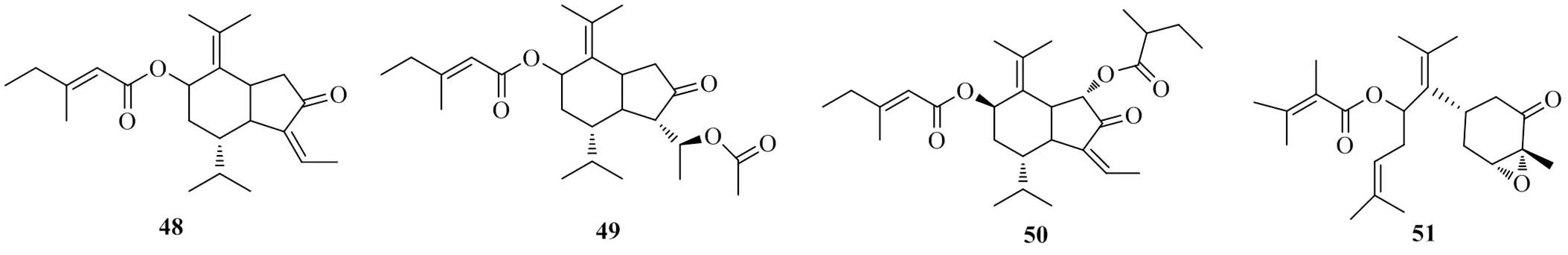
圖12 具有DGAT1抑制活性的倍半萜類化合物的化學結構

圖13 具有DGAT1抑制活性的苷類化合物的化學結構
2.14 噻吩類
Meng等[29]從墨旱蓮的甲醇提取物中分離得到了2個噻吩類化合物,通過核磁數據與相關文獻對比后,鑒定2個化合物分別為α-terthienylmethanol(62)和α-formylterthienyl(63)。對其進行DGAT1的活性檢測,IC50值分別為(89.8±1.4)、(78.4±1.5)μmol/L,且這2個化合物對DGAT2均無抑制活性。具有DGAT1活性的噻吩類化合物的化學結構見圖14。
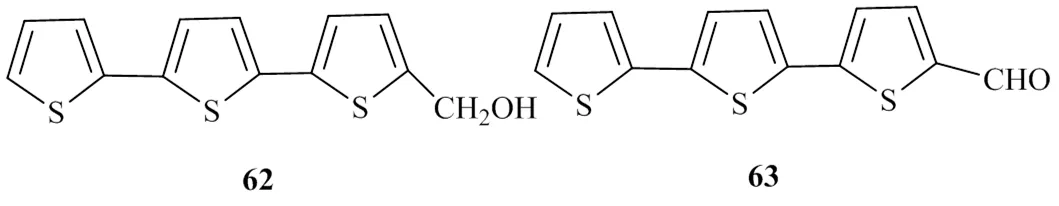
圖14 具有DGAT1抑制活性的噻吩類化合物的化學結構
2.15 喹諾酮生物堿類
Ko等[30]在尋找天然的DGAT1抑制劑過程中發現蕓香科植物吳茱萸(Juss.) Benth.果實的乙醇提取物能顯著地抑制從大鼠肝臟制備的DGAT,對其果實進行分離純化得到了4種喹諾酮生物堿類化合物,分別命名為1-methyl-2-tetradecyl-4(1)-quinolone(64)、evocarpine(65),1-methyl-2-[(4,7)-4,7-decadienyl]-4(1)-quinolone(66)和1-methyl-2-[(4,9)-6,9-pentadecadienyl]-4(1)- quinolone(67)。研究了這4個化合物對大鼠肝臟DGAT1的抑制作用,發現它們以劑量相關地方式抑制DGAT1活性,其IC50值分別為69.5、23.8、20.1、13.5 μmol/L,對比發現,結構中含有雙鍵比不含雙鍵的化合物抑制活性高,提示該類化合物的DGAT1活性與結構中是否含有雙鍵有關,與雙鍵的位置及數量沒有明顯的關系。上述具有DGAT1活性的喹諾酮生物堿類化合物的化學結構見圖15。
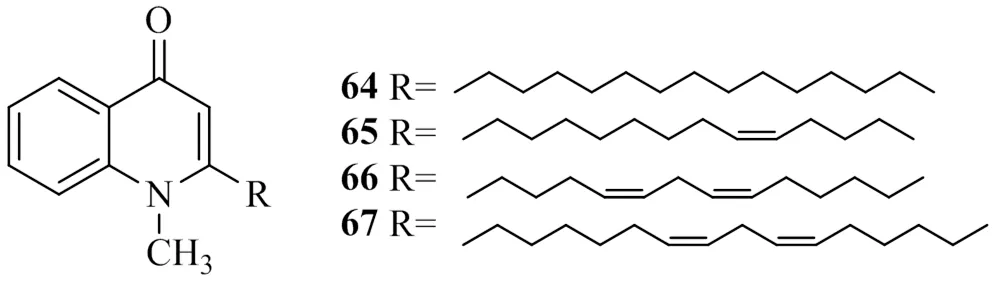
圖15 具有DGAT1抑制活性的喹諾酮生物堿類化合物的化學結構
3 結語
天然產物以其生物來源多樣、代謝產物復雜多變、毒副作用小和活性強等特點,越來越被學者們關注。植物來源的天然產物中具有DGAT1活性的化合物主要包括黃酮類、萜類、香豆素類和酰胺類等。隨著研究的深入,越來越多天然的DGAT1抑制劑不斷被開發。DGAT1抑制劑在解決肥胖、治療高脂血癥等方面的功能逐漸被人們完善,為藥物的研發提供依據。在研發過程中,還有很多問題需要注意。如DGAT1抑制劑的機制是阻止TG的合成,那么對于非脂肪性攝入導致的肥胖可能會沒有藥效。其次,如何處理藥物的毒性以及藥物所帶來的不良反應等問題,都值得去思考和解決。盡管面對諸多的挑戰,以DGAT1抑制劑為基礎研發治療肥胖藥物的前景仍值得期待。
利益沖突 所有作者均聲明不存在利益沖突
[1] Grube B, Chong P W, Lau K Z,. A natural fiber complex reduces body weight in the overweight and obese: A double-blind, randomized, placebo-controlled study [J]., 2013, 21(1): 58-64.
[2] Poirier P, Giles T D, Bray G A,. Obesity and cardiovascular disease: Pathophysiology, evaluation, and effect of weight loss [J]., 2006, 26(5): 968-976.
[3] Khera R, Murad M H, Chandar A K,. Association of pharmacological treatments for obesity with weight loss and adverse events: A systematic review and meta-analysis [J]., 2016, 315(22): 2424-2434.
[4] Cases S, Stone S J, Zhou P,. Cloning of DGAT2, a second mammalian diacylglycerol acyltransferase, and related family members [J]., 2001, 276(42): 38870-38876.
[5] 牛永志, 王國平, 鄭昀曄, 等. 煙草DGAT基因家族全基因組鑒定與分析 [J]. 中國煙草科學, 2020, 41(1): 1-8.
[6] Orland M D, Anwar K, Cromley D,. Acyl coenzyme A dependent retinol esterification by acyl coenzyme A: Diacylglycerol acyltransferase 1 [J]., 2005, 1737(1): 76-82.
[7] Turchetto-Zolet A C, Maraschin F S, de Morais G L,. Evolutionary view of acyl-CoA diacylglycerol acyltransferase (DGAT), a key enzyme in neutral lipid biosynthesis [J]., 2011, 11: 263.
[8] Li F L, Wu X M, Lam P,. Identification of the wax ester synthase/acyl-coenzyme A: Diacylglycerol acyltransferase WSD1 required for stem wax ester biosynthesis in[J]., 2008, 148(1): 97-107.
[9] Saha S, Enugutti B, Rajakumari S,. Cytosolic triacylglycerol biosynthetic pathway in oilseeds. Molecular cloning and expression of peanut cytosolic diacylglycerol acyltransferase [J]., 2006, 141(4): 1533-1543.
[10] Conte G, Serra A, Cremonesi P,. Investigating mutual relationship among milk fatty acids by multivariate factor analysis in dairy cows [J]., 2016, 188: 124-132.
[11] Lacasse P, Ollier S, Lollivier V,. New insights into the importance of prolactin in dairy ruminants [J]., 2016, 99(1): 864-874.
[12] Oh K Y, Lee J H, Curtis-Long M J,. Glycosidase inhibitory phenolic compounds from the seed of[J]., 2010, 121(4): 940-945.
[13] Yin S, Fan C Q, Wang Y,. Antibacterial prenylflavone derivatives from, and their structure-activity relationship study [J]., 2004, 12(16): 4387-4392.
[14] Li J L, Li N, Lee H S,. Four new sesqui-lignans isolated fromand their diacylglycerol acyltransferase (DGAT) inhibitory activity [J]., 2016, 109: 185-189.
[15] Zhang N, Li N, Sun Y N,. Diacylglycerol compounds from barks ofwith inhibitory activity against acyltransferase [J]., 2014, 6(2): 164-167.
[16] Latha P G, Evans D A, Panikkar K R,. Immunomodulatory and antitumour properties ofseeds [J]., 2000, 71(3): 223-231.
[17] Wu C Z, Hong S S, Cai X F,. Hypoxia-inducible factor-1 and nuclear factor-κB inhibitory meroterpene analogues of bakuchiol, a constituent of the seeds of[J]., 2008, 18(8): 2619-2623.
[18] Lin X, Li B B, Zhang L,. Four new compounds isolated fromand their diacylglycerol acyltransferase (DGAT) inhibitory activity [J]., 2018, 128: 130-134.
[19] Chai M Y. A new bioactive coumestan from the seeds of[J]., 2020, 22(3): 295-301.
[20] Liu J, He X F, Wang G H,. Aphadilactones A-D, four diterpenoid dimers with DGAT inhibitory and antimalarial activities from a Meliaceae plant [J]., 2014, 79(2): 599-607.
[21] Jung H J, Burm Lee H, Lim C H,. Cochlioquinone A1, a new anti-angiogenic agent from[J]., 2003, 11(22): 4743-4747.
[22] Lee H B, Lim C H, Kwon H J,. Inhibitory activity of diacylglycerol acyltransferase by cochlioquinones A and A1 [J]., 2003, 56(11): 967-969.
[23] Lee S W, Rho M C, Choi J H,. Inhibition of diacylglycerol acyltransferase by phenylpyropenes produced byF1959 [J]., 2008, 18(11): 1785-1788.
[24] Lee S W, Kim K, Rho M C,. New Polyacetylenes, DGAT inhibitors from the roots of[J]., 2004, 70(3): 197-200.
[25] Inokoshi J, Takagi Y, Uchida R,. Production of a new type of amidepsine with a sugar moiety by static fermentation ofsp. FO-2942 [J]., 2010, 63(1): 9-16.
[26] Lee S W, Rho M C, Park H R,. Inhibition of diacylglycerol acyltransferase by alkamides isolated from the fruits ofand[J]., 2006, 54(26): 9759-9763.
[27] Park H R, Yoo M Y, Seo J H,. Sesquiterpenoids isolated from the flower buds ofL. inhibit diacylglycerol acyltransferase [J]., 2008, 56(22): 10493-10497.
[28] Tabata N, Ohyama Y, Tomoda H,. Structure elucidation of roselipins, inhibitors of diacylglycerol acyltransferase produced byKF-1040 [J]., 1999, 52(9): 815-826.
[29] Meng X, Li B B, Lin X,. New polyacetylenes glycoside fromwith DGAT inhibitory activity [J]., 2019, 21(6): 501-506.
[30] Ko J S, Rho M C, Chung M Y,. Quinolone alkaloids, diacylglycerol acyltransferase inhibitors from the fruits ofrutaecarpa [J]., 2002, 68(12): 1131-1133.
Research progress on natural sources of diacylglycerol acyltransferase inhibitors
XIONG Da-xi, CUI Long
College of Pharmacy, Beihua University, Jilin 132000, China
Diacylglycerol acyltransferase (DGAT), the only rate-limiting enzyme, is catalytic enzyme in the last step of triglyceride synthesis which closely related to fat metabolism and lipid deposition in tissues. Many compounds have novel structures, strong activity and low side effects, so natural products are the first choice of inhibitors. In order to find effective natural DGAT inhibitors, the types of compounds with better inhibitory activity in natural products are reviewed in this paper.
natural products; diacylglycerol acyltransferase; structure-activity relationship; obesity; diabetes
R282.71
A
0253 - 2670(2021)13 - 4074 - 08
10.7501/j.issn.0253-2670.2021.13.031
2020-11-02
吉林省科技發展計劃項目(20191102056YY)
熊大璽(1996—),男,碩士研究生,主要從事天然藥物化學研究。Tel: 13894728078 E-mail: 1440521360@qq.com
崔 龍(1971—),男,教授,博士,主要從事天然藥物化學研究。Tel: 18604498621 E-mail: cuilong71@163.com
[責任編輯 崔艷麗]