基于催化原理解決高考中的催化劑試題
廣東 張 超 余曉梅
催化劑在生命現象和現代工業中發揮著重要作用,催化化學已經成為當代化學學科發展的前沿和趨勢。《普通高中化學課程標準(2017年版2020年修訂)》(以下簡稱《課程標準》指出:“知道化學反應是有歷程的,認識基元反應活化能對化學反應速率的影響。知道催化劑可以改變反應歷程,對調控化學反應速率具有重要意義。”《課程標準》中與催化劑有關的描述頗多,體現了課程教學要與生產實際相結合,高考中對催化劑的關注和考查也越來越深刻,需要師生對催化劑的原理有更加深刻的認識,然而中學化學教材中關于催化劑的內容鮮有更新而且對原理的講解較為簡單和模糊,本文結合大學教材中催化劑的理論基礎,從催化劑的反應歷程、催化劑的種類和催化劑的選擇性出發,對歷年與催化劑相關的高考試題,進行較深入的分析和解讀,論述高考命題的價值導向和科學導向,以期對化學高考的有效復習提供一定的指向。
一、催化劑及催化反應歷程圖
中學教材中催化劑的概念是“能改變化學反應速率而在反應前后本身的質量和化學性質不變的物質”,其中“改變”包括“加快”和“減慢”兩層含義;而2014年國際純粹與應用化學聯合會(簡稱“IUPAC”)已將“催化劑(Catalyst)”定義為“催化劑是增加反應速率但不改變總反應的標準吉布斯自由能的物質,催化劑既是反應的反應物,也是該反應的生成物”,而且其中具有減慢反應速率作用的物質被稱為“抑制劑(Inhibitor)”。另外,其實催化劑是有“壽命”的,雜質、高溫等因素會導致催化劑失活,高中階段這些不完備的認識是由于學生對催化劑的反應歷程認知不完備。
反應歷程是指化學反應所經歷的途徑或過程,又稱反應機理。化工生產中通過研究反應的反應歷程,從而找出決定反應速率的關鍵,進而控制和利用反應,達到生產中多快好省的目的。
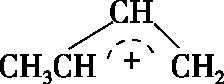
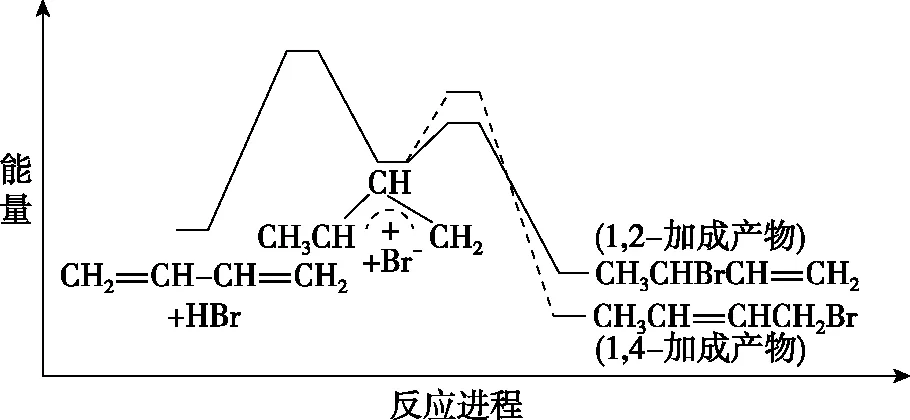
圖1
( )
A.1,4-加成產物比1,2-加成產物穩定
B.與0℃相比,40℃時1,3-丁二烯的轉化率增大
C.從0℃升至40℃,1,2-加成正反應速率增大,1,4-加成正反應速率減小
D.從0℃升至40℃,1,2-加成正反應速率的增大程度小于其逆反應速率的增大程度
【答案】AD
【解析】本題考查化學反應和能量的關系。物質的能量越低越穩定,由圖1可以看出1,4-加成產物的能量更低,因此更穩定,A正確;由圖1可以看出該反應為放熱反應,升高溫度平衡向逆反應方向進行,反應物的轉化率降低,即40℃的轉化率更低,B錯誤;溫度升高反應速率加快,兩個反應的速率都加快,C錯誤;由于溫度升高平衡逆向移動,所以正反應速率增大的程度小于逆反應速率增大的程度,D正確。
【練習1】(2018·海南卷·12)炭黑是霧霾中的重要顆粒物,研究發現它可以活化氧分子,生成活化氧。活化過程的能量變化模擬計算結果如圖2所示。活化氧可以快速氧化二氧化硫。下列說法正確的是
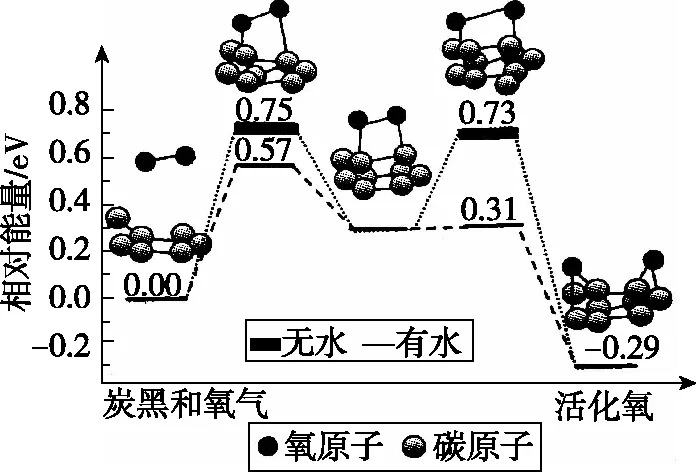
圖2
( )
A.每活化一個氧分子吸收0.29 eV的能量
B.水可使氧分子活化反應的活化能降低0.42 eV
C.氧分子的活化是O—O的斷裂與C—O鍵的生成過程
D.炭黑顆粒是大氣中二氧化硫轉化為三氧化硫的催化劑
【答案】CD
【啟示】大部分催化劑都會參與反應歷程,改變反應的路徑,形成中間產物,減小反應的活化能,根據過渡態理論,先找到過渡態,算出該反應歷程中最大能壘(活化能),活化能越大,反應速度越慢;催化劑在某個歷程中被消耗,在另外的歷程中又重新生成,根據這種循環的機制確定催化劑:先與最初反應物分子參與反應,又在生成最后產物的同時生成的物質為催化劑,其他物質通常是中間產物。
二、催化反應的類型
有催化劑參加的反應稱為催化反應。根據催化劑和反應物存在的狀態來劃分,催化反應通常可以分為均相催化反應和多相催化反應,前者催化劑和反應物質處在同一相,如均為氣態或液態,后者則不是同一相,這時反應在兩相界面上進行。工業上的許多重要的催化反應大多是多相催化反應,而且催化劑以固體物質,反應物為氣態或者液態居多。
1.均相催化


即反應物先與催化劑生成不穩定的中間產物,然后中間產物再分解成產物,而催化劑得以再生。由于生成中間產物的反應①和中間產物分解反應②的活化能都小于原反應的活化能,所以先生成中間產物,再分解成生成物就成了反應的一條捷徑,降低了反應的活化能。在配位催化過程中,催化劑大多數是配合物,或者是反應歷程中催化劑與反應物生成了配合物,在研究該反應需要充分考慮到配合物的結構特點。
在均相催化反應中也存在不需另加催化劑而能自動發生催化作用的情況,即是自催化反應。例如,加熱分解高錳酸鉀制取氧氣的反應,隨著反應的進行,反應速率逐漸加快,這是由于反應生成的二價錳離子對該反應具有催化作用。均相催化劑一般具有高活性、高選擇性和反應條件溫和等優點,但最大的問題是催化劑的分離回收。
【例2】(2020·全國卷Ⅱ·11)據文獻報道:Fe(CO)5催化某反應的一種反應機理如圖3所示。下列敘述錯誤的是
圖3
( )
A.OH-參與了該催化循環
B.該反應可產生清潔燃料H2
C.該反應可消耗溫室氣體CO2
D.該催化循環中Fe的成鍵數目發生變化
【答案】C

【練習2】(2020·全國卷Ⅰ·10)銠的配合物離子[Rh(CO)2I2]-可催化甲醇羰基化,反應過程如圖4所示。
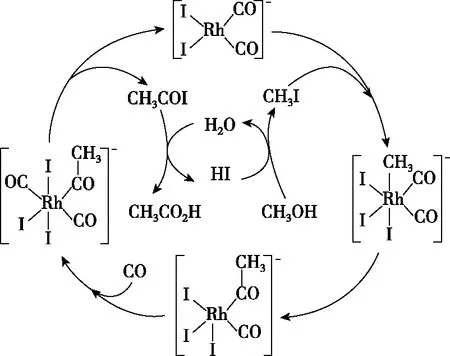
圖4
下列敘述錯誤的是
( )
A.CH3COI是反應中間體

C.反應過程中Rh的成鍵數目保持不變

【答案】C
2.多相催化
多相催化在化工生產和科學實驗中大量應用,最常見的催化劑是固體,反應物為氣體或者液體。由于多相催化與表面吸附有關,所以比表面積越大,催化效率越高。在工業上,催化劑通常附著在一些不活潑的多孔性物質上,這種物質稱為催化劑的載體。載體的作用是使催化劑分散在載體上,產生較大的表面積,同時可以節省催化劑的用量。常用的載體有硅藻土,高嶺土、硅膠和分子篩等。有時在反應體系中含有少量的某些物質,就會嚴重降低甚至完全破壞催化劑的活性。這種物質稱為催化毒物,這種現象稱為催化劑中毒。因此,應用多相催化于工業生產中,保持原料的純凈是十分重要的。
【例3】(2020·浙江七月選考·29節選)(2)①CO2和C2H6按物質的量1∶1投料,在923 K和保持總壓恒定的條件下,研究催化劑X對“CO2氧化C2H6制C2H4”的影響,所得實驗數據如表1:

表1
結合具體反應分析,在催化劑X作用下,CO2氧化C2H6的主要產物是________,判斷依據是________。
②采用選擇性膜技術(可選擇性地讓某氣體通過而離開體系)可提高C2H4的選擇性(生成C2H4的物質的量與消耗C2H6的物質的量之比)。在773 K,乙烷平衡轉化率為9.1%,保持溫度和其他實驗條件不變,采用選擇性膜技術,乙烷轉化率可提高到11.0%。結合具體反應說明乙烷轉化率增大的原因是________________。
【答案】①CO,C2H4的產率低,說明催化劑X有利于提高反應Ⅲ速率
②選擇性膜吸附C2H4,促進反應Ⅱ平衡正向移動
【解析】①由數據可知,CO2的轉化率約為乙烷的兩倍,且生成乙烯的量遠小于乙烷的轉化量,說明該過程中是以反應Ⅲ為主,催化劑主要加快了反應Ⅲ的速率。②選擇性膜使生成的乙烯通過并離開反應體系,降低了乙烯濃度,則有利于反應Ⅱ平衡正向移動,從而提高乙烯的產率。
【練習3】(2018·北京卷·8)我國科研人員提出了由CO2和CH4轉化為高附加值產品CH3COOH的催化反應歷程。該歷程示意圖如圖5所示。
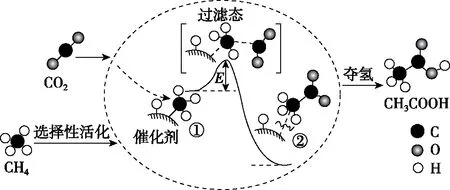
圖5
下列說法不正確的是
( )
A.生成CH3COOH總反應的原子利用率為100%


D.該催化劑可有效提高反應物的平衡轉化率
【答案】D
【啟示】該題是多相催化反應,由于多相催化與表面吸附有關,所以一般比表面積越大,催化效率越高。因此過多的雜質氣體吸附在催化劑表面,會造成催化劑表面對反應物的吸附下降,從而導致催化劑的部分失活。
三、催化的選擇性
催化反應一般是多步驟的,催化劑的化學選擇性一般是可同時進行幾種并行的反應或進行經過生成中間產物的串行反應,從而使反應出現主要反應和副反應之分,相應地反應產物也有主產物和副產物之分,由此就產生了催化劑的選擇性問題。所謂催化劑選擇性是指催化劑加速主要反應的程度,即反應物消耗于生成主產物的百分數。




其中可近似認為第二步反應不影響第一步的平衡。下列表述正確的是________(填標號)。
A.v(第一步的逆反應)>v(第二步反應)
B.反應的中間產物只有NO3
C.第二步中NO2與NO3的碰撞僅部分有效
D.第三步反應活化能較高
【答案】AC
【解析】此反應由若干個基元反應組成,第一步基元反應快速平衡,第二步是慢反應,由于慢反應是整個反應的決速步驟,故相較第一步快速平衡而言,其速率更小,A正確;而對比各步基元反應發現,中間產物有NO3和NO,B錯誤;根據有效碰撞理論,分子發生反應的條件是成為活化分子和合理的取向,不論快慢反應亦是如此,且第二步的反應速率慢更加說明NO2與NO3的碰撞僅部分有效,C正確;活化能越高,則普通分子變成活化分子越困難,發生有效碰撞幾率越小,反應速率越慢,第三步卻是快反應,故D錯誤。
【啟示】該題是串行反應,總反應速率由慢反應決定,催化劑通過催化其中的慢反應而發揮作用,加入催化劑降低慢反應的活化能,從而提高反應速率。對于并行反應,選用不同的催化劑可增大工業上所需要的某個反應的速率,同時對其他不需要的反應加以抑制,從而表現出催化劑是具有選擇性的。另外,對某一反應來說,起催化作用的物質往往有多種,不同的催化劑催化效果也不同,同時注意溫度對催化劑的活性有顯著影響,在復習備考中,要注重知識之間的邏輯關系,使知識結構化和系統化。

相關數據如表2:
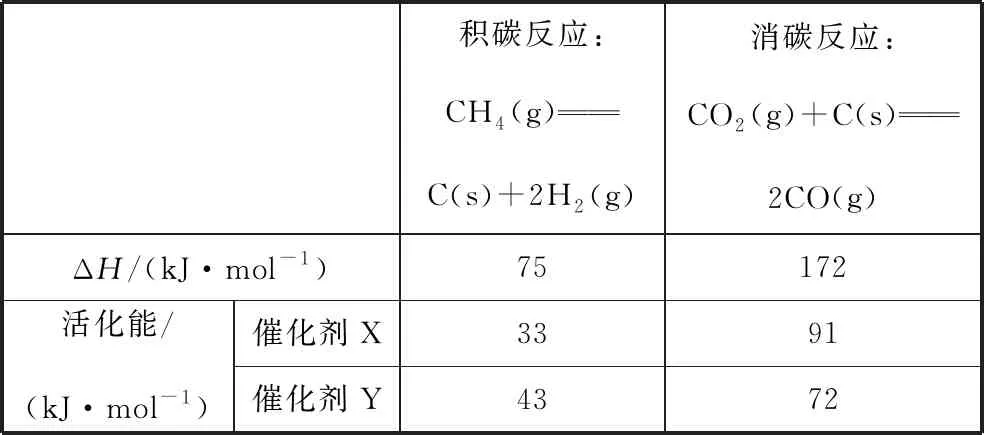
表2
由表2判斷,催化劑X________(填“優于”或“劣于”)Y,理由是________________。
【答案】劣于 相對于催化劑X,催化劑Y積碳反應的活化能大,積碳反應的速率小,而消碳反應活化能相對小,消碳反應速率大。
催化劑的選擇性還包括區域選擇性和對映選擇性。當反應物分子中有幾個部分可以發生反應時,催化劑的加入使反應主要在某一部分發生,生成需要的目標產物,則催化劑的區域選擇性高。當具有潛手性中心的反應物分子進行不對稱催化反應時,催化劑主要促進產物中某一種對映異構體生成,則此催化劑的對映選擇性高。


