Ca(H2PO4)2-H3PO4-K2SO4體系中石膏晶型及形貌調控
吳 欽,楊 林,易 蕓,耿平蘭,曹建新
(1.貴州大學化學與化工學院,貴陽 550025;2.貴州大學,貴州省綠色化工與清潔能源技術重點實驗室,貴陽 550025;3.貴州大學,貴州省工業廢棄物高效利用工程研究中心,貴陽 550025;4.貴州省產品質量檢驗檢測院,貴陽 550016)
0 引 言
磷酸二氫鉀是一種化學性質穩定、無味、無毒、易溶于水的高濃度磷鉀復肥,廣泛應用于工業、農業、醫藥業以及食品行業[1-2]。磷酸二氫鉀的制備方法有多種,如中和法、復分解法、萃取法、離子交換法、直接法、結晶法和電解法等,其中中和法因得到的磷酸二氫鉀產品質量穩定、純度高而占據主導地位[3]。中和法以熱法磷酸和氫氧化鉀或碳酸鉀為原料,通過酸堿中和反應制得磷酸二氫鉀,因所用原料價格昂貴,導致生產成本過高,目前主要應用于工業、食品和醫藥行業,未能在農業上得到推廣[4]。我國是農業大國,開發出一種低成本的磷酸二氫鉀制備方法意義重大。
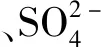
1 實 驗
1.1 實驗原料
碳酸鈣(≥99.0%)、磷酸(≥85%)、硫酸鉀(≥99.0%),均為分析純,購自成都金山化學試劑有限公司;硫酸(95%~98%),分析純,購自重慶川東化工有限公司;實驗用水為去離子水。
1.2 實驗方法
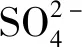
(1)
(2)
式中:W1和W2分別表示以CaO計加入碳酸鈣質量和磷酸二氫鈣溶液質量;mK2SO4、mH2SO4、mCaO分別表示K2SO4、H2SO4、CaO的摩爾數。
將分別預熱至設定溫度的磷酸二氫鈣溶液和硫酸鉀溶液攪拌下混合至設定反應時間、迅速抽濾。濾餅95 ℃熱水洗滌三次、無水乙醇洗滌兩次、60 ℃干燥,制得石膏樣品;收集熱水洗滌后的濾液待測。實驗裝置如圖1所示。
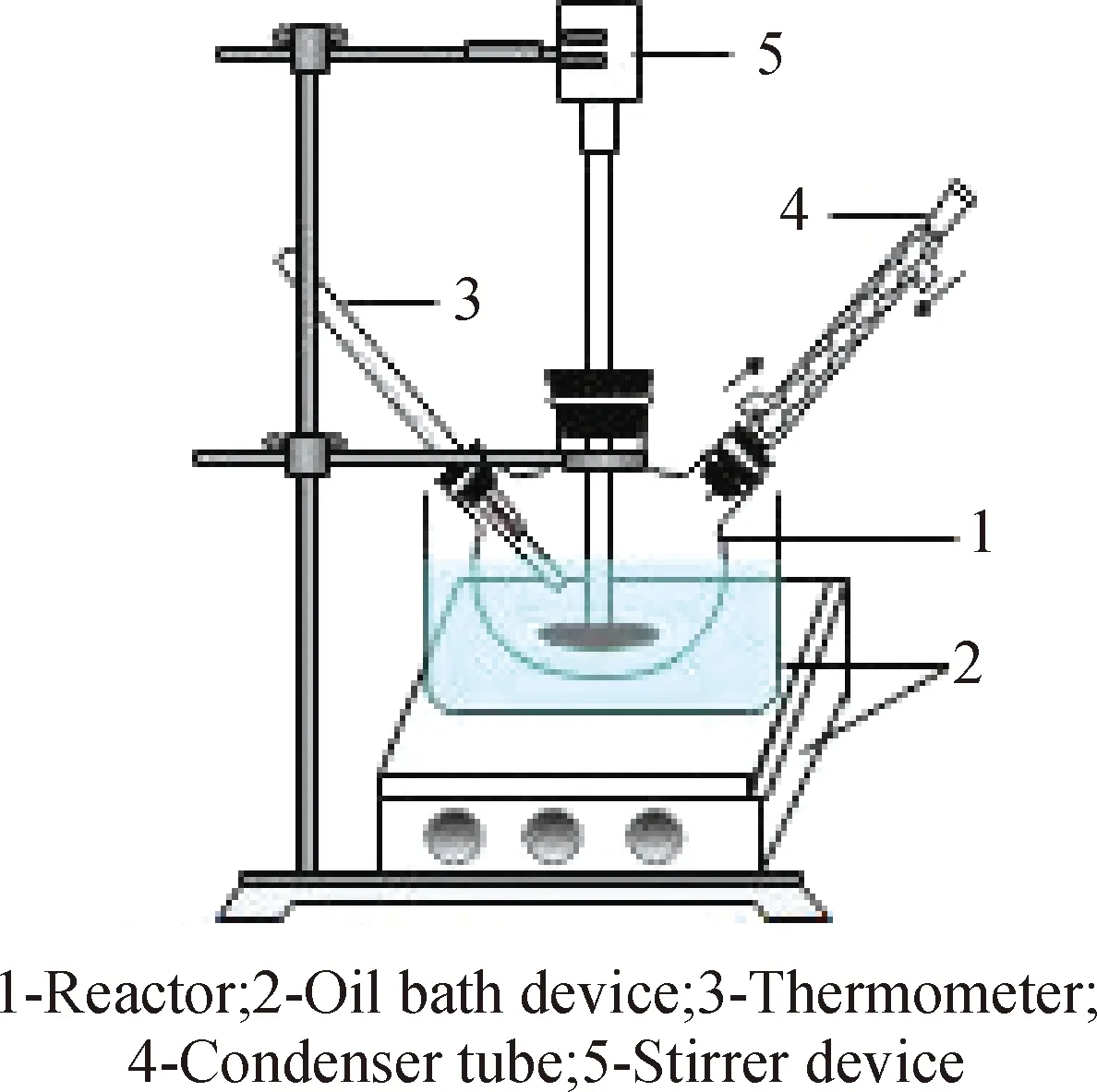
圖1 實驗裝置示意圖Fig.1 Schematic diagram of experimental set-up
采用X射線衍射儀(德國Bruker D8 Advance)分析樣品的物相組成,測試條件:Cu靶,電壓40 kV,電流40 mA,掃描范圍2θ為10°~80°,步幅為0.02°;采用掃描電子顯微鏡(日本Hitachi SU8010)觀察樣品的微觀形貌,加速電壓為10 kV。
采用四苯硼鈉重量法和EDTA滴定法分別檢測熱水洗滌后濾液中鉀和鈣含量。鉀收率ηk和脫鈣率ηCa分別按式(3)、(4)計算:
(3)
(4)
式中:W3和W4分別表示濾液和反應體系中K含量;W5和W6分別表示反應體系和濾液中Ca含量。
2 結果與討論
2.1 反應條件對石膏晶型和形貌的影響
2.1.1 反應時間的影響
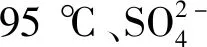
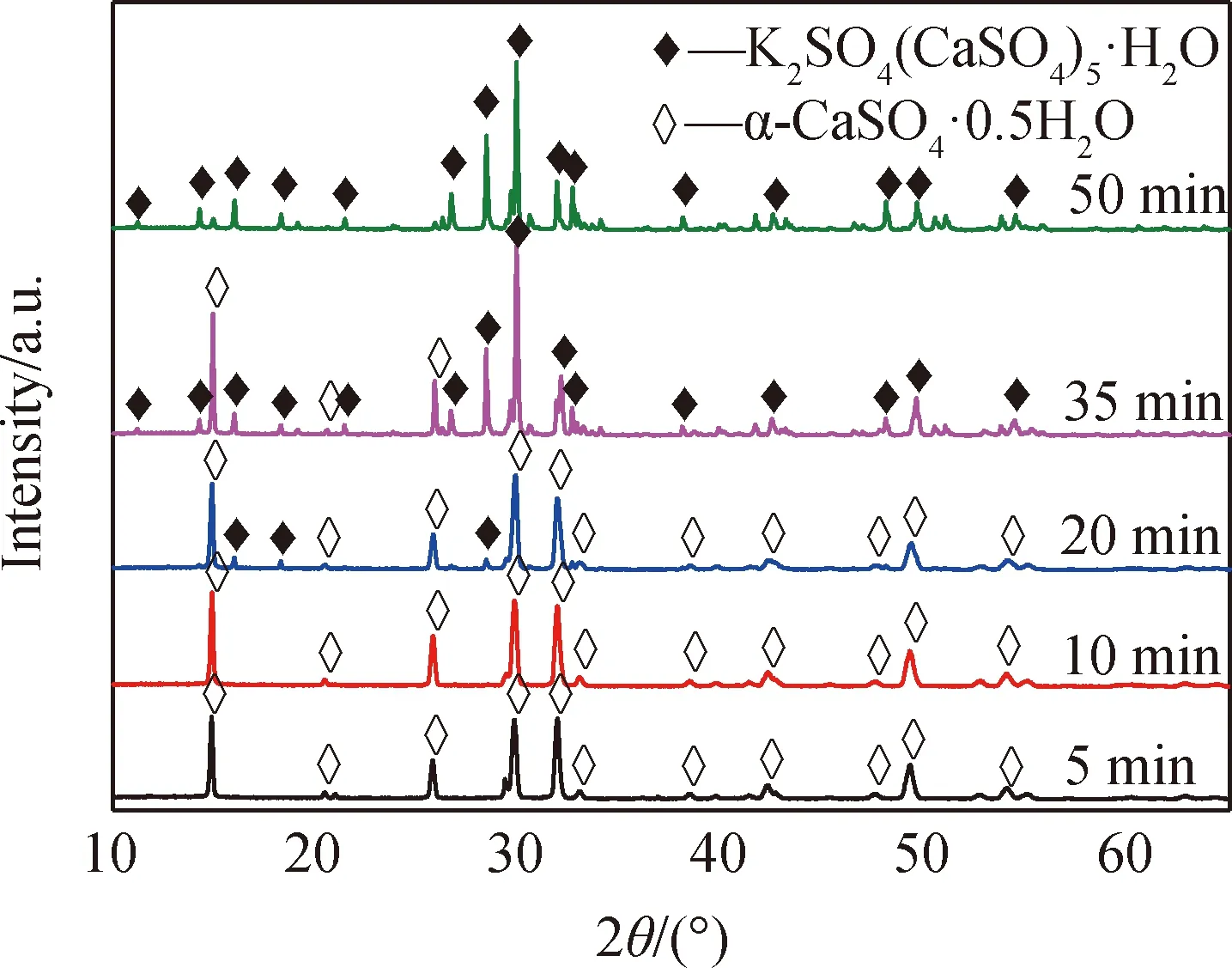
圖2 不同反應時間制得樣品的XRD圖譜Fig.2 XRD patterns of samples prepared for different reaction time
圖3顯示,在5 min時,得到呈六棱形錐面短柱狀的α-CaSO4·0.5H2O,晶體長度為42~70 μm、直徑為13~24 μm,表面較為光滑、缺陷較少,同時存在晶體朝不同取向交錯生長的聚晶體,以及極少量錐面呈犬牙狀形貌的晶體;10 min時,部分晶體表面缺陷和犬牙狀形貌晶體增多;而到20 min時,晶體表面明顯粗糙,且原本輪廓較為清晰分明的晶體錐面幾乎全呈現參差不齊的犬牙狀形貌。過快的生長速度會導致產生較多缺陷,晶體表面的光滑度下降[12],α-CaSO4·0.5H2O晶體在5 min即已生長完成,因此,反應過快是產生較多聚晶體和缺陷的主要原因。
圖4顯示,晶體的柱面和錐面元素組成除了硫酸鈣的特征元素O、Ca、S外,還存在K元素,說明反應過程中有K進入到晶體的晶格中,并形成K2SO4(CaSO4)5·H2O(而反應時間分別為5 min和10 min時制得的樣品XRD分析未檢出K2SO4(CaSO4)5·H2O,可能是其含量過低所致)。此外,可以明顯地觀察到,20 min樣品晶體錐面的譜圖中K元素對應的峰值明顯增加,而柱面無明顯變化,說明此時晶體錐面上K元素的含量增加,由此推測,K2SO4(CaSO4)5·H2O的形成主要從晶體錐面開始并形成犬牙狀形貌。因此,隨著反應的進行,K會進入到晶體晶格,造成晶體缺陷,并主要從晶體錐面開始轉變為K2SO4(CaSO4)5·H2O,呈現錐面犬牙狀形貌。

圖4 不同反應時間制得樣品的SEM照片及EDS譜圖Fig.4 SEM images and EDS spectra of samples prepared for different reaction time
2.1.2 反應溫度的影響
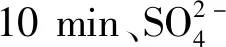
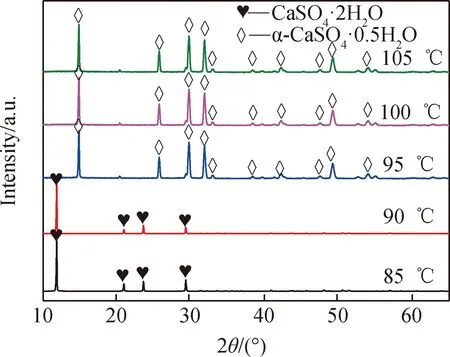
圖5 不同反應溫度制得樣品的XRD圖譜Fig.5 XRD patterns of samples prepared at different reaction temperatures

圖6 不同反應溫度制得樣品的SEM照片Fig.6 SEM images of samples prepared at different reaction temperatures
圖5顯示,反應溫度在90 ℃及以下時,得到CaSO4·2H2O相;反應溫度在95 ℃及以上,可得到α-CaSO4·0.5H2O相。相同磷酸濃度下,α-CaSO4·0.5H2O在較高的溫度區間內穩定[13],因此,本實驗條件下,將溫度升至95 ℃及以上溫度范圍,可得到α-CaSO4·0.5H2O。
從圖6中可以看出,在95 ℃和100 ℃均制得六棱形錐面短柱狀α-CaSO4·0.5H2O,晶體大小基本一致,而100 ℃晶體聚晶和缺陷現象更為嚴重一些。這是由于溫度越高,反應越快,晶體的完整性越差且越容易團聚。
圖7 不同過量系數ξ制得樣品的XRD圖譜Fig.7 XRD patterns of samples prepared with different excess coefficient ξ

圖8 不同過量系數ξ制得樣品的SEM照片Fig.8 SEM images of samples prepared with different excess coefficient ξ
2.1.4 CaO含量的影響

圖9 不同CaO含量制得樣品的XRD圖譜Fig.9 XRD patterns of samples prepared with different CaO content

圖10 不同CaO含量制備的石膏的SEM照片Fig.10 SEM images of samples prepared with different CaO content
從圖9中可以看出,當CaO的含量在3.5%~5.0%時,得到的產物是α-CaSO4·0.5H2O,而CaO含量增加到5.5%時,產物為CaSO4·2H2O及少量的CaSO4·0.5H2O。究其原因,CaO含量高(即加入的碳酸鈣量較多),反應消耗磷酸較多,在體系磷酸加量不變的條件下,相當于過量磷酸量少,以致體系磷酸濃度降低,而易生成CaSO4·2H2O[13]。
從圖10中可以看出,當CaO含量為3.5%時,得到的α-CaSO4·0.5H2O晶體缺陷和聚晶較少,幾乎沒有犬牙狀形貌的K2SO4(CaSO4)5·H2O晶體。隨著CaO含量的增加,晶體缺陷、聚晶和犬牙狀形貌晶體同樣有所增加,這應該是Ca2+增加使反應速度增快所致,但總體變化并不明顯。同時可以觀察到,CaO含量增加,晶體向長徑比減小的短柱狀發展。這是因為,CaO含量增加,體系Ca2+濃度增大,生長基元在Ca2+基團少的晶體側面上疊合速度增快,從而得到長徑比相對較小的短柱狀α-CaSO4·0.5H2O晶體[14]。
2.2 反應條件對鉀收率和脫鈣率的影響
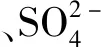
由圖11(a)可見,隨著反應時間增加,鉀收率和脫鈣率均呈現下降趨勢。隨著時間的增加,逐漸形成K2SO4(CaSO4)5·H2O(見圖2),導致鉀收率和脫鈣率降低。可以發現,5 min、10 min的鉀收率和脫鈣率分別為94.68%和85.06%、94.23%和83.80%,二者相差不大,考慮到使物料能充分混合反應(CaO含量高時磷酸二氫鈣為懸浮液),反應時間選10 min為宜。
由圖11(b)可見,隨著反應溫度的增加,鉀收率先增加,到95 ℃后降低;脫鈣率在85 ℃到90 ℃區間略降低,在90 ℃到95 ℃區間上升后趨于穩定。結合圖5分析可知,溫度低于95 ℃時,主要生成CaSO4·2H2O(通常呈片狀),容易包裹液相攜帶鉀,不易洗滌分離;而溫度高于95 ℃時,容易形成K2SO4(CaSO4)5·H2O,均會使鉀收率降低。85 ℃到90 ℃區間,生成的CaSO4·2H2O溶解度隨溫度的增加而略微增大[15],使脫鈣率略微降低;而95 ℃后產物為α-CaSO4·0.5H2O相,其溶解度較CaSO4·2H2O小,導致脫鈣率上升。可見,反應溫度選95 ℃為宜。
由圖11(d)可見,CaO含量從3.5%增到5.0%時,鉀收率和脫鈣率基本保持不變,而當增加到5.5%時,二者均有所降低。CaO含量在3.5%~5.0%之間,產物均是α-CaSO4·0.5H2O,對形成K2SO4(CaSO4)5·H2O影響并不明顯(見圖9),從而對鉀收率和脫鈣率影響不大;當CaO含量增加到5.5%時,體系中主要生成CaSO4·2H2O(見圖9),其片狀結構易產生包裹液相攜帶效應而使鉀收率降低;而此時脫鈣率下降,可能是因為此時溫度較高,CaSO4·2H2O溶解度相對較大,液相鈣離子濃度增加,從而使脫鈣率降低。兼顧α-CaSO4·0.5H2O晶體形貌,CaO含量選5.0%為宜。

圖11 不同反應條件下的鉀收率及脫鈣率Fig.11 Yields of potassium and decalcification rates under different reaction conditions
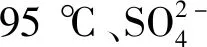
2.3 樣品力學性能測定和磷酸二氫鉀XRD分析
在適宜反應條件下批量制備α-CaSO4·0.5H2O樣品,研磨過120目篩(125 μm),`按《α型高強石膏》(JC/T 2038—2010)[16]測定力學性能;濾液經蒸濃、甲醇沉淀后的產品進行XRD分析,結果分別如表1及圖12所示。
從表1可以看出,α-CaSO4·0.5H2O的抗折強度和抗壓強度分別為5.61 MPa和33.74 MPa,達到《α型高強石膏》行業標準中的α30等級。圖12表明濾液經蒸濃、甲醇沉淀后主要物質為磷酸二氫鉀,經測定其含量在80%以上。
3 結 論
(1)通過控制反應條件,可對Ca(H2PO4)2-H3PO4-K2SO4體系中石膏的晶型和形貌進行調控,得到高強度短柱狀α-CaSO4·0.5H2O。

