肝移植術后撤除免疫抑制劑的回顧性分析
戚德彬, 陳 鵬, 佟 輝, 彭承宏, 李 濤
(上海交通大學醫學院附屬瑞金醫院外科 肝移植中心,上海 200025)
肝移植病人術后需長期規律服用免疫抑制劑,以防止排斥反應的發生。但免疫抑制劑所帶來的短期及長期不良反應,如心血管疾病、感染、代謝紊亂、腎功能損害、惡性腫瘤等[1],嚴重影響病人的長期生存。多中心研究表明,長期生存肝移植病人中有超過40%的成人和60%的兒童可達到免疫耐受而完全撤除免疫抑制劑的應用[2-3]。但如何識別達到免疫耐受的肝移植病人,尚缺乏公認的有效生物標志物。在肝移植病人術后隨訪工作中,因擔心完全撤藥可能會讓病人暴露于嚴重排斥反應的風險,臨床醫師通常不會主動要求病人完全撤藥。除個別病人主動要求外,完全撤藥的病人多因出現嚴重并發癥而被動撤藥。本文回顧性分析本中心撤除免疫抑制劑的15例肝移植病人臨床資料,現報道如下。
資料與方法
一、一般資料和圍術期免疫抑制方案
回顧性分析本中心在2013年1月至2020年6月期間被動或主動完全撤除免疫抑制劑的隨訪肝移植病人臨床資料。主動撤藥為病人要求撤藥。男13例,女2例,平均年齡(63.7±14.6)歲,肝移植術后平均時間(140.7±62.1)個月。9例原發病為乙肝后肝硬化失代償,2例為肝門膽管癌,2例為肝細胞癌合并肝硬化,1例為酒精性肝硬化失代償,1例為肝豆狀核變性(見表1)。
肝移植手術方式均為血型相容的經典原位肝移植。圍術期免疫抑制方案如下:術前4 h嗎替麥考酚酯(mycophenolate mofetil,MMF)1 g口服,術中應用甲潑尼龍500 mg,術后用他克莫司(FK506)+MMF+腎上腺皮質激素。其中,FK506總劑量按0.05~0.10 mg1(kg·d),濃度調整在 8~10 μg1L,MMF總劑量1.5 g1d,腎上腺皮質激素劑量遞減。6例肝移植病人術后d1與d4應用單劑巴利昔單抗(舒萊)。
二、術后免疫抑制維持方案
肝移植病人術后1年免疫抑制維持遵循個體化用藥方案。在監測肝功能正常的前提下,免疫抑制劑用量遞減。
三、術后免疫抑制完全撤除方案
對于主動撤藥的肝移植病人,詳細告知其完全撤藥的潛在風險,在隨訪醫師嚴格指導下逐漸撤藥。要求撤藥前1年內未發生臨床或組織病理學明確的急性排斥反應(acute rejection,AR),轉氨酶及總膽紅素完全正常,影像學檢查未發現血管及膽道并發癥。減藥間隔時間為3個月,直至完全撤除免疫抑制劑。對于被動撤藥的肝移植病人,根據不同病情,逐漸減量或直接停藥。
四、研究方法
將15例肝移植術后完全撤除免疫抑制劑的病人分為主動撤藥組與被動撤藥組,撤藥成功組與撤藥失敗組,比較組間差異。
五、隨訪和撤藥結果判定
對于撤藥的肝移植病人進行嚴密隨訪,撤藥后1個月內每周復查1次,1~3個月每2周復查1次,3個月后每個月復查1次,1年后每3個月復查1次。每次復查包括血常規、肝腎功能、血脂及腫瘤指標。每半年肝臟超聲復查。在隨訪過程中,有轉氨酶升高并經肝穿刺病理組織學活檢證實為急性排斥,復用免疫抑制劑者判定為撤藥失敗;有轉氨酶升高,但經病理組織學活檢排除急性排斥,未復用免疫抑制劑,經保肝治療后轉氨酶恢復正常者為撤藥成功。
六、統計學方法
采用SPSS 17.0統計學軟件進行分析。計量數據以均數±標準差(±s )表示,采用t檢驗。計數資料采用Fisher精確檢驗。P<0.05為差異有統計學意義。
結 果
15例肝移植病人中,11例因免疫抑制劑嚴重不良反應,包括骨髓抑制、腎功能損害、新發腫瘤以及腫瘤復發轉移等,而被動撤藥(見表1)。其中2例因發生AR而撤藥失敗,平均撤藥時間為(10.4±6.2)個月,撤藥成功率81.8%。主動撤藥的4例病人,平均撤藥時間為(28.8±30.3)個月,撤藥全部成功(100%),其中1例完全撤藥時間達74個月。末次隨訪移植物功能及病人結局見表2。
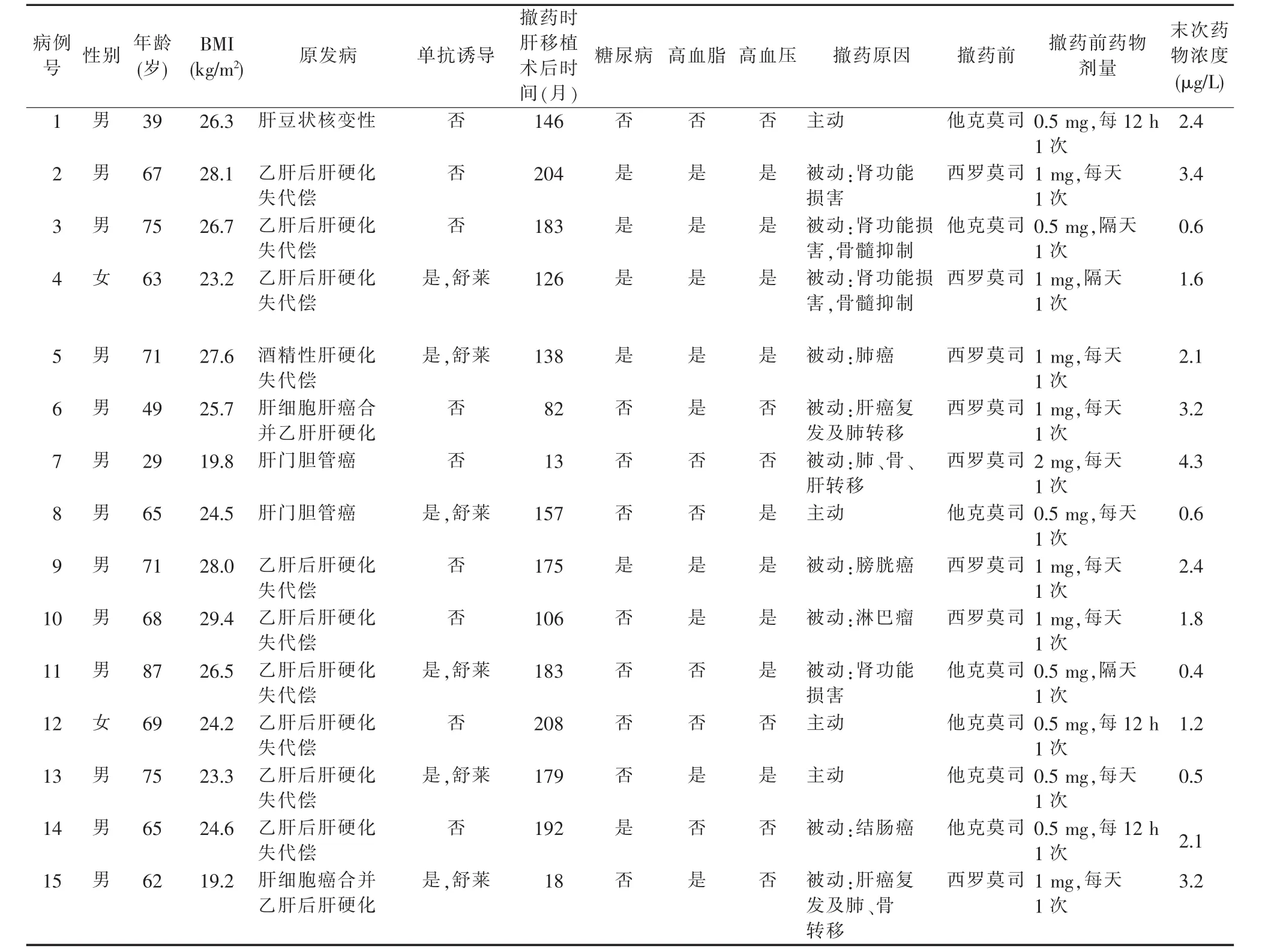
表1 一般臨床資料
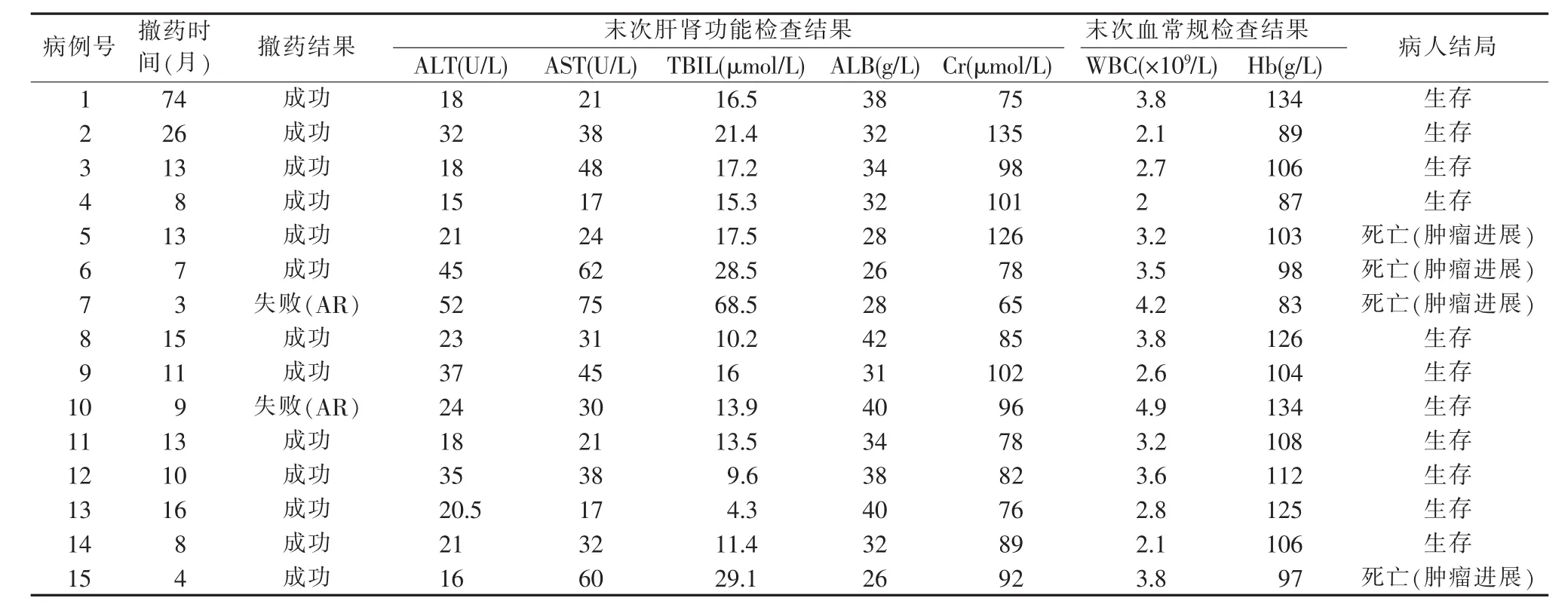
表2 隨訪病人結局
主動撤藥組與被動撤藥組在性別、年齡、體質量指數(body mass index,BMI)、使用單抗誘導、撤藥時肝移植術后時間、合并癥(糖尿病、高血脂、高血壓)、撤藥時間以及撤藥成功率的差異無統計學意義(P>0.05)(見表3)。撤藥成功組撤藥時肝移植術后時間明顯長于撤藥失敗組,兩組間差異具有統計學意義(P<0.05)(見表4)。

表3 主動撤藥組與被動撤藥組比較
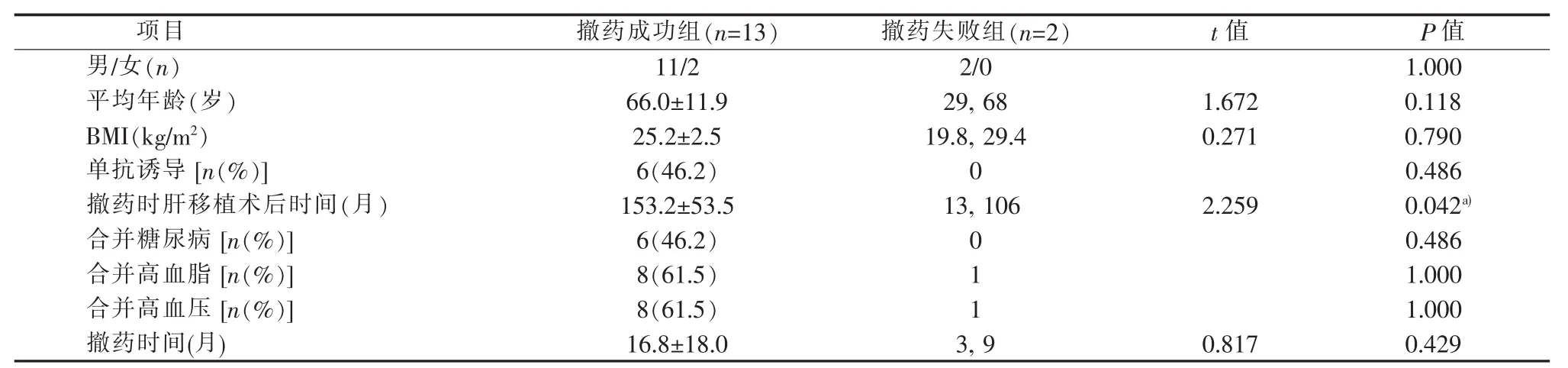
表4 撤藥成功組與撤藥失敗組比較
討 論
隨著外科技術的提高以及新型免疫抑制藥物的應用,肝移植已成為各種終末期肝病唯一可靠的治療方法。肝移植病人術后1、5和10年的生存率分別達到90%、80%和70%[4]。為防止排斥反應的發生,肝移植病人術后需長期應用免疫抑制劑。病人不僅承擔巨大的經濟負擔,還面臨長期應用免疫抑制劑帶來的短期及長期不良反應,如心血管疾病、感染、代謝紊亂、腎功能損害、惡性腫瘤等。雖然近年來免疫抑制方案不斷優化,但有研究報道,肝移植術后10年生存的病人中,77.6%出現高血壓,47.9%出現高脂血癥,42.9%出現中度以上腎功能受損[5]。肝移植術后10年內死亡的病人中,20%死于感染,18%死于新發腫瘤,14%死于心血管疾病[6]。
操作性免疫耐受 (operational tolerance,OT)是指在不使用免疫抑制劑的情況下,至少1年以上未發生移植物排斥反應,獲得移植器官長期存活的現象。肝移植術后OT形成的分子機制目前尚未完全明確,可能與微嵌合現象、Treg細胞、輔助性T細胞(helper T cell,Th)1與Th2細胞因子比例、自然殺傷細胞、未成熟樹突狀細胞及其來源的外泌體等有關[7-18]。其相關因子可能作為生物標志物預測OT的狀態。最近Jhun等[14]發現在逐漸減少肝移植病人免疫抑制劑用量的過程中,Treg與Th17的比值會發生改變。免疫耐受組病人Treg與Th17的比值明顯高于非免疫耐受組。Pérez-Sanz等[15]的前瞻性研究證實,SENP6與FEM1C表達對肝移植病人的OT狀態有很強的預測作用。但迄今為止,尚未發現能精準預測肝移植病人術后OT狀態的生物標志物。因此,目前臨床上仍是在監測移植物功能的基礎上通過逐漸撤除免疫抑制劑的方法來誘導肝移植病人達到OT狀態。Shaked等[16]的多中心研究表明,肝移植術后撤除免疫抑制劑的病人中有67.5%成功減藥至標準藥量的一半以下,13.0%的病人達到OT狀態而完全撤藥。肝移植病人完全撤藥是否成功與病人年齡、原發病、肝移植類型、免疫抑制方案、肝移植術后時間等多種因素有關。Sánchez-Fueyo等[17]研究發現,肝移植術后10年以上的成人中有較高的比例達到OT。Trotter等[18]認為,對于那些肝移植術后5年以上,最近未發生AR或膽道并發癥等,免疫抑制劑血藥濃度穩定的肝移植病人可考慮緩慢撤藥。撤藥周期為6~12個月。撤藥期間應縮短隨訪間期。隨訪期間必須重視病人肝功能異常的處理,并及時行肝穿刺排除AR。de la Garza等[19]研究認為,撤藥隨訪過程中出現肝功能異常,但低于正常指標上限3倍的肝移植病人,應維持當前免疫抑制劑用量,于7~14 d后復查肝功能,肝功能正常的病人繼續撤藥。Assy等[20]的隨機對照試驗有75%的自身免疫性肝炎肝移植病人在完全撤藥后9~15周內出現疾病復發。確診后恢復潑尼松聯合硫唑嘌呤(100 mg1d)搶救治療,病人實驗室檢查指標于6周內緩解。因此,原發病為自身免疫性肝炎的肝移植病人術后完全撤除免疫抑制劑需謹慎[21]。
本研究主動撤藥肝移植病人采用筆者的撤藥方案均獲得成功,4例病人肝移植術后時間均超過12年,其中1例原發病為肝豆狀核變性的肝移植病人已成功完全撤藥74個月。但在被動撤藥組中有2例病人因發生AR導致撤藥失敗,其中1例撤藥在肝移植術后13個月。撤藥成功組撤藥時肝移植術后時間明顯長于撤藥失敗組,說明撤藥時肝移植術后時間是決定撤藥是否成功的重要因素之一。
總之,本研究有限的病例資料表明,有選擇地在遠期隨訪肝移植病人中進行完全撤藥是安全的。對于肝移植術后10年以上,無血管及膽道并發癥,在免疫抑制劑最小劑量維持下肝功能保持正常,依從性良好的肝移植病人可在隨訪醫師指導下逐漸撤除免疫抑制劑。對于原發病為自身免疫性肝病相關的肝移植病人,則不建議完全撤除免疫抑制劑。本研究病例較少,還需在今后隨訪過程中積累更多完全撤藥的肝移植病例,以進一步觀察肝移植病人免疫耐受形成的臨床特征,并監測其免疫耐受相關因子,以尋找可靠的生物標志物。

