蝦頭類肝素的制備、理化性質(zhì)及抗凝血活性評價
陳 菁,杜振興,陳建平,賈學(xué)靜,劉曉菲,李 瑞,鐘賽意,3,
(1.廣東海洋大學(xué)食品科技學(xué)院,廣東省水產(chǎn)品加工與安全重點實驗室,廣東省海洋生物制品工程實驗室,廣東省海洋食品工程技術(shù)研究中心,廣東 湛江 524088;2.廣東海洋大學(xué)深圳研究院,廣東 深圳 518108;3.大連工業(yè)大學(xué) 海洋食品精深加工關(guān)鍵技術(shù)省部共建協(xié)同創(chuàng)新中心,遼寧 大連 116034)
天然類肝素是存在于生物體中類似于肝素結(jié)構(gòu)的一類物質(zhì),如硫酸乙酰肝素、硫酸皮膚素、硫酸軟骨素等[1],具有抗凝血、抗血栓等活性。類肝素的抗凝血活性較肝素低,抗凝血作用更為緩和,長期使用類肝素不會出現(xiàn)高抗凝活性引起的副作用,避免了因抗凝血作用可能造成的不良反應(yīng)[2]。此外,類肝素能與多種蛋白質(zhì)相結(jié)合,對細胞的增殖、分化、結(jié)合起一定調(diào)控作用,并能參與外來細胞的識別和控制過程[3]。因此,類肝素的使用安全性較高,有關(guān)類肝素物質(zhì)的研究受到越來越多研究者的關(guān)注。
凡納濱對蝦養(yǎng)殖產(chǎn)量約占我國對蝦養(yǎng)殖產(chǎn)量的85%,2018年海水養(yǎng)殖凡納濱對蝦總產(chǎn)量約為112萬 t[4-5],在蝦的生產(chǎn)和消費過程中產(chǎn)生的大量蝦頭(包括肝胰腺、生殖腺和消化器官,約占整蝦的36%)、蝦殼等加工副產(chǎn)物大多被低值化利用或被直接廢棄。我國對這些加工副產(chǎn)物的高值化利用主要集中在調(diào)味品制造[6]、甲殼素和蝦青素的提取,以及殼聚糖的制備等[7]。近年來,人們通過對殼聚糖進行硫酸化修飾,以期獲得硫酸化糖胺聚糖的結(jié)構(gòu)并具有抗凝作用等其他生物活性[8]。國內(nèi)對直接從蝦頭中分離類肝素并研究其活性鮮有報道。
本課題組前期探究發(fā)現(xiàn)凡納濱對蝦的蝦頭中存在肝素類物質(zhì)[9]。國外有研究從凡納濱對蝦頭中分離出肝素類糖胺聚糖,并發(fā)現(xiàn)其具有較強的抗血管生成和抗炎活性,但抗凝血活性和出血副作用不明顯[10-11]。本研究以蝦頭為原料制備類肝素物質(zhì),進行理化性質(zhì)分析和結(jié)構(gòu)表征,并考察其抗凝血活性,為凡納濱對蝦加工副產(chǎn)物的高值化利用(提供類肝素產(chǎn)品)開發(fā)的新途徑。
1 材料與方法
1.1 材料與試劑
凡納濱對蝦(Litopenaeus vannamei)蝦頭購自廣東省湛江市水產(chǎn)品批發(fā)市場大捷水產(chǎn)店。
2709堿性蛋白酶(1.2×105U/g) 南寧龐博生物工程有限公司;FPA98Cl型離子交換樹脂、無水硫酸鈉 上海麥克林生化科技有限公司;肝素標(biāo)準(zhǔn)品(190 IU/mg) 中國食品藥品檢定研究所;Lowry蛋白定量試劑盒 福州飛凈生物科技有限公司;血漿活化部分凝血活酶時間(activated partial thromboplastin time,APTT)試劑盒、凝血酶原時間(prothrombin time,PT)試劑盒、血漿凝血酶時間(thrombin time,TT)試劑盒武漢中太生物技術(shù)有限公司;兔血漿、咔唑、甘露糖(mannose,Man)、鼠李糖(rhamnose,Rha)、D-無水葡萄糖(glucose,D-Glc)、D-葡萄糖醛酸(D-gluconic acid,D-GlcA)、乙酸纖維素薄膜 上海源葉生物科技有限公司;1-苯基-3-甲基-5-吡唑啉酮(3-methyl-1-phenyl-2-pyrazolin-5-one,PMP)、艾杜糖醛酸(iduronic acid,IdoA)、N-乙酰半乳糖胺(N-acetylgalactosamine,GalNAc)、阿利新藍8GX染色劑、氨基己糖 美國Sigma-Aldrich公司;甲醇、乙腈(均為色譜純) 美國賽默飛世爾科技公司;無水乙醇、氯化鈉等其他試劑均為分析純。
1.2 儀器與設(shè)備
數(shù)顯恒溫水浴鍋HH-8 常州國華電器有限公司;Sorvall Lynx6000高速落地離心機 美國賽默飛世爾科技公司;N-4000旋轉(zhuǎn)蒸發(fā)儀 東京理化器械株式會社;FD8508型真空冷凍干燥機 韓國ilShin公司;TU-1901雙光束紫外-可見分光光度計 北京普析通用儀器有限責(zé)任公司;BRUKER TENSOR-27傅里葉變換紅外光譜(Fourier transform infrared spectroscopy,F(xiàn)TIR)儀德國Bruker公司;1200高效液相色譜(high performance liquid chromatography,HPLC)儀、ZORBAX EclipseXDB-C18色譜柱(4.6 mm×250 mm,5 μm)美國安捷倫公司;UltrahydrogelTM500色譜柱(7.8 mm×300 mm,10 μm) 美國Waters公司;XN06半自動凝血分析儀 武漢景川診斷技術(shù)股份有限公司。
1.3 方法
1.3.1 蝦頭類肝素的提取分離
參考文獻[12],將蝦頭干燥并粉碎,按料液比1∶10(m/V)加入蒸餾水,加入5.4 mg/mL(終質(zhì)量濃度,下同)堿性蛋白酶、6 mg/mL氯化鈉,于55 ℃水浴酶解20 h;酶解液經(jīng)沸水浴滅酶10 min后冷卻離心(8 000 r/min,20 min),離心后取上清液,采用FPA98Cl陰離子交換樹脂進行動態(tài)吸附,層析柱規(guī)格26 mm×100 cm。樹脂活化方法:用蒸餾水清洗后用4 倍體積的4 g/100 mL氫氧化鈉溶液浸泡4 h,浸泡過程中不斷攪拌,用蒸餾水洗至pH 9,濾干后,再用體積分數(shù)4%鹽酸溶液浸泡4 h,蒸餾水洗至pH 6。分離4 L上清液大約需要活化500 g樹脂。依次以0.5、1.1、1.5 mol/L的NaCl溶液進行梯度洗脫(圖1),分別得到洗脫組分F0.1、F1.1、F1.5,每管均收集8 mL洗脫液,用阿利新藍法分析其類肝素含量,以洗脫管數(shù)為橫坐標(biāo),所測得490 nm波長處的吸光度為縱坐標(biāo)繪制梯度洗脫曲線;合并含有類肝素的洗脫液,緩慢加入1 倍體積的無水乙醇,靜置12 h后離心(4 000 r/min,10 min),收集沉淀,沉淀用無水乙醇洗滌2 次;經(jīng)3 kDa透析袋脫鹽,以雙蒸水為透析溶液,每2 h換一次透析液。透析后,真空冷凍干燥得到純化物蝦頭類肝素,并進行下一步分析。記錄3 種蝦頭類肝素提取物的干粉質(zhì)量m1/mg和蝦頭干粉的質(zhì)量m2/kg,按照下式計算類肝素得率。

1.3.2 蝦頭類肝素的理化性質(zhì)
類肝素質(zhì)量分數(shù)采用阿利新藍法[13],以肝素為標(biāo)準(zhǔn)品;GlcA質(zhì)量分數(shù)的測定采用改良的硫酸-咔唑法[14],以D-GlcA為標(biāo)準(zhǔn)品;蛋白質(zhì)量分數(shù)采用Folin-酚法測定,以牛血清白蛋白為蛋白標(biāo)準(zhǔn)品;氨基己糖質(zhì)量分數(shù)參照文獻[15]測定;硫酸基質(zhì)量分數(shù)測定采用BaCl2-gel比濁法[13],以硫酸鉀為標(biāo)準(zhǔn)品;效價采用天青A比色法測定[16],以肝素為標(biāo)準(zhǔn)品。
1.3.3 蝦頭類肝素的乙酸纖維素薄膜電泳分析
將純化后的類肝素組分F1.1和F1.5、硫酸皮膚素(dermatan sulfate,DS)、硫酸軟骨素(chondroitin sulfate,CS)、硫酸軟骨素C型(chondroitin sulfate C,CS-C)、肝素標(biāo)準(zhǔn)品,分別配制成質(zhì)量濃度5 mg/mL水溶液,參考文獻[17]進行乙酸纖維素薄膜電泳分析。
1.3.4 蝦頭類肝素的紫外波長掃描
將純化的類肝素組分以蒸餾水配成1 mg/mL的溶液,以蒸餾水為參比,采用紫外-可見分光光度計測定樣品在波長190~400 nm范圍內(nèi)的紫外吸收光譜。
1.3.5 蝦頭類肝素的相對分子質(zhì)量測定
采用高效凝膠滲透色譜(high performance gel permeation chromatography,HPGPC)法測定樣品分子質(zhì)量。色譜條件為:UltrahydrogelTM500色譜柱(7.8 mm×300 mm,10 μm)、流動相0.2 mol/L NaSO4溶液、流速0.3 mL/min、柱溫35 ℃、進樣量10 μL、Agilent 1200示差折光檢測器。
肝素標(biāo)準(zhǔn)品(平均分子質(zhì)量分別為3.55、5.2、7.4、15、30 kDa)和蝦頭類肝素樣品分別用0.2 mol/L硫酸鈉溶液配制成質(zhì)量濃度為5 mg/mL的溶液,經(jīng)0.22 μm的針式濾膜過濾后進樣。記錄標(biāo)準(zhǔn)品和樣品的保留時間并進行數(shù)據(jù)處理。
1.3.6 蝦頭類肝素的FTIR分析
取2 mg樣品與200 mg溴化鉀混勻,充分研磨后壓制成半透明薄片,利用FTIR儀進行掃描,掃描波數(shù)范圍為4 000~400 cm-1。
1.3.7 蝦頭類肝素的單糖組成分析
稱取蝦頭類肝素2 mg于棕色玻璃樣品瓶中,加入1 mL 2 mol/L三氟乙酸溶液,于110 ℃烘箱水解4 h,得樣品水解液。
單糖標(biāo)準(zhǔn)品和樣品水解液經(jīng)1-苯基-3-甲基-5-吡唑啉酮(1-phenyl-3-methyl-5-pyrazolinone,PMP)-柱前衍生HPLC法進行單糖組成分析[18]。色譜條件:ZORBAX EclipseXDB-C18色譜柱(4.6 mm×250 mm,5 μm);流動相:體積分數(shù)85%的0.02 mol/L pH 6.74磷酸鹽緩沖液-體積分數(shù)15%乙腈溶液;柱溫:30 ℃;流速:1 mL/min;檢測波長:245 nm;紫外檢測器;進樣量:10 μL。
1.3.8 蝦頭類肝素的體外抗凝血活性評價
以生理鹽水為陰性對照,肝素標(biāo)準(zhǔn)品為陽性對照,采用試劑盒法測定血漿APTT、PT、TT實驗所用血漿為新鮮兔血漿。
APTT是在37 ℃下以激活劑激活因子Ⅻ和Ⅺ,以部分凝血活酶腦磷脂懸液代替血小板提供凝血的催化表面,在Ca2+參與下觀察血漿凝固所需要的時間。具體測定方法:取待測血漿50 μL,加入50 μL不同質(zhì)量濃度的標(biāo)準(zhǔn)品和待測樣品溶液,再加入APTT試劑50 μL,混勻,37 ℃下溫育3 min,然后快速加入50 μL 0.025 mol/L氯化鈣溶液,加入的同時立即混勻啟動計時,記錄血液凝固的時間,即為APTT。
PT是指在待測血漿中加入過量的組織凝血活酶浸出液和Ca2+,使凝血酶原轉(zhuǎn)變?yōu)槟福甘估w維蛋白原轉(zhuǎn)變?yōu)槔w維蛋白,導(dǎo)致血漿凝固所需要的時間。具體測定方法:取待測血漿50 μL,加入50 μL不同質(zhì)量濃度的標(biāo)準(zhǔn)品和待測樣品溶液,37 ℃下溫育3 min,加入100 μL的PT試劑,加入的同時立即混勻啟動計時,記錄血液凝固的時間,即為PT。
TT是指在待測血漿中加入“標(biāo)準(zhǔn)化”的凝血酶溶液后,纖維蛋白原轉(zhuǎn)變?yōu)槔w維蛋白,導(dǎo)致血漿凝固所需要的時間。具體測定方法:取待測血漿100 μL,加入100 μL不同質(zhì)量濃度的標(biāo)準(zhǔn)品和待測樣品溶液,37 ℃下溫育3 min,加入100 μL TT試劑,加入的同時立即混勻啟動計時,記錄血液凝固的時間,即為TT。
1.4 數(shù)據(jù)處理與分析
采用Excel 2010軟件處理數(shù)據(jù),結(jié)果以3 組平行的平均值±標(biāo)準(zhǔn)差表示,采用Origin 2017軟件作圖。
2 結(jié)果與分析
2.1 蝦頭類肝素的分離純化結(jié)果及理化性質(zhì)
類肝素在組織中通常以糖蛋白形式存在,通常采用降解蛋白質(zhì)的手段使與之結(jié)合的類肝素得以釋放[19]。通過強堿性FPA98Cl型離子交換樹脂進行選擇性動態(tài)吸附,分離部分雜蛋白及核酸;再以濃度遞增的NaCl溶液分級洗脫(圖1),再以醇沉除去混雜的酸性蛋白,經(jīng)透析除鹽、冷凍干燥獲得3 個組分,分別是F0.5、F1.1、F1.5,所得組分均呈黃白色蓬松狀,易溶于水。

圖1 蝦頭類肝素FPA98Cl型陰離子交換柱洗脫曲線Fig.1 Elution curve of heparinoid in shrimp heads on FPA98Cl anion exchange column
由表1可知,組分F0.5、F1.1、F1.5的得率分別是213.53、347.00、91.67 mg/kg,F(xiàn)1.1的得率最高,而Dietrich等[20]報道了蝦頭可作為制備低分子肝素的原料,其得率為32 mg/kg;Cahú等[21]從南美白對蝦加工廢棄物中提取的糖胺聚糖得率為79 mg/kg。組分F0.5、F1.1和F1.5的類肝素質(zhì)量分數(shù)呈遞增趨勢,其中,F(xiàn)1.1和F1.5的類肝素質(zhì)量分數(shù)達80%以上,明顯高于F0.5(48.80%);蛋白質(zhì)量分數(shù)均在1%以下;F1.5的硫酸基質(zhì)量分數(shù)最高(12.05%),F(xiàn)1.1次之(9.39%),F(xiàn)0.5組分最低(0.45%)。有研究表明硫酸基的存在對糖復(fù)合物的理化性質(zhì)及生物活性具有重要的影響,發(fā)現(xiàn)肝素和硫酸軟骨素的抗凝血活性與硫酸基的位置和連接方式有著密切的關(guān)系,硫酸化程度高的肝素的抗凝血活性比較強[22]。效價測定結(jié)果顯示,F(xiàn)1.5的效價最高,為118.29 IU/mg,其次為F1.1(109.72 IU/mg),F(xiàn)0.5的效價最低(18.90 IU/mg)。Medeiros等[23]以蛋白酶酶解、IRA-900陰離子交換樹脂吸附,再以丙酮分級的方法從招潮蟹(Ucides cordatus)提取類肝素化合物,肝素相對含量為45%,其效價為52 IU/mg。Dietrich等[20]從巴西對蝦中提取出一種天然低分子肝素,其效價為95 IU/mg,具有良好的抗凝血和抗血栓作用。
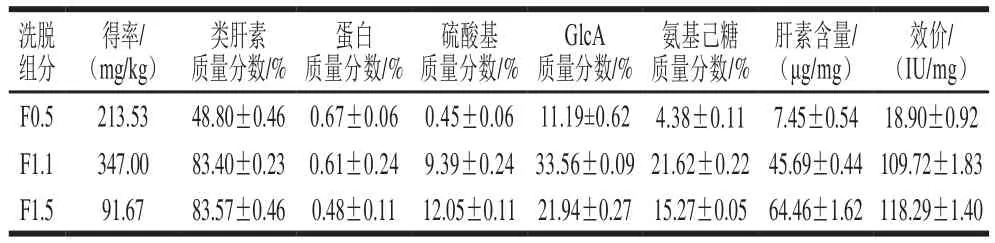
表1 各洗脫組分的得率及理化性質(zhì)Table 1 Yields and physicochemical properties of eluate components
2.2 蝦頭類肝素的醋酸纖維薄膜電泳結(jié)果
糖胺聚糖為多聚陰離子,不同種類的糖胺聚糖所帶電荷密度的不同,電泳遷移率不同,可以此鑒別其種類[13]。洗脫組分F0.5的糖胺聚糖含量較低,電泳遷移率最低,條帶散亂,故未進行電泳分析。如圖2所示,DS、CS-C、肝素相對遷移率依次增加,與王皓等[17]的結(jié)果一致。洗脫組分F1.1和F1.5的乙酸纖維素薄膜電泳結(jié)果均為單一條帶,F(xiàn)1.5的遷移率最大,與肝素遷移率相近;其次是F1.1,與CS的遷移率較為一致,表明組分F1.5主要含有肝素,組分F1.1主要含有CS和少量DS。
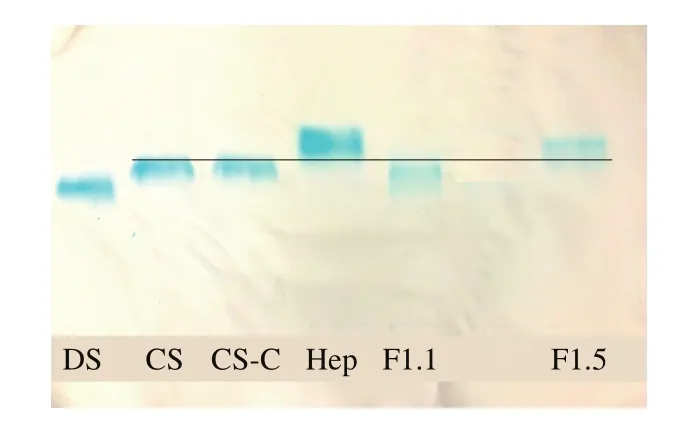
圖2 分離組分乙酸纖維素薄膜電泳結(jié)果Fig.2 Electrophoresis of the separated components on cellulose acetate
2.3 蝦頭類肝素的純度及分子質(zhì)量測定結(jié)果
2.3.1 紫外波長掃描結(jié)果
洗脫組分F0.5、F1.1、F1.5的紫外光譜掃描結(jié)果如圖3所示,3 個組分僅在190~200 nm波長處有糖基末端的吸收峰,與報道中肝素在180~220 nm波長處有特征吸收峰[19]、CS在180~200 nm波長處有特征吸收峰[19]的結(jié)果一致,說明3 個洗脫組分的紫外吸收與肝素、CS的特征吸收峰相近,而在260 nm未見明顯的核酸吸收峰,在280 nm處也未見蛋白質(zhì)吸收峰,在其他紫外區(qū)域也無明顯吸收峰,結(jié)合前節(jié)理化性質(zhì)中蛋白質(zhì)量分數(shù)均小于1%,表明F0.5、F1.1、F1.5的純度較高。

圖3 分離組分紫外光譜掃描結(jié)果Fig.3 UV spectra of the components
2.3.2 分子質(zhì)量測定結(jié)果
如圖4所示,F(xiàn)0.5、F1.1、F1.5均為單一色譜峰,基本無雜峰,說明純度較高。其中F1.1的峰形較為狹窄且對稱,分子質(zhì)量分布相對均一。HPGPC法測得肝素標(biāo)準(zhǔn)品分子質(zhì)量的對數(shù)(y)與保留時間(x)的線性方程為:y=-0.184 2x+9.971 1(R2=0.997 3),計算出F0.5、F1.1、F1.5的分子質(zhì)量分別為12.5、7.8、19.8 kDa。Cavalcante等[24]以凡納濱對蝦頭為原料制備了多硫酸化的CS,采用HPGPC法測得其平均分子質(zhì)量為26 kDa;與之相比,F(xiàn)1.1的分子質(zhì)量較小,不同方法獲得的CS分子質(zhì)量也不盡相同。Brito等[25]從凡納濱對蝦頭中提取了肝素/硫酸肝素類化合物,測得其平均分子質(zhì)量為15 kDa,具有顯著的抗凝血活性和低的出血副作用,相比之下F1.5的分子質(zhì)量稍大。
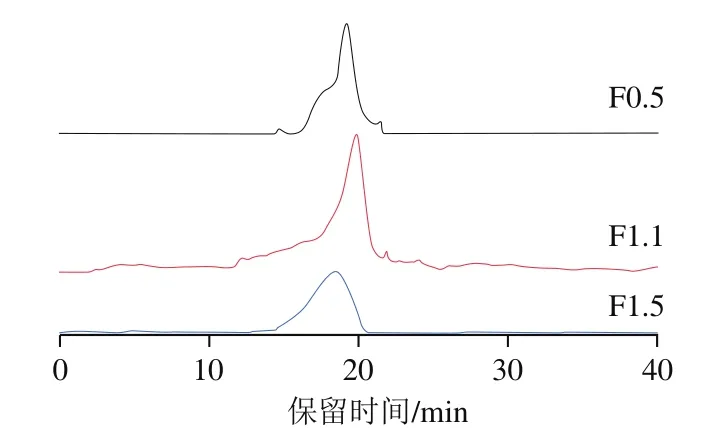
圖4 分離組分的HPGPC圖譜Fig.4 HPGPC of the components
2.4 蝦頭類肝素的FTIR光譜分析
分離組分在400~4 000 cm-1波數(shù)范圍內(nèi)進行FTIR掃描的結(jié)果見圖5,官能團分析見表2。組分F0.5、F1.1、F1.5的FTIR譜圖大致相似,在3 421 cm-1附近是多糖分子間氫鍵O―H伸縮振動峰,證明羥基的存在;2 935 cm-1處為C―H伸縮振動峰,是糖類物質(zhì)的特征吸收峰;在1 652 cm-1、1 551 cm-1附近為N-乙酰基的吸收峰[26];在1 415 cm-1附近的吸收峰證明有羧基存在;3 個組分在1 240 cm-1處均有吸收峰,F(xiàn)1.1在850 cm-1處、F1.5在820 cm-1處有吸收峰,說明這3 個組分中均存在硫酸基團[26];對比圖譜,F(xiàn)0.5在1 240 cm-1處的吸收峰較弱,且在820、850 cm-1處沒有吸收,說明組分F0.5結(jié)構(gòu)中的硫酸基含量低,與硫酸基質(zhì)量分數(shù)測定結(jié)果一致。綜上,組分F0.5、F1.1、F1.5均含有羧基、羥基、硫酸基、乙酰氨基,F(xiàn)1.1和F1.5為吡喃糖構(gòu)型。

圖5 分離組分的FTIR圖Fig.5 Fourier transform infrared spectra of the components

表2 各洗脫組分的FTIR圖譜分析Table 2 Fourier transform infrared spectral analysis of the eluate components
F1.1在850 cm、931cm-1處有CS在1 000~700 cm-1指紋區(qū)的特征吸收峰[19],F(xiàn)1.5 在932 cm-1處具備肝素在890~940 cm-1的特征吸收峰[19],表明F1.1和F1.5具有CS和肝素的結(jié)構(gòu)。
2.5 蝦頭類肝素的單糖組成分析
采用PMP衍生法,以Man、Rha、氨基葡萄糖(glucosamine sulfate,GlcN)、GlcA、IdoA、Glc、GalNAc、半乳糖(galactose,Gal)、巖藻糖(fucose,F(xiàn)uc)為標(biāo)準(zhǔn)品,對F0.5、F1.1、F1.5進行單糖組成分析,對色譜圖(圖6)進行分析,得到3 個組分中不同單糖的物質(zhì)的量分數(shù)(表3)。F0.5主要由Man(19.86%)、GlcA(12.72%)、Glc(38.20%)和GalNAc(18.42%)組成;F1.1主要含有Rha(14.74%)、GlcA(23.59%)、IdoA(11.93%)、GalNAc(12.20%)和Gal(21.23%),此外還有少量Man、Fuc;F1.5主要由GlcA(17.61%)、IdoA(6.47%)、GalNAc(16.53%)、Gal(28.04%)和Fuc(16.68%)組成。F0.5、F1.1和F1.5的單糖組成種類和比例有所差異。
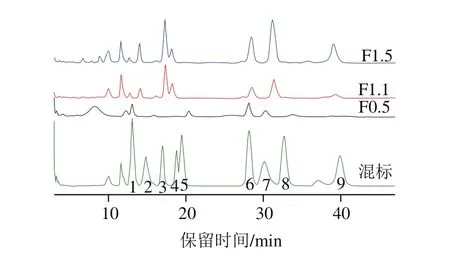
圖6 分離組分的單糖組成HPLC圖Fig.6 HPLC profile showing the monosaccharide composition of the components
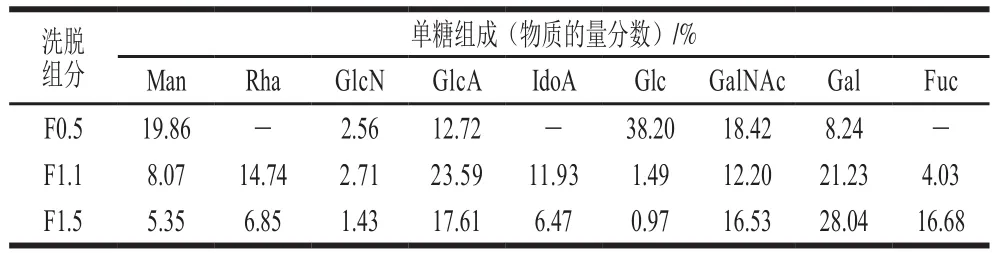
表3 分離組分的單糖組成分析Table 3 Monosaccharide composition of the components
2.6 蝦頭類肝素體外抗凝血活性
本實驗以肝素作為陽性對照,通過測定APTT、PT、TT來評價蝦頭類肝素F0.5、F1.1、F1.5 3 個組分的體外抗凝血活性,三者分別反映內(nèi)源性凝血途徑、外源性凝血途徑和共同凝血途徑。如圖7所示,F(xiàn)0.5沒有明顯的抗凝血活性,在實驗質(zhì)量濃度范圍內(nèi),F(xiàn)1.1和F1.5的抗凝血活性呈現(xiàn)出劑量依賴關(guān)系,APTT、TT明顯比F0.5長,說明F1.1和F1.5均能通過內(nèi)源性凝血途徑和共同凝血途徑發(fā)揮抗凝血活性。但與肝素對照品相比,要達到相同的抗凝血作用需要更高的質(zhì)量濃度,表明F1.1和F1.5的抗凝活性弱于肝素,較為緩和。Cássaro等[27]報道,與肝素相比,抗凝血活性低的多糖表現(xiàn)出更好的抗血栓形成作用,出血風(fēng)險也更低。通過APTT和TT的結(jié)果來看,推測F1.5的抗凝血活性比F1.1強,這與前節(jié)硫酸基質(zhì)量分數(shù)和效價測定結(jié)果一致。此外,推測F1.1和F1.5的抗凝血活性與其分子質(zhì)量有關(guān),有學(xué)者研究不同分子質(zhì)量仿刺參糖胺聚糖的活性時發(fā)現(xiàn)其抗凝血、抗血栓活性會隨著分子質(zhì)量的增大而增強[28],李娜[29]對叉枝松藻多糖抗凝血的研究結(jié)果也表明多糖的抗凝血活性隨著分子質(zhì)量的減小而降低。與F0.5相比,F(xiàn)1.1和F1.5對PT均無明顯延長作用,說明F1.1和F1.5對外源凝血系統(tǒng)無明顯作用。因此,可以確定F1.1和F1.5主要基于抑制凝血酶活性和抑制纖維蛋白原向纖維蛋白的轉(zhuǎn)化,通過內(nèi)源凝血途徑和共同凝血途徑發(fā)揮抗凝作用[30]。

圖7 蝦頭類肝素的抗凝血活性APTT(A)、TT(B)和PT(C)分析Fig.7 APTT (A), TT (B) and PT (C) analysis for anticoagulant activity of heparinoid in shrimp heads
3 結(jié) 論
酶解制備的凡納濱對蝦頭類肝素化合物經(jīng)純化得到3 個組分(F0.5、F1.1、F1.5),F(xiàn)0.5的類肝素質(zhì)量分數(shù)較低且無抗凝血活性;F1.1和F1.5的類肝素質(zhì)量分數(shù)達83%,分子質(zhì)量分別為7.8、19.8 kDa;F1.1的電泳遷移速率與CS相近,F(xiàn)1.5接近肝素標(biāo)準(zhǔn)品的遷移速率;F1.1和F1.5均具有羧基、乙酰氨基、硫酸基團等吸收峰;3 個組分中的單糖組成為比例不同的GlcA、IdoA、GalNAc、Gal和Fuc;F1.1和F1.5組分與肝素相比,其抗凝血活性較為溫和,F(xiàn)1.5的抗凝血活性強于F1.1,可以作為潛在的抗凝血治療劑。

