糖尿病腎病維持性血液透析患者血清骨保護素、骨硬化蛋白的表達及與骨質疏松的關系
王丹 劉曉燕 張浩東
慢性腎臟病(CKD)及其引起的終末期腎病的發病率近年來在全球范圍內呈持續增長趨勢,是嚴重危害人類健康的公共衛生問題[1,2]。對于維持性血液透析患者,骨質疏松是慢性腎臟病礦物質骨異常的一個常見臨床類型[3],是造成維持性血液透析患者骨折高發的重要原因,影響血液透析患者的生存質量。糖尿病腎病作為引起維持性血液透析患者的首要病因,由于高糖導致鈣、磷排出增多、骨膠原蛋白發生糖基化反應引起骨脆性增加、并發血管神經病變導致骨質營養供應不足等原因[4],骨質疏松問題尤為嚴重[5]。血清骨保護素(OPG)作為腫瘤壞死因子受體的超家族成員,是核因子受體活化因子和腫瘤壞死因子相關凋亡誘導配體的受體,主要由骨骼和血管組織產生,是骨轉化重要的調節因子[6]。骨硬化蛋白(SOST)又稱硬骨素,是參與骨形成負調控的分泌型糖蛋白,特異性地表達于骨細胞中,通過作用于成骨細胞而在骨代謝中起重要作用[7]。目前骨質疏松的診斷主要依靠影像學檢查,尋找協助骨質疏松診斷的血清學指標對于協助臨床診斷具有重要的臨床意義。因此,本研究擬探討OPG和SOST在糖尿病腎病維持性血液透析患者中的表達及其與骨質疏松的關系。
1 資料與方法
1.1 一般資料 本研究選取2016年1月至2019年3月內蒙古自治區人民醫院和烏海市人民醫院血液凈化中心維持性血液透析患者作為研究對象。所有維持性血液透析患者進行骨密度檢查。本研究經醫院醫學倫理委員會批準,所有研究對象自愿參加并簽署知情同意書。根據入選標準和排除標準,研究共納入糖尿病腎病維持性血液透析患者136例為糖尿病腎病組進行分析,為研究糖尿病腎病維持性血液透析患者的臨床基線資料,本研究納入同期198例維持性血液透析的非糖尿病腎病患者作為對照組。
1.2 納入與排除標準
1.2.1 納入標準:①年齡≥18歲,男女不限;②根據美國腎臟基金會腎臟病預后質量倡議指南標準[8]臨床診斷糖尿病腎病:在大部分糖尿病患者中,出現以下任何一條者考慮其腎臟損傷是糖尿病引起的:A大量白蛋白尿;B糖尿病視網膜病變伴微量白蛋白尿;C在10年以上糖尿病病程的1型糖尿病患者中出現微量白蛋白尿;③透析齡>6個月;④每周透析3次,每次透析至少3 h。
1.2.2 排除標準:①患者近3個月出現急性感染或者急性心腦血管疾病;②存在自身免疫性疾病或惡性腫瘤;③長期使用激素或免疫抑制劑;④近6個月有股骨頸骨折病史。
1.3 樣本采集與檢測 收集所有血液透析患者透析前晨起靜脈血5 ml,經高速離心機3 000 r(有效離心半徑為8 cm)離心10 min后貯存于EP管,于-80℃冰箱保存。血清OPG和SOST測定采用酶聯免疫復合物法,OPG檢測試劑盒購自美國R&D公司,SOST檢測試劑盒購自上海藍基生物科技有限公司,檢測方法按照試劑盒操作步驟進行檢測。收集患者的基線資料,包括年齡、性別比、透析齡、血清鈣(Ca)、血清磷(P)、甲狀旁腺激素(iPTH)、25-羥維生素D3(25-(OH)-VitD3)、骨密度、血紅蛋白(Hb)、血清白蛋白(ALB)。Ca、P及iPTH采用羅氏診斷產品(上海)有限公司試劑盒進行檢測,25-(OH)-VitD3上海亞培生物科技有限公司生產的ELISA檢測試劑盒進行檢測,Hb和ALB采用美國貝克曼公司型號為BECKMANCOULTER的LX20儀器檢測。
1.4 骨密度檢查 骨密度檢測采用美國Norland公司的XR-36型雙能X線骨密度儀,對患者行股骨頸的骨密度測定。根據中國原發性骨質疏松癥診治指南診斷標準[9]診斷骨質狀態:T值-1.0 ~ +2.5 s為骨量正常,-1.0 ~ -2.5 s為骨量減少,<-2.5 s為骨質疏松。
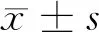
2 結果
2.1 一般資料 納入研究的136例糖尿病腎病維持性血液透析患者中,診斷骨質疏松的患者有64例,未診斷骨質疏松的患者有72例。與198例非糖尿病腎病的維持性血液透析患者比較,糖尿病腎病維持性血液透析患者iPTH、血清OPG和SOST水平較高,骨質疏松發生比例較高,骨密度較低,差異有統計學意義(P<0.05)。見表1。

表1 糖尿病腎病與非糖尿病腎病維持性血液透析患者臨床基線資料比較
2.2 不同骨質狀態的糖尿病腎病維持性血液透析患者血清OPG、SOST水平 在糖尿病腎病維持性血液透析患者中,分析不同骨質狀態患者血清OPG、SOST水平的差異。骨質疏松的患者血清OPG、SOST水平均高于骨量減少和骨質正常的患者,差異有統計學意義(P<0.05),骨量減少的糖尿病腎病維持性血液透析患者血清OPG、SOST水平高于骨量正常的患者,差異有統計學意義(P<0.05)。見表2。

表2 不同骨質狀態的糖尿病腎病維持性血液透析患者血清OPG、SOST水平
2.3 糖尿病腎病維持性血液透析患者骨質疏松危險因素分析 建立Logistic回歸模型,以136例糖尿病腎病維持性血液透析患者的基線資料為樣本,以是否發生骨質疏松作為因變量,賦值為1=骨質疏松,0=非骨質疏松。連續變量按照2組總均值進行分段,轉化為兩分類變量,以提高統計效率使回歸結果清晰。單因素Logistic回歸分析提示,女性、長透析齡、高水平的iPTH、25-(OH)-VitD3、血清OPG和SOST水平是糖尿病腎病維持性血液透析患者發生骨質疏松的危險因素(P<0.05,OR>1)。選取單因素Logistic回歸分析中具有統計學意義的變量納入多因素Logistic回歸分析,回歸過程采用“進入法”以進行自變量的選擇和剔除,設定α剔除=0.10,α入選=0.05,回歸結果:共有女性、長透析齡、高水平的iPTH、血清OPG和SOST水平被保留入回歸方程。女性、長透析齡、高水平的iPTH、血清OPG和SOST水平是糖尿病腎病維持性血液透析患者發生骨質疏松的獨立危險因素。見表3。

表3 糖尿病腎病維持性血液透析患者骨質疏松多因素Logistic回歸
2.4 血清OPG、SOST診斷糖尿病腎病維持性血液透析患者骨質疏松的ROC曲線分析 ROC曲線分析得出,血清OPG診斷糖尿病腎病維持性血液透析患者骨質疏松的最佳閾值為450.9,曲線下面積為0.771,敏感度為80%,特異度為81%,準確度為77%;血清SOST診斷糖尿病腎病維持性血液透析患者骨質疏松的最佳閾值為375.6,曲線下面積為0.794,敏感度為81%,特異度為76%,準確度為79%。聯合OPG、SOST診斷糖尿病腎病維持性血液透析患者骨質疏松的曲線下面積為0.821,敏感度為85%,特異度為81%,準確度為84%。見表4。

表4 血清OPG、SOST診斷糖尿病腎病維持性血液透析患者骨質疏松的ROC曲線分析
3 討論
糖尿病腎病已成為全世界范圍引起終末期腎病主要原因[10],與非糖尿病患者比較,由于高糖環境作用導致糖尿病腎病維持性血液透析患者并發癥增加,遠期預后更差。骨質疏松是終末期腎病患者腎性骨營養不良一個常見的臨床類型,可增加終末期腎病患者骨折的致殘率和病死率,已經成為影響血液透析患者生活質量和生存率的重要因素[11]。對于糖尿病腎病維持性血液透析患者,由于長期透析導致鈣磷代謝紊亂、高糖環境下糖基化終末產物作用等因素的影響,導致骨脆性增加和骨質疏松的發生。目前骨質疏松的診斷主要通過骨密度影像學檢查,存在費用昂貴、重復操作依從性低等應用局限,尋找診斷骨質疏松的較為特異且敏感的血清學指標對于診斷和評估糖尿病腎病維持性血液透析患者的骨質疏松情況尤為重要。
血清OPG作為腫瘤壞死因子受體超家族成員,又稱破骨細胞形成抑制因子,是骨代謝的重要調節因子。OPG是由類似成骨細胞的鈣化血管細胞釋放的,其水平的增高反映了血管細胞向成骨樣細胞轉變的血管重塑過程,且循環血中的OPG是由骨組織釋放的,反映了骨轉換的狀態[6]。目前OPG水平在腎功能不全患者比正常人群顯著升高,但其與血液透析患者骨質疏松的關系仍需要進一步研究。SOST是由SOST基因編碼的糖蛋白,由213個氨基酸組成,且僅由骨細胞分泌[12]。SOST可通過拮抗骨形態發生蛋白通路,抑制骨形成。SOST具有高度的組織特異性,SOST基因敲除小鼠其皮質骨及小梁骨骨密度均增加超過50%[13],而SOST轉基因小鼠SOST表達增加可導致骨細胞合成骨硬化蛋白減少,骨密度增加,進而導致骨質疏松[14]。本研究對糖尿病腎病維持性血液透析患者OPG和SOST的表達及其與骨質疏松的關系進行深入的探討。
本研究結果發現,在糖尿病腎病維持性血液透析患者中,相比非糖尿病腎病患者,iPTH、血清OPG、SOST水平以及骨質疏松的發生比例較高,而骨密度較低。高血糖引起骨吸收增加,導致機體內不斷進行骨重建,一旦打破骨吸收和骨形成的平衡就會導致骨代謝異常。而OPG作為破骨細胞形成抑制因子,能夠有效抑制破骨細胞分化和成熟破骨細胞的活力,促進破骨細胞的凋亡,起到阻斷鈣質流失和骨質的破壞的作用,因此在糖尿病腎病維持性血液透析患者中表達升高[15]。血清中SOST表達增加可負反饋抑制骨細胞進一步合成骨硬化蛋白,導致生物體內骨形成能力受到抑制,造成骨質量的下降和骨質疏松。在2型糖尿病患者中同樣有研究報道[16],血清SOST水平顯著高于普通人群,且與糖尿病病程及糖化血紅蛋白水平呈正相關。而糖尿病腎病患者骨質疏松發生率高于非糖尿病腎病患者,可能原因包括[17]:(1)高糖導致的引起滲透性利尿使鈣、磷排出增加,血液中鈣濃度降低,激活破骨細胞,促進骨鈣磷動員,骨吸收增強,骨量減少。(2)胰島素缺乏和敏感性降低,導致腎小管重吸收減少,尿中鈣、磷過度丟失,骨鈣動員加強。骨基質和礦物質均丟失,骨吸收加速,骨形成減少。(3)糖尿病微血管病變影響骨的血流分布,毛細血管通透性增加,微血管基膜增厚,導致骨的營養障礙,影響骨重建,促進骨質疏松的發展。
此外,本研究還發現,骨密度越低,血清OPG和SOST的水平越高。女性、長透析齡、高水平的iPTH、血清OPG和SOST水平是糖尿病腎病維持性血液透析患者發生骨質疏松的獨立危險因素。由于雌激素本身具有促進骨形成與抑制骨吸收的作用,有利于維持骨密度和提高骨量。絕經女性由于雌激素水平的下降,導致骨質疏松的發生風險明顯升高[18]。長透析齡以及高水平iPTH的患者由于鈣磷代謝紊亂以及慢性腎臟病礦物質和骨異常等因素的影響,同樣也增加骨質疏松的發生風險。此外,本研究發現,血清OPG和SOST水平是維持性血液透析患者發生骨質疏松的危險因素。血清OPG水平升高可能是人體發生骨質疏松后的生理性代償反應或由于骨吸收增加,OPG釋放入血,因此在一定程度上也可以反應機體骨質疏松的程度。既往同樣有研究表明,在血液透析患者中高水平的血清OPG是發生骨質疏松癥的獨立危險因素[19]。經典通路即Wnt/β-catenin 信號通路能夠促進骨髓間充質干細胞向成骨細胞分化,增加骨形成。而SOST作為Wnt/β-catenin 信號通路的拮抗劑,能夠抑制骨合成,降低骨密度并增加骨質疏松的發生[16]。骨質疏松患者經過治療后,SOST水平逐漸下降[20],提示SOST可能參與了骨質疏松的發生發展,其表達水平與骨質情況和骨密度密切相關。
此外,本研究通過繪制ROC曲線評估血清OPG和SOST對糖尿病腎病維持性血液透析患者發生骨質疏松的診斷價值,結果顯示,血清OPG和SOST診斷骨質疏松均具有一定價值,聯合檢測血清OPG和SOST水平可作為臨床輔助診斷糖尿病腎病維持性血液透析患者骨質疏松發生的血清學標志物。本研究探討糖尿病腎病維持性血液透析患者OPG和SOST的表達及其與骨質疏松的關系,對于協助糖尿病腎病維持性血液透析患者骨質疏松的診斷和評估具有一定的臨床意義。但本研究仍存在一定的局限性,作為單中心研究,入選的樣本量較少,其結論需要大樣本多中心研究進一步驗證。
綜上,血清OPG和SOST水平在糖尿病腎病維持性血液透析患者表達水平升高,且在骨質疏松患者中的表達水平高于骨質低下和骨質正常的患者,是發生骨質疏松的獨立危險因素。聯合血清OPG和SOST水平在診斷和評估糖尿病腎病維持性血液透析患者骨質疏松具有較高的臨床應用價值,可以作為協助診斷和評估骨質疏松的血清學指標。

