大黃素通過調控ROS和NLRP3炎癥體通路改善草酸鈣結晶誘導的腎小管上皮細胞損傷
高丙鵬,田 靜,靳銀山,劉亞東,于時良,劉健男
(1.畢節市第一人民醫院泌尿外科,貴州畢節 551700;2.畢節市七星關區中醫院,貴州畢節 551700;3.哈爾濱醫科大學附屬第一醫院泌尿外科,黑龍江哈爾濱 150001)
以腎結石和腎鈣質沉著癥為代表的晶體相關腎損傷是常見的腎臟疾病,通常源于代謝失衡和集合系統解剖結構的異常[1-2]。其中與高草酸尿癥相關的草酸鈣結石是最常見的結石類型[3]。氧化應激和炎癥反應是草酸鈣結石腎損傷中的主要病理過程。草酸鈣結晶可以激活NLRP3炎癥體導致炎癥因子成熟并釋放,進而引起局部微環境病變乃至腎功能損傷[4]。結石導致的活性氧(reactive oxygen species,ROS)生成也可通過氧化應激途徑促進腎小管上皮細胞脂質過氧化以及組織器官損傷[5]。因此具有抗炎抗氧化的藥物被廣泛用于防治腎結石形成及腎功能損傷[6]。
大黃素(Emodin)是傳統中藥大黃的主要成分,是一種蒽醌類衍生物(圖1A),具有抗炎、抗感染、抗氧化、抗纖維化及免疫調節的作用[7-9]。Emodin被證實可以通過NLRP3炎癥體途徑改善哮喘小鼠的氣道炎癥反應[10]。但其針對草酸鈣結石腎損傷是否存在保護作用尚未得到證實。本研究從體外試驗層面探究Emodin是否可以改善草酸鈣結晶引起的腎小管上皮細胞的氧化應激與炎癥損傷,從而為Emodin等具有抗炎抗氧化作用的藥物在腎結石疾病中的防治提供理論依據。
1 材料與方法
1.1 材料與試劑人腎皮質近曲小管上皮細胞(HK2)購自于中國科學院細胞庫。高糖DMEM合成液體培養基(美國Gibco公司),草酸(Na2C2O4)、氯化鈣(CaCl2·2H2O)、Emodin(美國Sigma公司),兔抗人NLRP3單克隆抗體、兔抗人IL-18單克隆抗體、兔抗人IL-1β單克隆抗體(中國萬類生物公司),小鼠抗人ASC單克隆抗體、小鼠抗人cleaved-caspase-1單克隆抗體(美國Santa Cruz公司),小鼠抗人GAPDH單克隆抗體(中國中杉金橋公司),CCK-8試劑盒(日本同仁化學研究所),活性氧檢測試劑盒(中國碧云天生物技術有限公司),IL-18及IL-1β酶聯免疫吸附試驗(enzyme-linked immunosorbent assay,ELISA)檢測試劑盒(美國Boster公司)。
1.2 細胞培養將HK2細胞培養于含體積分數為10%的胎牛血清及體積分數為1%的青-鏈霉素雙抗的高糖DMEM培養液中,于37 ℃、體積分數為5% CO2培養箱中常規傳代培養。對數生長期的細胞按照實驗要求分別給予草酸鈣結晶及Emodin干預。研究分為3組:對照組、草酸鈣干預組、草酸鈣+Emodin干預組。實驗組細胞用10 μmol/L Emodin預處理2 h后,再用0.5 mmol/L的草酸鈣結晶處理24 h[11]。
1.3 草酸鈣結晶的制備將10 mmol/L的草酸和10 mmol/L的氯化鈣溶解在去離子水中并混合使其濃度為5 mmol/L。使用HCl和NaOH將混合物調節至生理pH值7.4,在室溫下沉降24 h后以2 000 g的離心力離心5 min。獲得的草酸鈣晶體用甲醇洗滌并室溫干燥,收集后使用紫外線滅菌以備用[12]。
1.4 免疫印跡(Western blot)實驗干預后的細胞提取總蛋白并采用蛋白質定量法測定蛋白濃度,用12.5 g/L的SDS-PAGE凝膠電泳分離后電轉至聚偏氟乙烯膜,5 g/L脫脂奶粉室溫封閉1 h。然后孵育NLRP3、ASC、cleaved-caspase-1、IL-18及IL-1β抗體并4 ℃冰箱過夜。辣根過氧化物酶標記的二抗室溫孵育1 h后滴加電化學發光(electrochemiluminescence,ECL)液進行顯影。Image Lab軟件分析蛋白條帶的灰度值后進一步用內參GAPDH標準化并分析目的蛋白的表達差異。
1.5 細胞活力測定細胞活性使用CCK-8試劑盒進行檢測。HK2細胞在96孔板內生長至對數期,約7 000個/孔。在0.5 mmol/L草酸鈣結晶及相應濃度的Emodin處理24 h后(每組設6個復孔),每個孔加入10 μL CCK-8溶液并37 ℃孵育1 h。于波長450 nm處用酶標儀檢測吸光度并計算細胞活性。
1.6 ROS檢測干預后的細胞用無血清培養液洗去殘余藥物后,在含DCFH-DA探針的無血清培養液中重懸,在37 ℃培養箱中避光孵育20 min,期間每隔3~5 min混勻吹打1次。每組均取相同數目的細胞重懸于500 μL的磷酸鹽緩沖液(phosphate buffered saline,PBS)中。濾過并轉移至流式BD管后,搖勻并上機檢測。結果采用流式分析軟件FlowJo進行分析。
1.7 培養液IL-18及IL-1β水平的測定各組細胞培養液提取后離心(離心力1 000 g,10 min)。取上清液用ELISA法對炎癥因子IL-18、IL-1β濃度進行測定,于波長410 nm處用酶標儀檢測吸光度并計算炎癥因子濃度。
2 結 果
2.1 Emodin對腎小管上皮細胞損傷的改善CCK-8實驗顯示草酸鈣結晶能明顯降低細胞活性(圖1B)。Emodin的預處理可以改善草酸鈣結晶對細胞的損傷,并在一定范圍內呈濃度依賴性。細胞活性實驗表明濃度為10 μmol/L的Emodin對腎小管上皮細胞在草酸鈣結晶損傷中的保護效果最佳,因此后續實驗選擇此濃度為干預條件。
2.2 Emodin對氧化應激反應的抑制作用流式細胞儀檢測發現(圖2),草酸鈣結晶的干預會使腎小管上皮細胞內ROS發生率顯著增加。與對照組相比,草酸鈣結晶組ROS的生成增加了4~5倍。而與草酸鈣結晶單獨干預組相比,Emodin的加入顯著降低了細胞內ROS水平。
2.3 Emodin對腎小管上皮細胞炎癥反應的緩解Western blot顯示與對照組相比(圖3),草酸鈣結晶干預顯著增加了細胞內NLRP3炎癥體組成蛋白(NLRP3、ASC、Pro-caspase-1)及下游相關炎癥因子(Cleaved-caspase-1、IL-18、IL-1β)的表達。而Emodin預處理可以顯著下調該NLRP3炎癥體通路相關蛋白(NLRP3、ASC、Pro-caspase-1、Cleaved-caspase-1、IL-18、IL-1β)的表達。
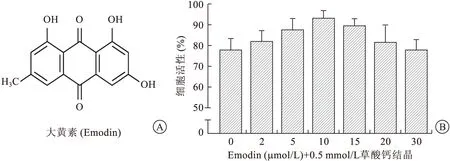
A:Emodin結構式;B:細胞增殖與毒性試驗。圖1 Emodin結構及細胞增殖與毒性試驗圖
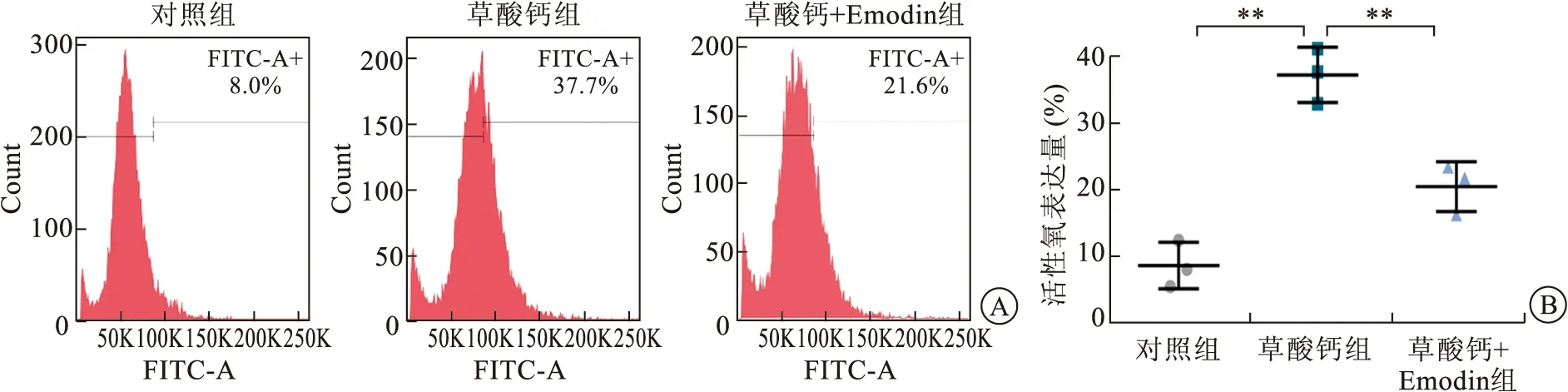
A:流式細胞術檢測各組ROS表達量;B:柱狀圖定量分析。組間對比,**P<0.01。圖2 不同治療組ROS表達量分析圖
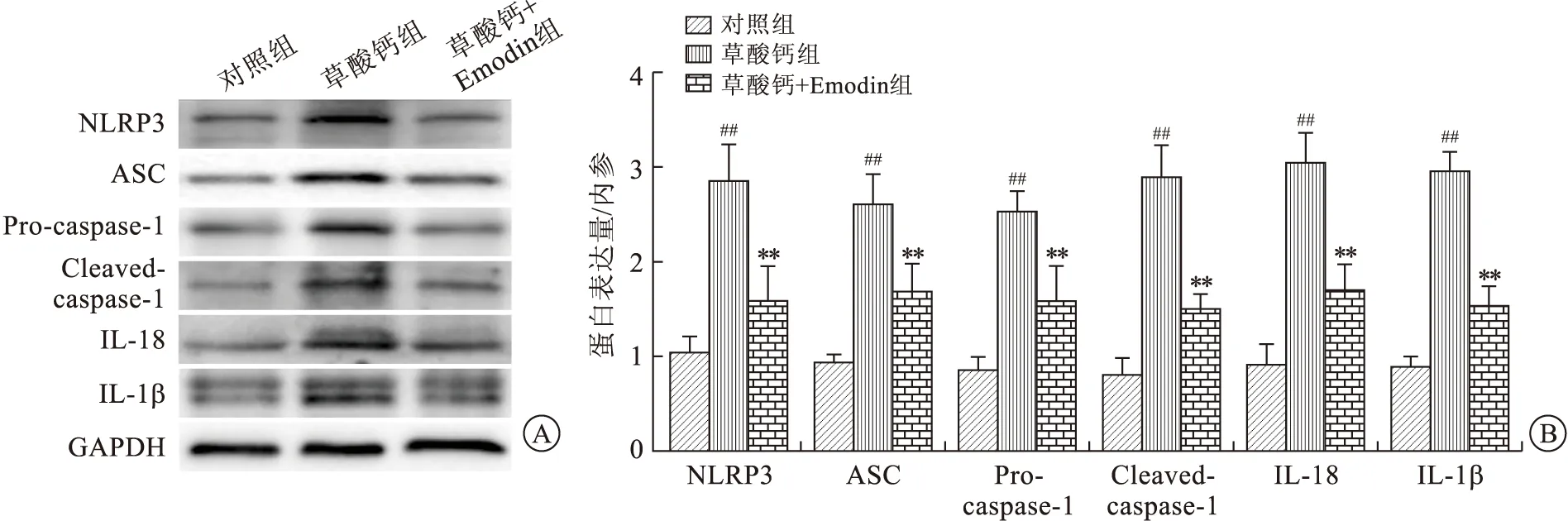
A:Western blot檢測炎癥相關蛋白NLRP3、ASC、Pro-caspase-1、Cleaved-caspase-1、IL-18、IL-1β的表達量;B:蛋白表達量的柱狀圖定量分析。與對照組比較,##P<0.01;與草酸鈣組比較,**P<0.01。圖3 Emodin對草酸鈣結晶引起的炎癥相關蛋白表達水平的影響
2.4 Emodin對細胞分泌炎癥因子的影響ELISA檢測顯示(圖4),草酸鈣結晶干預增加細胞培養基中炎癥因子IL-18及IL-1β的含量。與對照組相比,草酸鈣結晶組的培養液中IL-18/IL-1β濃度升高2~3倍,而Emodin的預處理可以顯著緩解該分泌炎癥因子的升高,各組間差異顯著,P<0.01。
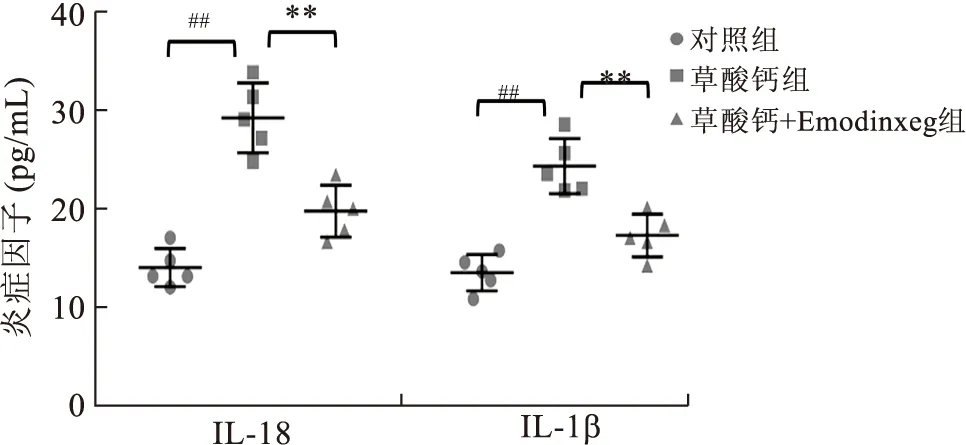
與對照組比較,##P<0.01;與草酸鈣組比較,**P<0.01。圖4 Emodin對各組細胞分泌炎癥因子水平的影響
3 討 論
解除解剖梗阻以及在飲食上限制草酸的攝入一直以來都是腎結石的主要治療方案。然而,研究表明慢性腎結石及腎鈣質沉著癥會造成腎功能嚴重損傷,由此我們意識到在腎結石中保護腎功能十分重要[13]。腎結石的腎功能損傷主要來源于局部的炎癥反應和氧化應激[5]。NLRP3炎癥體通路及氧化應激已被證實參與草酸鈣結石的病理生理過程[5,14],因此有必要尋找有效的抗炎抗氧化途徑治療草酸鈣結石導致的腎損傷。
ROS作為氧化應激的主要調節因子,已經被證明是結石病理損傷中的主要參與者[15]。相關研究表明ROS水平升高會引起腎小管上皮細胞脂質過氧化,組織的炎癥反應以及腎功能損傷[16]。也有研究表明ROS可以通過NF-κB途徑促進NLRP3、pro-IL-18/1β等炎癥相關蛋白的表達,啟動NLRP3炎癥體通路并引起炎癥反應[17]。我們的研究也表明草酸鈣結晶的干預會引起ROS上調,而Emodin預處理可以顯著緩解該氧化應激損傷并保護細胞活性。
NLRP3炎癥體通路在草酸鈣結石腎損傷中的作用已經在體內和體外實驗中得到證實:草酸鈣結晶可以通過刺激NLRP3炎癥體分泌IL-1β導致腎小管上皮細胞炎性損傷[18];同時NLRP3炎癥體通路是高草酸尿癥大鼠腎功能衰竭的重要病理途徑[5]。我們也在體外實驗角度證明了這一點,草酸鈣結晶的干預顯著上調腎小管上皮細胞NLRP3炎癥體相關蛋白的表達及IL-18、IL-1β炎癥因子的分泌,同時該炎癥反應可被Emodin顯著改善。NLRP3炎癥體的觸發包括啟動和激活2個連續但功能獨立的步驟,其中炎癥體的啟動觸發炎癥體組成蛋白NLRP3、ASC、Pro-caspase-1的合成,炎癥體的激活觸發NLRP3炎癥體的組裝與活化及下游炎癥因子的激活[19]。研究表明,ROS是參與這2個環節的關鍵因子[19]。我們的結果亦與之相符,即在草酸鈣結晶和Emodin干預模型中,ROS與NLRP3炎癥體通路是被同向調節的。然而在草酸鈣結晶腎損傷中NLRP3炎癥體通路是否由ROS直接調控尚需進一步探索。
Emodin作為傳統中藥大黃根莖的有效成分,具有廣泛的藥理作用,被應用于抗癌、保肝、抗菌、抗炎及抗氧化領域[7]。其分子作用機制也從多角度進行了闡述,如:Nrf2/ARE/HO-1信號通路,IRS2/PI3K/Akt通路,NLRP3炎癥體通路[20-22]。然而,關于Emodin在草酸鈣結晶炎癥損傷及氧化應激損傷中的作用尚無研究。本研究通過體外實驗首次論證了Emodin在該領域的保護作用及其作用機制,與Emodin在其他領域中的報道一致,我們發現Emodin可以顯著改善草酸鈣結晶引起的腎小管上皮細胞毒性、ROS生成和炎癥因子的表達。該結果證明Emodin可以通過調控ROS及NLRP3炎癥體通路改善草酸鈣結晶引起的腎小管上皮細胞損傷。然而,Emodin在腎結石體內模型的保護效果及具體作用靶點有待研究。
綜上所述,本研究首次從細胞層面驗證了Emodin可以通過調控ROS及NLRP3炎癥體通路抑制草酸鈣結晶引起的腎小管上皮細胞氧化應激和炎癥損傷。為草酸鈣腎結石的防治、Emodin及類似藥物的臨床應用提供了新的研究方向與思路。

