m6A閱讀蛋白IGF2BP1在膀胱癌中的表達及作用
周子健,李 凱,蔡令凱,莊俊濤,楊 瀟,楊海偉,李鵬超,呂 強
(南京醫科大學第一附屬醫院泌尿外科,江蘇南京 210029)
膀胱癌每年導致全球近17萬人死亡,是全球第6大常見腫瘤[1],具有進展快、侵襲性強和預后不佳的臨床特點[2],故探索其新的生物標志物和治療靶點至關重要[3]。N6-甲基腺嘌呤(m6A)是真核生物RNA中最常見的修飾之一,參與調節腫瘤進展[4-5]。胰島素樣生長因子2 mRNA結合蛋白1(IGF2BP1),屬于RNA結合蛋白家族的一員[6],可以促進腫瘤細胞增殖、侵襲和化療耐藥[7]。2018年,IGF2BP1首次被報道可以作為一種新的m6A閱讀蛋白,識別mRNA上保守的GG(m6A)C序列,促進目標mRNA的穩定及其翻譯[8]。隨后研究發現,IGF2BP1以m6A修飾的方式促進轉錄調節因子SRF轉錄形成致癌驅動網絡[9]。
本團隊在之前的研究中已經發現m6A甲基化蛋白METTL3能夠以m6A依賴的方式促進膀胱癌腫瘤的增殖[10],而本次研究主要探討m6A閱讀蛋白IGF2BP1在膀胱癌中的表達及作用。
1 材料與方法
1.1 樣本來源膀胱癌組織及其配對的癌旁組織均取自2010至2013年在南京醫科大學第一附屬醫院(江蘇省人民醫院)確診為膀胱癌并進行手術的患者。隨訪的截止日期是2018年1月。所有患者都簽署知情同意書。本研究使用的臨床樣本已得到南京醫科大學第一附屬醫院(江蘇省人民醫院)倫理委員會的證實。
1.2 細胞培養人膀胱癌細胞系T24、J82、BIU87、TCC細胞株和人正常膀胱上皮細胞系SV-HUC購自中科院上海細胞庫。細胞分別用含體積分數為10%的胎牛血清(fetal bovine serum,FBS)的DMEM培養基、1640培養基、F12K培養基,于37 ℃、體積分數為5%的CO2飽和濕度培養箱中培養。FBS、胰蛋白酶和各類培養基均購自Thermo公司。
1.3 細胞轉染小干擾RNA(siRNA)轉染:按照LipofectamineTM3000說明進行siRNA的轉染,轉染分為陰性siRNA轉染組(NC組)及干擾IGF2BP1表達的siRNA組(siRNA1和siRNA2)。siRNA由江蘇凱基生物公司設計及合成。簡要操作如下:轉染前24 h,接種T24細胞(1×105個/孔)于6孔板中,細胞生長融合達到60%時轉染siRNA及NC組,siRNA及LipofectamineTM3000分別溶解于Opti-MEM培養基中,制備成siRNA-Lip 3000混合物,轉染后于培養箱內孵育1~2 d。
1.4 免疫組化取膀胱組織標本切片,常規脫蠟,抗原提取后,用IGF2BP1抗體(1∶100,Proteintech)封閉并染色,磷酸鹽緩沖溶液(phosphate buffer solution,PBS)代替一抗稀釋液作為陰性對照,具體染色實驗步驟依據試劑盒進行。結果判定:細胞中出現黃色或棕黃褐色為陽性,陽性細胞比例評分標準為:無陽性計0分、陽性細胞比例<25%計1分、25%~50%計2分、51%~75%計3分、>75%計4分。染色強度評分標準:無染色0分、淡黃色計1分、黃色計2分、棕黃色計3分。以陽性細胞比例評分和染色強度評分之和判斷癌組織和癌旁組織中IGF2BP1蛋白的表達,0~4分為陰性,5~7分為陽性。
1.5 RNA提取和qRT-PCRTrizol法(Invitrogen,USA)提取的細胞和組織的總RNA,根據試劑盒說明書利用The Applied Biosystems Stepone Plus PCR System (Applied Biosystems,USA)和LightCycler 480(Roche,USA)儀器進行逆轉錄及qRT-PCR實驗。β-actin用作內參,所有實驗重復3次,計算機斷層掃描(computed tomography,CT)值取平均值。根據擴增的標準曲線計算出目的基因的CT值后,從而反映IGF2BP1 mRNA的相對表達水平。逆轉錄及qRT-PCR試劑購自南京諾唯贊公司。PCR引物由南京擎科公司合成,IGF2BP1引物序列:上游TAGTACCAAGAGACCAGACCC,下游GATTTC TGCCCGTTGTTGTC;β-actin引物序列:上游AGC GAGCATCCCCCAAAGTT,下游GGGCACGAAG GCTCATCATT。
1.6 細胞增殖和克隆實驗細胞增殖實驗中,以每孔1 000個細胞的密度將轉染后的細胞接種到96孔板中。接種后24、48、72、96 h分別采用細胞計數kit-8(CCK-8)系統測定細胞活力,用酶標儀(Tecan,瑞士)在450 nm處測定吸光度值。對于克隆形成實驗,將500個細胞接種到6孔板中并保持在完全培養基中生長8 d,而后將克隆板在1.44 mol/L多聚甲醛中固定20 min,并用結晶紫染色液(碧云天生物公司)染色20 min后拍攝可見的群落。
1.7 生物信息學分析TCGA數據庫中膀胱癌基因表達量數據的收集:在TCGA數據庫中下載膀胱癌相關轉錄譜的基因表達量數據(https://portal.gdc.cancer.gov/),數據類型為HTSeq-FPKM。獲得膀胱癌基因表達量數據420例,其中19例癌旁組織,411例腫瘤組織。之后提取19種m6A相關基因的mRNA表達量并進行數據校正,應用R4.0.0軟件進行統計學分析及相應圖形繪制,采用“heatmap”包進行圖形繪制。評估m6A相關蛋白之間的交互關系:使用STRING數據庫(http://stringdb.org)進行m6A相關蛋白的相關性分析。
1.8 統計學分析SPSS 26.0軟件進行統計學分析,通過t檢驗或卡方檢驗分析兩組之間的差異,非配對樣本間比較采用Wilcoxon秩和檢驗或Kruskal-Wallis秩和檢驗。所有統計檢驗均為雙側,P<0.05表示差異有統計學意義。
2 結 果
2.1 m6A相關蛋白在膀胱癌組織及癌旁組織中的表達水平TCGA數據分析結果顯示,在19種m6A相關蛋白中,甲基化蛋白METTL3、閱讀蛋白IGF2BP1、IGF2BP3和YTHDC1的表達量在腫瘤組織中顯著高于癌旁組織;而其他甲基化蛋白如METTL14和METTL16,去甲基化蛋白ALKBH5和FTO的表達在腫瘤組織中則顯著下調(P<0.05,圖1A)。同時,在膀胱癌中,m6A相關蛋白之間存在不同程度的相關性。其中IGF2BP1與METTL3、IGF2BP2、IGF2BP3和YTHDC1等呈現不同強度的正相關性(圖1B),提示IGF2BP1可能通過m6A依賴的方式與其他m6A相關蛋白協調作用發揮致癌作用。GEPIA數據庫(http://gepia.cancer-pku.cn/)聯合GTEx中的正常組織樣本和TCGA中的臨床樣本綜合分析顯示:IGF2BP1在膀胱腫瘤中高表達(圖1C)。
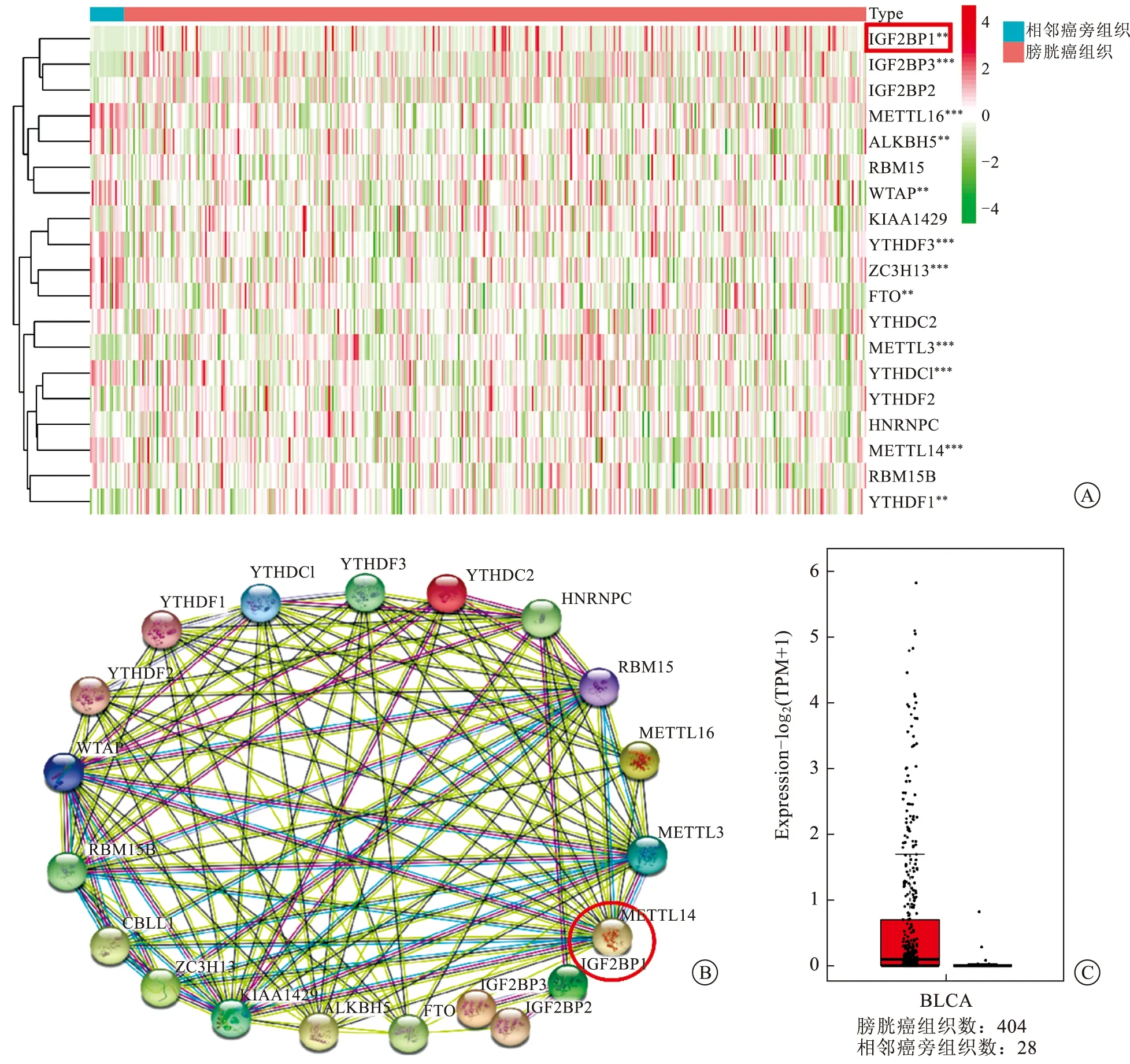
A:19種m6A相關蛋白在TCGA膀胱癌樣本中的差異表達;B:STRING數據庫分析19種m6A相關蛋白的相關性;C:GEPIA數據庫顯示IGF2BP1在膀胱癌中的高表達。圖1 m6A相關蛋白在膀胱癌中的表達
2.2 IGF2BP1在膀胱癌組織及人膀胱癌細胞系中的表達水平在35例膀胱癌患者的臨床樣本中,qRT-PCR實驗顯示膀胱腫瘤組織中IGF2BP1的mRNA表達水平顯著高于癌旁正常組織(P=0.048 1,圖2A),與公共數據庫TCGA分析結果一致。免疫組化檢測表明,IGF2BP1的蛋白表達水平在腫瘤組織中也顯著高于癌旁組織(圖2B)。隨后我們以人正常膀胱上皮細胞SV-HUC細胞為對照組細胞,通過qRT-PCR檢測人膀胱癌細胞系中IGF2BP1的mRNA表達水平,結果顯示,在T24、J82和TCC細胞株中,IGF2BP1的mRNA表達均明顯高于其在SV-HUC細胞中的表達;但在BIU87膀胱癌細胞中,IGF2BP1表達差異不明顯(圖2C)。BIU87細胞屬于低度惡性膀胱癌細胞,而T24、J82和TCC細胞則是高度惡性膀胱癌細胞,IGF2BP1的表達是否與腫瘤的惡性程度相關,有待后續研究驗證。
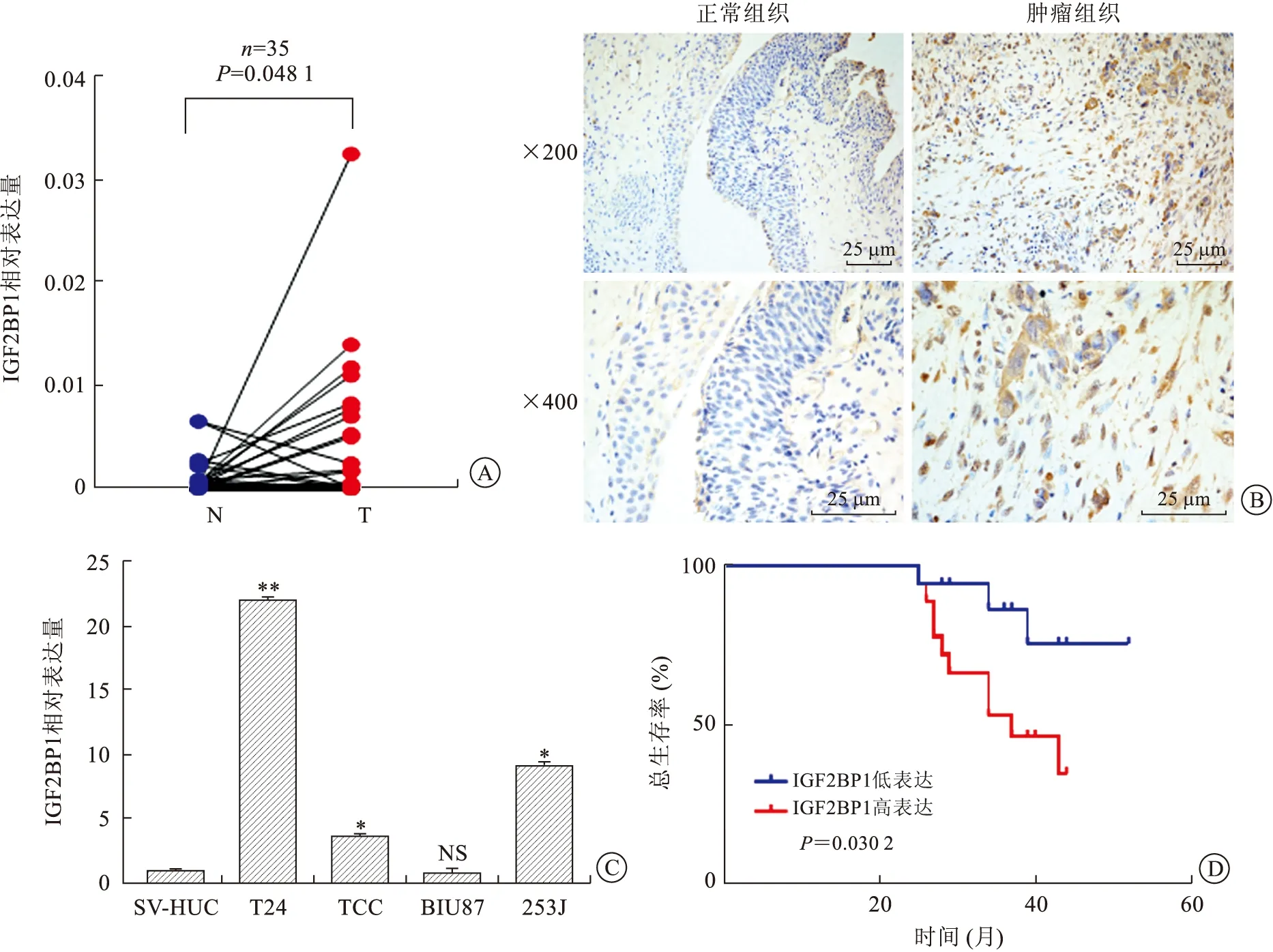
A:qRT-PCR檢測35對膀胱癌組織(T)與相鄰癌旁組織(N)中IGF2BP1 mRNA的相對表達水平;B:免疫組化檢測顯示IGF2BP1蛋白在膀胱癌臨床樣本中的表達情況(×200,×400);C:以SV-HUC細胞為對照,qRT-PCR檢測膀胱癌細胞系中的IGF2BP1的相對表達水平(*P<0.05,**P<0.01,NS表示數據無統計學意義);D:生存分析顯示IGF2BP1表達水平對35例膀胱癌患者預后的影響。圖2 IGF2BP1在膀胱癌臨床樣本中表達升高并影響膀胱癌患者預后
2.3 IGF2BP1表達與膀胱癌患者病理特征的相關性分析在本研究中,IGF2BP1的mRNA表達與膀胱癌患者的年齡、性別、腫瘤分期、分級和腫瘤最大徑之間均無明顯關聯(P>0.05,表1),可能是本研究中臨床樣本例數過少導致。但是Kaplan-Meier生存分析顯示,與低表達IGF2BP1的膀胱癌患者相比,高表達IGF2BP1的患者預后更差,生存時間更短(P=0.030 2,圖2D)。
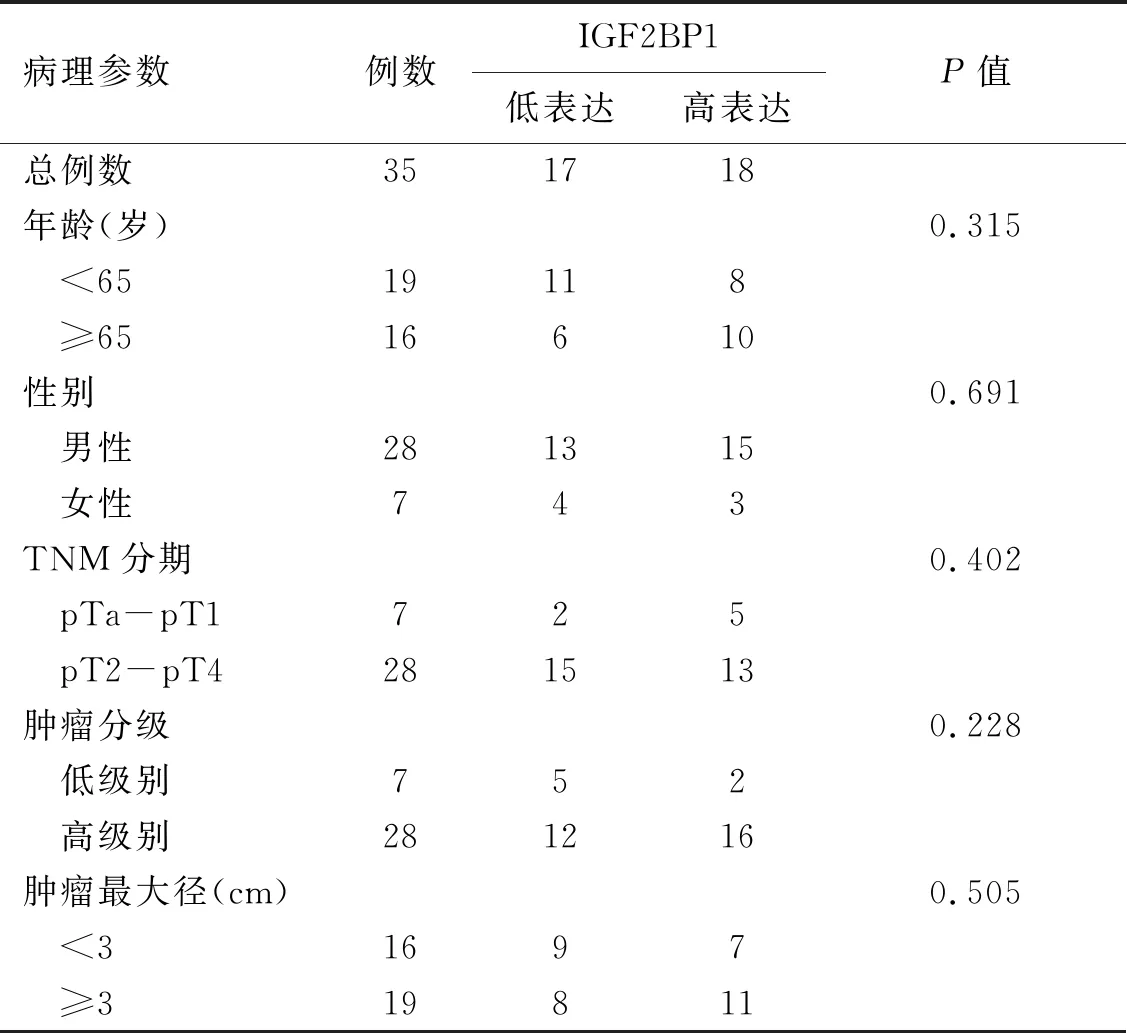
表1 IGF2BP1 mRNA的表達與膀胱癌患者病理特征的相關性分析
2.4 IGF2BP1 siRNA轉染效果及其對膀胱癌細胞增殖能力的影響T24細胞轉染IGF2BP1 siRNA 48 h后,通過qRT-PCR和Western blot實驗分別檢測各組細胞IGF2BP1的表達水平。結果顯示,相比于NC組,siRNA組IGF2BP1的表達明顯降低(圖3A、B)。隨后使用轉染好的細胞進行細胞增殖實驗,CCK8實驗檢測顯示,IGF2BP1基因干擾后導致細胞增殖能力顯著下降(圖3C)。克隆形成實驗檢測也顯示,IGF2BP1基因干擾降低了菌落形成效率(圖3D)。

A~B:qRT-PCR和western blot實驗檢測IGF2BP1小干擾RNA的轉染效率;C~D:CCK8實驗和克隆形成實驗檢測IGF2BP1干擾后膀胱癌細胞的增殖能力。結晶紫染色;*P<0.05,**P<0.01。圖3 IGF2BP1干擾后膀胱癌細胞增殖能力減弱
3 討 論
m6A甲基化蛋白和去甲基化蛋白之間的交互作用決定了m6A修飾的動態過程和可逆調節。然而,m6A修飾必須被不同的閱讀蛋白所識別才能發揮不同的下游功能[11]。閱讀蛋白IGF2BP1在胚胎發育過程中大量存在,在成年時幾乎看不到,但在癌癥發生時IGF2BP1又重新合成進而表達上調[12]。既往研究發現IGF2BP1可通過內切酶干擾目標mRNA的降解發揮致癌作用;最近的研究發現IGF2BP1優先識別發生m6A修飾的mRNA,其與靶基因的關聯也可以通過識別靶轉錄本的m6A修飾而增強,表明IGF2BP1是一種新的m6A解讀器[8]。2020年最新研究表明,作為m6A修飾的閱讀蛋白,IGF2BP1可以通過識別m6A修飾進而縮短多種癌細胞的G1期細胞周期[13];LINC00266-1編碼的多肽RBRP可以增強IGF2BP1對靶基因的m6A修飾的識別,從而發揮致癌功能[7]。
在過去的40多年里,肌肉浸潤性膀胱癌和晚期膀胱癌的系統治療主要以鉑類的化療為主。然而在近10年,測序技術的發展使得膀胱癌的基因組特性得以快速確定,加深了我們對膀胱癌發病機制的理解,膀胱癌治療前景也相應地發生了一些變化:常用的分子靶點被用于開發靶向療法,如成纖維細胞生長因子受體抑制劑和抗體-藥物偶聯療法[14]。而m6A修飾研究的迅速發展也標志著分子生物學的重大進展,有助于揭示癌癥發展的生物學機制,可能為癌癥治療提供新的靶點。目前多項研究表明甲基化蛋白METTL3寫入m6A修飾后可以促進膀胱癌進展[10,15-16];METTL14介導Notch1發生m6A修飾卻可以抑制Notch1自身RNA的穩定性,進而抑制膀胱癌干細胞的自我更新與膀胱腫瘤的發生[17],其他關于m6A修飾在膀胱癌中的研究相對較少。
本研究通過siRNA技術干擾膀胱癌細胞IGF2BP1的表達,結果發現IGF2BP1表達抑制后膀胱癌細胞增殖活力明顯降低,提示抑制IGF2BP1表達可減緩膀胱癌的發生發展。同時本研究結果顯示,IGF2BP1在膀胱癌組織和膀胱癌細胞中表達均明顯上調,與公共數據庫TCGA的分析結果一致,提示IGF2BP1的高表達可能與膀胱癌的發生、發展緊密相關,有可能會成為膀胱癌治療中新的治療靶點,但是由于本研究臨床樣本太少,IGF2BP1 mRNA的表達與患者的病理特征均無明顯關系,后續還需要大量的臨床研究進一步驗證。下一步本課題組將重點研究IGF2BP1基因表達影響膀胱癌進展的具體機制,并且探討針對性靶向基因治療是否具有臨床應用的研究前景。

