CT平掃腎臟矢狀位重建后認知影像融合在超微經皮腎鏡取石術中的臨床應用
尹冰德,何 昶,陸旭偉,郭錐鋒,楊 帆,何敏坷,黃嘉琦,巫嘉文,王 杭
(1.復旦大學附屬閔行醫院泌尿外科,上海 211099;2.復旦大學附屬中山醫院泌尿外科,上海 200032)
經皮腎鏡取石術(percutaneous nephrolitho-tomy,PCNL)是復雜性腎結石的一線治療方式[1]。快速清除結石及較高的清石率是PCNL的顯著優勢,可能出現嚴重并發癥是制約其推廣的重要原因。經皮腎通道的大小通常與出血有關,隨著通道直徑的增大出血量會有一定的增多。精準目標腎盞穿刺是減少輸血、介入止血甚至腎切除等嚴重出血并發癥的關鍵所在。目前使用范圍最廣的經皮腎穿刺定位方式為術中X線造影和超聲實時定位,各有優缺點其中超聲定位時除了探查腎臟本身,還需辨別腎臟與鄰近器官的關系、腎盂腎盞的相對立體結構及穿刺目標盞的結石清除效率等[2]。我們發現計算機斷層掃描(computed tomography,CT)平掃腎臟矢狀位重建時,其影像圖像與術中超聲引導時采用腎臟縱切探查的聲像圖高度符合,術前擬定穿刺目標腎盞,術中可通過認知融合超聲引導下穿刺。本文將探討CT平掃腎臟矢狀位重建在認知影像融合(CT-US)指導術中超聲實時引導下超微經皮腎鏡取石術(super-mini PCNL,SMP)的臨床應用,并介紹初步研究結果。
1 資料與方法
1.1 臨床資料對2019年6月至2020年5月在我院行SMP的患者進行回顧性研究。觀察兩組的目標盞選擇時間(從B超探查開始到成功穿刺目標盞),手術時間(從穿刺開始至手術結束完成)等圍手術期相關數據,主要觀察指標為目標盞選擇時間。患者術前完善中段尿培養及藥敏、血常規、C反應蛋白、降鈣素原及腎臟CT檢査。術前合并感染患者使用抗菌藥物復查提示感染控制后(中段尿培養轉陰及各項指標明顯好轉如血常規、C反應蛋白、降鈣素原等)手術。術后腹部平片(kidney ureter bladder,KUB)檢查發現殘余結石直徑>4 mm為有意義結石殘留。術后監測患者體溫、神志、血壓,如考慮有膿毒血癥應立即給予心電監護、吸氧,泰能等特殊抗生素抗感染治療,如低血壓使用去甲腎上腺素,必要時使用糖皮質激素(如氫化可的松)。認知影像融合:術前基于CT平掃腎臟矢狀位重建對腎臟穿刺目標盞、路徑初步建立認知,術中應用于超聲引導下經皮腎手術的方法。結石直徑:取結石最大徑(cm)。
1.2 主要設備64排螺旋CT(德國西門子公司);上海瑞柯恩激光技術有限公司,型號H3B。
1.3 方 法
1.3.1CT平掃腎臟矢狀位重建 CT-US組術前行CT平掃檢査(圖1A、B、C),最小掃描層面為0.625 mm,術前、術中PCAS系統下行腎臟矢狀位重建(圖1D、E)。
1.3.2手術步驟 在截石位輸尿管鏡下逆行插入F5輸尿管導管,接輸液器逆行重力灌注充盈腎集合系統(術中發現結石墜入輸尿管時改用人工注水)。然后改為俯臥位。CT-US組結合CT平時腎臟矢狀位重建進行定位引導,即在B超初步定位后參考CT腎臟矢狀位重建影像進行微調,根據擬定的目標盞進行穿刺。在成功穿刺目標盞見清亮尿液流出后置入“J”形導絲,拔除穿刺針外鞘,切開皮膚1 cm,使用筋膜擴張器逐級擴張通道至F12,更換F14金屬擴張器,置入F14 SMP腎鏡,連接負壓清石系統,將結石清除,COOK超滑導絲引導下順行留置F6輸尿管支架管,根據術中清石情況考慮是否無管化,術畢。US組采用傳統術中超聲進行定位引下SMP(圖1F)。
1.3.3統計學方法 采用SPSS 22統計軟件處理數據。方差齊性的變量以均數表示。偏態分布定量變量以中位數表示;定性變量以率表示。兩組樣本均數比較釆用獨立樣本t檢驗。兩組間定性變量比較采用χ2檢驗,必要時釆用Fisher’s精確檢驗。以P<0.05為差異有統計學意義。
2 結 果
本研究共納入53例患者。CT-US組28例,男性18例,女性10例;平均年齡50.46(25~77)歲;平均體重指數(body mass index,BMI)24.53(22~27);平均結石最大徑3.8(1.5~5.0)cm;部分鹿角形結石9例,非鹿角形結石12例,輸尿管上段結石7例。B超組25例,男性14例,女性11例;平均年齡49(29~70)歲;平均BMI 23.8(20.5~27.05);平均結石最大徑2.9(1.5~4.2)cm;部分鹿角形結石10例,非鹿角形結石9例,輸尿管上段結石6例。
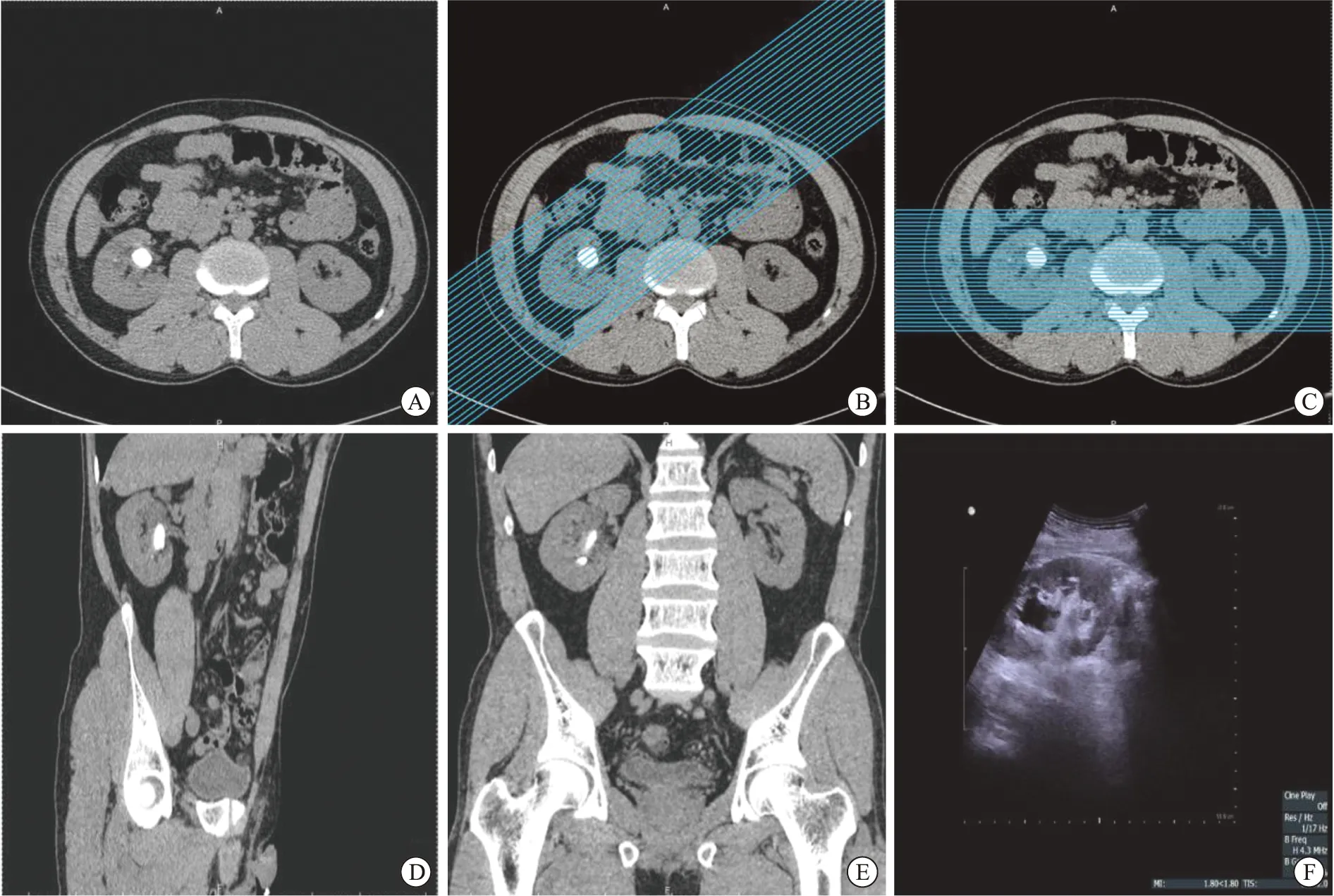
A:CT平掃橫斷面;B:CT平掃腎臟矢狀位重建示意;C:CT平掃冠狀位重建示意;D:腎臟矢狀位重建指腎臟縱軸方向重建;腎臟矢狀位重建后提示術前擬定穿刺目標盞、穿刺深度、穿刺體表位置,更符合術中超聲定位時圖像,通過認知融合指導超聲引導下穿刺;E:冠狀位重建后影像圖片提示腎臟與周圍器官的關系不符合超聲實時定位時的關系,不利于術前明確穿刺目標腎盞;F:同一患者實時超聲定位圖像。圖1 CT平掃冠狀位與腎臟矢狀位重建的不同及超聲實時定位圖像
3 討 論
精準的腎盞穹窿穿刺是PCNL成功的關鍵,成功的穿刺可以最大限度地減少圍術期并發癥的發生并提高清石率[3]。超聲定位下PCNL穿刺相比于X線定位更有優勢,可避免射線輻射造成的潛在損傷,也可降低鄰近器官組織的損傷,但由于B超影像的特殊性及專業性,學會判別超聲下的組織器官聲像圖需要專業的學習及長時間的超聲操作積累。PCNL術中穿刺需要泌尿外科醫生對腎盂、腎盞的三維結構及穿刺路徑與腎周組織器官關系有深刻的理解,而傳統超聲定位穿刺術前判讀IVP及CTU對術中超聲定位的幫助相對有限。復雜性腎結石依腎盞復雜的解剖結構分布,KUB、IVU、及CTU不能全面清晰地顯示結石形態及與周圍組織器官的三維關系,不能精確擬定穿刺通道方向和路徑[4]。
PCNL術中超聲定位穿刺時需要找到最佳的穿刺平面,此穿刺平面為腎臟矢狀位在體表的投射(圖1B)。CT平掃重建采用腎臟矢狀位(腎臟縱軸方向)可以顯露此穿刺平面,且符合術中超聲探查腎臟縱軸時完整展現腎盂及各個腎盞時的穿刺原則。此時CT影像截面與超聲定位時腎臟縱軸探查的聲像圖高度符合,重建的方向與穿刺時超聲探頭平行,尤其對于習慣采用頭端穿刺方法時,術前明確目標腎盞穿刺路徑是否有損傷肝臟、脾臟及胸膜的風險。術前擬定體表穿刺點及體表標志,減少術中超聲探查定位時間,顯著縮短定位時間,精準建立皮腎通道,減少術中術后出血。相對于傳統的超聲定位穿刺方法,術前CT平掃腎臟矢狀位重建,確定更為合理的穿刺目標盞、穿刺點與重要體表標記的關系及穿刺路徑,可顯著減少術中、術后出血量。
本研究結果(表1)提示CT-US組術前、術后血紅蛋白差值顯著低于B超組,術前腎臟矢狀位重建后的CT平掃圖像利于術中認知融合穿刺,更能精準穿刺腎盞穹隆,減少穿刺腎柱或直接穿刺腎盂導致出血甚至血腫形成的發生[5]。SMP手術一般出血量較少,超聲引導精準腎盞穹窿穿刺及多普勒超聲可避開穿刺路徑的血管時出血會更少[6]。結果提示血紅蛋白下降幅度稍高,考慮與術后輸液血液稀釋有關。精準的腎盞穹窿穿刺更利于術中結石清除及手術時間,兩組病例我們應用SMP,皮腎通道常規采用F14,我們認為結石清除率和手術時間與目標腎盞的選擇有關,術中出血及血塊形成影響手術視野,一定程度上影響結石的清除。因此,我們認為減少術中、術后出血及提高結石清除率更得益于術中精準穿刺,術前擬定合理目標腎盞并確定穿刺路徑有利于術中穿刺的實施。
表1 CT-US組與US組的相關指標比較
CT平掃腎臟矢狀位重建的優點在于:①術前模擬了經皮腎穿刺時超聲定位腎臟縱軸,利于術前了解腎臟集合、前后組腎盞分布,利于腎盞精準穿刺;②術前熟悉腎臟鄰近器官分布,確定穿刺目標腎盞路徑,減少穿刺術中鄰近臟器損傷(肝、脾、肺、胸膜及腸管);③CT平掃腎臟矢狀位重建部分符合經皮腎穿刺窗口,利用體表標志,可初步確定體表穿刺點及穿刺進針方向。④CT平掃腎臟矢狀位重建可以基本了解腎輸尿管結石、腎積水及腎盂腎盞分布情況,不需要注射造影劑、對腎功能無影響、無需二次甚至多次掃描檢查、耗時短等優勢,人體接受的放射劑量遠低于CT尿路造影,可以在短期內重復檢查隨訪[7]。SMP的優勢在于術中、術后出血相對較少,且術中聯合負壓吸引裝置,手術過程中保持腎盂低壓狀態,能大幅降低術中、術后感染及膿毒血癥的發生,但精準的腎盞穹窿穿刺仍然是手術成敗及降低手術并發癥發生率的決定因素[8]。SMP在治療直徑<2 cm的腎結石方面優勢更大,且安全性更高,對于大負荷結石可考慮分期手術。雖然SMP手術時間較長,但出血和術后疼痛的發生率明顯較低,住院時間較短[9]。
融合影像技術以往更多應用在前列腺活檢及肝臟腫瘤射頻消融中,此技術可以使穿刺更加精準[10-13]。融合影像技術可融合CT與B超的優點,增加空間定位能力,在解剖結構上更加形象具體[14]。但融合影像技術目前仍然不能完全依賴融合技術,需要發揮人的主觀能動性進行調整,依靠人的肉眼進行圖像的對比和調整,在對位精度上還無法做到完全精準,尚無法在高度精確的數字領域實現CT與超聲影像的完全統一。我們認為腎臟矢狀位重建后的CT影像可進行術中連續翻頁播放,術中使用認知影像融合進行超聲定位,基層醫院同樣容易實現,更有利于術中超聲定位,減小PCNL的手術難度,降低手術并發癥發生率[15]。
綜上所述,我們初步研究發現,采用CT平掃腎臟矢狀位重建后認知影像融合指導術中超聲定位技術進行SMP是安全有效的,尤其對于初學者來說可以顯著縮短穿刺定位的學習時間,相對于傳統超聲定位,具有更加精準的定位效果。認知影像融合技術具有操作簡單、成本低的優勢,設備優勢低的基層醫院也可應用。本研究屬于回顧性研究且認知影像融合具有較強的主觀能動性,客觀評價較弱。我們擬進一步整合CT影像輸入計算機軟件進行術中超聲融合,研究對影像融合及人工智能輔助穿刺系統進行深入。

