糖尿病周圍神經病變機械性痛覺超敏的比較性研究*
廖陳龍 周 晗 陳鴻錦 鐘文翔 張文川△
(1上海交通大學醫學院附屬第九人民醫院神經外科,上海200011;2上海交通大學醫學院附屬新華醫院神經外科,上海200092)
糖尿病周圍神經病變(diabetic peripheral neuropathy, DPN)并發的疼痛是指由糖尿病或糖尿病前期導致的周圍神經病理性疼痛,其發病機制復雜,對標準化鎮痛治療效果差,嚴重影響病人生活質量,是疼痛臨床控制的難題[1]。另有一部分DPN病人并不出現疼痛,而主要表現為感覺缺失。因此,DPN可根據臨床表現分為痛性與非痛性DPN兩類。兩者的鑒別有助于推進痛性DPN發病機制的研究,在進一步探索其高危因素的基礎上判別對相關治療敏感的潛在人群[2,3]。既往大量研究致力于比較痛性與非痛性DPN之間的區別,但無論在臨床特征(年齡、糖尿病病程、血糖水平、肥胖指標等)、基礎神經病變(感覺運動神經功能障礙、各類纖維功能和形態學改變、自主神經病變等),還是在神經微循環障礙或相關病理機制(免疫反應、炎性機制、基因易感性等)等方面,均未能明確兩者之間的差異[4,5]。因此我們推測,這可能與DPN疼痛性質的多樣性相關。作為神經病理性疼痛,DPN疼痛可表現為自發性及誘發性疼痛,后者包括痛覺過敏及痛覺超敏[6],且根據刺激因素(如壓力、針刺、溫度)的不同,可有多種分類[7],因此痛性DPN并非單一的病變,而應視為一類異質性的病變,其與非痛性DPN的區別應建立在進一步疼痛模式分類的基礎上。
鑒于機械性痛覺超敏是神經病理性疼痛的特征性表現,本研究創新性地將機械性痛覺超敏從神經病理性疼痛的諸多表現中抽提出來,通過比較機械性痛覺超敏陽性與陰性糖尿病大鼠的周圍神經纖維損害情況及相關神經元的激活模式差異,以期探索DPN機械性痛覺超敏的發生發展機制,為比較不同表型的痛性DPN提供實驗基礎及理論依據。
方 法
1.實驗動物
本實驗動物進行的研究行為均嚴格遵守相關動物保護及使用規定,并已通過上海交通大學醫學院附屬新華醫院倫理委員會批準(倫理號:XHEC-FNSFC-2018-017)。成年雄性SD大鼠(200~250 g)購自上海生命科學研究院實驗動物中心,飼養于本單位實驗動物中心。
2.分組與建模方案
根據本課題組前期建模數據及相關文獻[8,9],采用鏈脲佐菌素 (Streptozotocin, STZ, 美國Sigma)腹腔注射組(60 mg/kg)建立糖尿病模型,后者高血糖可維持4周以上,單次注射建模成功率在95%以上,單次未成功模型可在1周后追加同劑量STZ。采用隨機數字表法將大鼠隨機非平均分為4組,一組通過鏈脲佐菌素腹腔注射組(60 mg/kg)建立糖尿病模型(n= 60),一組在此基礎上結合坐骨神經乳膠管置入建立糖尿病模型(n= 20),其余2組分別作為對照組(溶媒腹腔注射及溶媒腹腔注射結合坐骨神經乳膠管置入,n= 8),見圖1。右側坐骨神經乳膠管置入法依據本課題組前期實驗方案進行[10],即于坐骨結節近端1 cm至遠端3 cm置入一段(長約1 cm)內徑與該段坐骨神經直徑相仿的長筒狀乳膠管,達到僅接觸但不壓迫坐骨神經的程度;單純注射STZ實驗組大鼠行假手術切口。分別于建模后3天、1周對各組大鼠通過尾靜脈采血檢測空腹血糖,視血糖濃度> 16.7 mmol/L為糖尿病成功建模。分別于建模后3天及后續每周檢測各組大鼠后爪機械縮足反射閾值 (mechanical withdrawal threshold, MWT)及熱縮足反射潛伏期(thermal withdrawal latency, TWL)。前者采用vonFrey纖維絲、“up and down”法檢測[10,11];后者采用熱板儀檢測:將透明有機玻璃箱將大鼠罩于熱板儀上,適應20~30分鐘后通過熱輻射光源聚焦到頂部玻璃(初始溫度維持在30℃),啟動熱板儀(升溫速度為每秒1℃)后,記錄開始照射至大鼠出現縮足、舔足的時間,重復測定3次,間隔10分鐘,取平均值記為TWL,設置每次最長輻射時間為30 s,避免灼傷大鼠足底皮膚。建模4周后,去除熱痛覺過敏陰性的大鼠,根據MWT,將2組實驗組大鼠進一步分為機械性痛覺超敏陽性(MA +)與陰性(MA -)組,各實驗亞組隨機選擇8只大鼠,處死后取材。
3.神經形態學檢查
大鼠麻醉(2%戊巴比妥鈉,50 mg/kg,腹腔注射)后,原切口暴露并截取長約1 cm的坐骨神經,分為三部分,兩部分備用形態學檢查:電鏡檢查及甲苯胺藍(美國Sigma)染色后光鏡檢查[10],另一部分備用Western blot檢測。使用Image Pro Plus軟件進行測量、分析:測量有髓和無髓神經纖維、軸突的數量和直徑,計算g比例(軸突面積/總神經纖維面積)及神經纖維密度[12]。
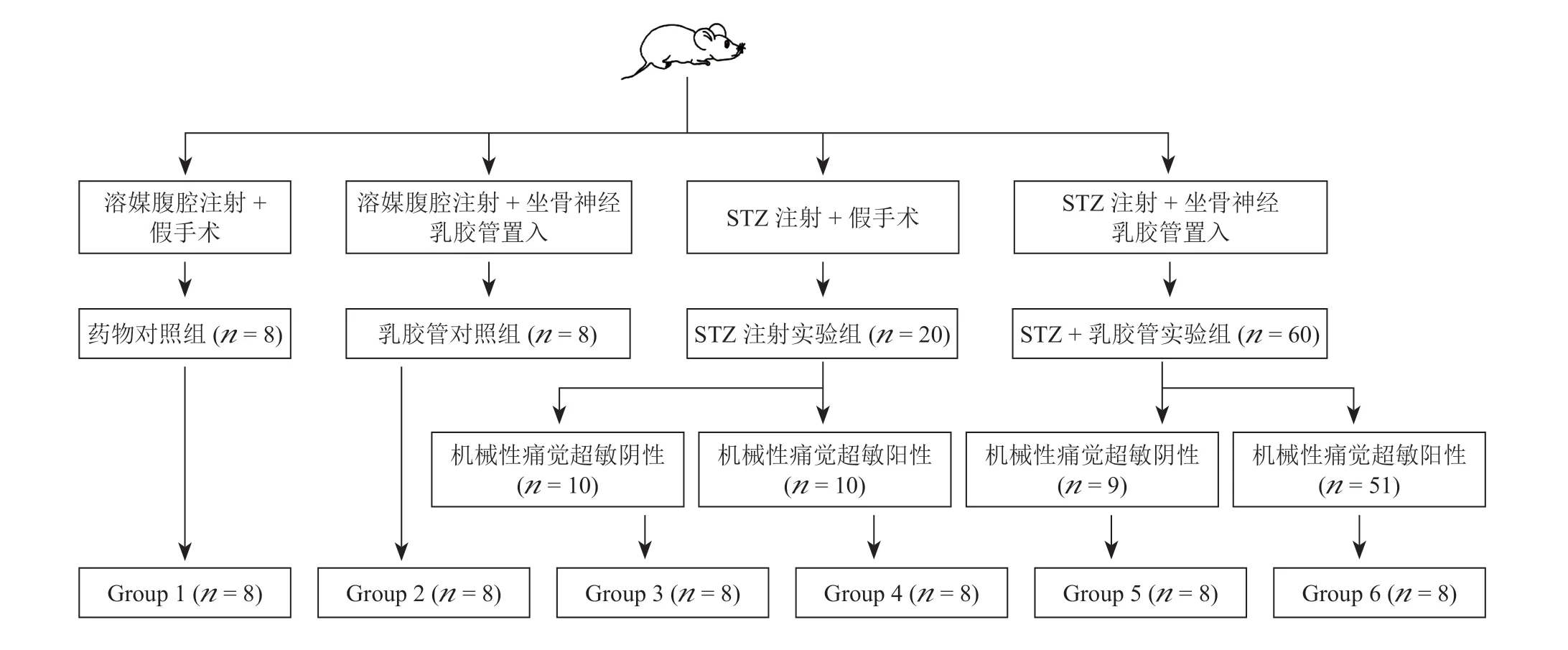
圖1 實驗動物分組及數量Fig. 1 Grouping and quantity of the rats
4. Western blot實驗
坐骨神經組織經裂解、離心、轉移上清等步驟后以BCA試劑盒(武漢谷歌生物科技有限公司)行總蛋白定量,電泳轉膜后封閉,分別添加一抗:兔抗MBP抗體(1:500,武漢博士德生物工程有限公司),小鼠抗GAPDH(1:1,0000,武漢谷歌生物科技有限公司),后添加相應二抗,化學發光試劑進行顯影,軟件分析條帶光密度值,以其相對于GADPH密度的比值進行統計分析。
5.免疫熒光及組化實驗
大鼠心臟灌注后取右側L4-6背根神經節(dorsal root ganglion, DRG)及L4-5節段的腰髓,包埋后對前者行矢狀面切片(20 μm),對后者行橫截面切片(4 μm)。DRG切片:取各組不同切片分別加入以下一抗:小鼠抗神經絲200 (NF-200)抗體(1:200,英國Abcam)和兔抗c-Fos抗體(1:2000,英國Abcam);小鼠抗降鈣素基因相關肽(CGRP)抗體(1:100,英國Abcam)和兔抗c-Fos抗體(1:2000),相應二抗:Alexa Fluor 647標記的山羊抗兔IgG(1:50,美國Jackson)和FITC標記的山羊抗小鼠IgG(1:50,美國Jackson),隨后滴加DAPI染液復染細胞核。腰髓切片:取各組切片添加一抗:兔抗c-Fos抗體(1:2000),相應二抗:生物素化羊抗兔抗體(1:200,美國Vector),洗片、孵育(ABC,1:200,美國Vector)、顯色(DAB,丹麥DAKO)。
DRG切片:倒置熒光顯微鏡觀察,Image Pro Plus軟件計數NF-200與c-Fos、CGRP與c-Fos雙標細胞及占比。
腰髓切片:光學顯微鏡下觀察,Image Pro Plus軟件計數脊髓背角中淺層(I-II)與深層(III-V)的c-Fos染色細胞。
6.統計學分析
統計學分析使用SPSS 18.0軟件,分類變量采用百分比表示,組間比較采用Pearson'sX2檢驗;連續變量(符合正態分布)采用均數±標準差(±SD)表示,組間比較采用方差分析,兩兩比較采用t檢驗,P< 0.05為差異有統計學意義。
結 果
1.一般情況和行為學
建模后3天至1周,實驗組大鼠均出現血糖升高(16.7 mmol/L),明顯高于對照組。在第4周時,STZ +乳膠管實驗組中機械性痛覺超敏陽性大鼠51只,機械性痛覺超敏陰性大鼠9只;STZ注射組中機械性痛覺超敏陽性大鼠10只,機械性痛覺超敏陰性大鼠10只。STZ +乳膠管實驗組機械性痛覺超敏的發生率(51/60)顯著大于單純STZ注射組(10/20,Pearson'sX2= 10.147,P< 0.05)。兩實驗組中機械性痛覺超敏陽性組的平均MWT值均顯著低于機械性痛覺超敏陰性組及相應對照組(P< 0.05),后兩者的平均MWT值均未見明顯差異(見圖2A);各實驗亞組的平均TWL值均低于相應對照組(P< 0.05),且各實驗亞組間未見明顯差異(見圖2B)。
2. 坐骨神經MBP定量
如圖2C, D所示,各實驗亞組均較對照組出現顯著的MBP表達水平升高(P< 0.05);各實驗組中,機械性痛覺超敏陽性組的MBP表達量較陰性組顯著升高(P< 0.05)。
3. 神經形態學
如圖3所示,各實驗組均出現不同程度的神經脫髓鞘病變及變性變化。神經纖維形態測定結果如表1所示,各實驗亞組的有髓纖維g比例較相應對照組顯著升高(P< 0.05),而有髓神經纖維區域及密度均較相應對照組減少(P< 0.05)。在各實驗組中,機械性痛覺超敏陽性組的有髓纖維g比例較相應陰性組顯著升高(P< 0.05),而有髓神經纖維區域及密度均較相應陰性組減少(P< 0.05)。神經形態學觀察和神經形態測定結果均顯示各實驗組中存在無髓纖維的變性,與相應對照組對比,各實驗組出現顯著的無髓神經纖維區域及密度的減少(P< 0.05),但機械性痛覺超敏陽性組與陰性組未見顯著性差異。

圖2 第4周各組大鼠疼痛行為學結果及各組大鼠坐骨神經MBP的表達(A)后爪機械縮足反射閾值結果;(B)后爪熱縮足反射潛伏期結果;(C, D)采用蛋白質免疫印跡實驗檢測各組大鼠坐骨神經MBP的表達情況;(C)電泳結果;(D)相對表達量統計結果。*P < 0.05,與1組相比;#P < 0.05,與2組相比;△ P < 0.05,與3組相比;?P < 0.05,與5組相比。Fig. 2 Nociceptive behavioral results and the expression of myelin basic protein (MBP) in sciatic nerve of each group at the 4th week(A) The mechanical withdrawal threshold; (B) The thermal withdrawal latency; (C, D) Western blot analysis of the expression of myelin basic protein (MBP) in sciatic nerve; (C) Electrophoresis bands; (D) Standardized MBP expression.*P < 0.05, compared with group 1; #P < 0.05, compared with group 2; △P < 0.05, compared with group 3; ?P < 0.05, compared with group 5.
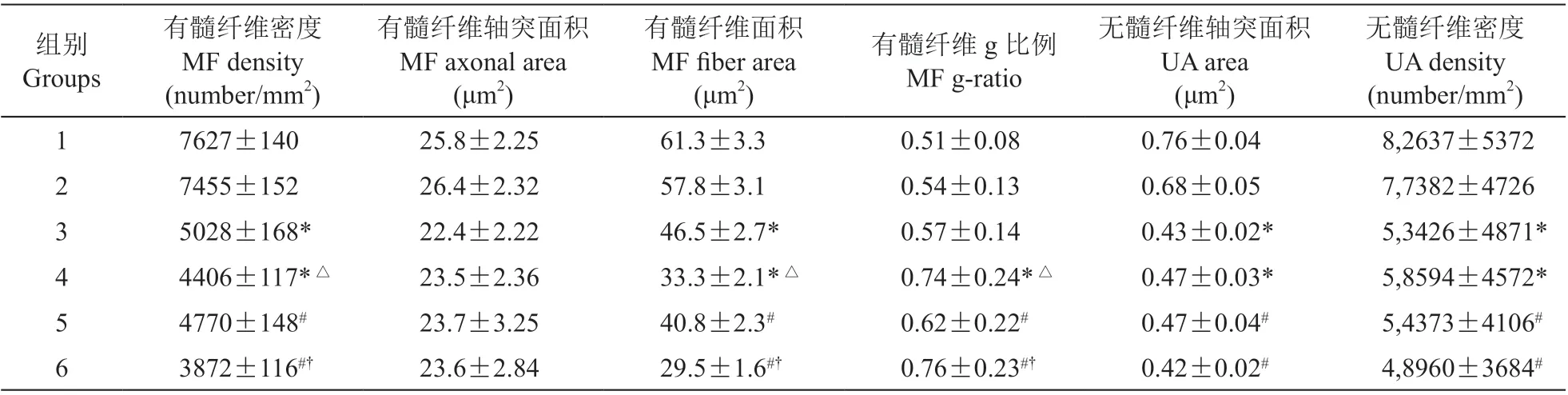
表1 各組周圍神經纖維的形態計數學數據Table 1 Morphometric data of peripheral nerve fibers in all groups.

圖3 電鏡下觀察各組大鼠坐骨神經(A-F)依次表示第1~6組。與兩組對照組(A, B)相比,各組實驗組(C-F)可見不同程度的脫髓鞘和神經變性病變。機械性痛覺超敏陽性組(D, F)比陰性組(C, E)出現更為顯著的脫髓鞘病變,髓鞘板層出現明顯紊亂、斷裂、腫脹。粗箭頭表示有髓纖維,細箭頭表示無髓纖維。比例尺= 2微米Fig. 3 Electron micrographs of sciatic nerve in each group(A-F) Showed groups 1-6 in turn. The morphologies of sciatic nerves in two control groups (A, B) were almost intact and normal. Abnormal morphological structures of both myelinated (arrow head) and unmyelinated fibers (thin arrow),presenting as dense and collapse configuration and different degree of myelin impairments, could be noted in the experimental subgroups (C-F). More serious demyelination were found in MA + groups (D, F) than in MA-groups (C, E),accompanied by disorder, edema and disarray of myelin sheath. Scale bar = 2 μm
4. DRG神經元激活
如圖4所示,與相應對照組相比,實驗組中DRG內激活(c-Fos標記)的NF-200及CGRP陽性神經元數量均顯著增多(P< 0.05)。在兩對實驗組中,機械性痛覺超敏陽性組DRG內激活(c-Fos標記)的NF-200陽性神經元數量較陰性組顯著增多(P< 0.05,見圖4A, C),而DRG內激活(c-Fos標記)的CGRP陽性神經元數量在機械性痛覺超敏陽性組與陰性組之間未見明顯差異(見圖4B, C)。
5.脊髓背角神經元激活
如圖5A-F所示,與相應對照組相比,實驗組中脊髓背角淺表(I-II)、較深(III-V)板層內激活(c-Fos標記)的神經元數量較相應對照組顯著增多(P<0.05)。在兩對實驗組中,機械性痛覺超敏陽性組脊髓背角內激活(c-Fos標記)的神經元數量較陰性組顯著增多(P< 0.05,見圖5G)。
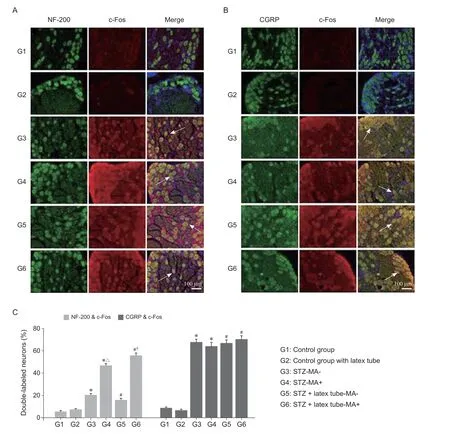
圖4 采用免疫熒光實驗分別檢測各組大鼠DRG內c-Fos與NF-200或CGRP共表達情況(A)各組DRG內NF-200與c-Fos共染情況,可見各實驗組中存在不同數量的NF-200與c-Fos共染神經元(白色箭頭),以第4、6組居多;(B)各組DRG內CGRP與c-Fos共染情況,可見各實驗組中存在不同數量的NF-200與CGRP共染神經元(白色箭頭);(C)雙染神經元統計結果。比例尺= 100微米*P < 0.05,與1組相比;#P < 0.05,與2組相比;△ P < 0.05,與3組相比;?P < 0.05,與5組相比。Fig. 4 Co-expression of c-Fos and NF-200 or CGRP in DRG by immunofluorescence double staining(A) In two control groups, almost no immunofluorescent labeling of c-Fos protein was noted in NF-200+ DRG neurons. In contrast, the immunofluorescent labeling of c-Fos protein could be seen in NF-200+ DRG neurons of the other four experimental groups, and more double labeled neurons were observed in MA + groups (group 4 and 6) than in MA- groups (group 3 and 5); (B) In the two control groups, there was almost no immunofluorescence labeling of c-Fos protein in CGRP+ DRG neurons, while in the other four experimental subgroups, there was a large number of immunofluorescence labeling of c-Fos protein in CGRP+ DRG neurons; (C) Statistical results of immunofluorescence double stained neurons. Scale bar = 100 μm*P < 0.05, compared with group 1; #P < 0.05, compared with group 2; △ P < 0.05, compared with group 3; ?P < 0.05, compared with group 5.
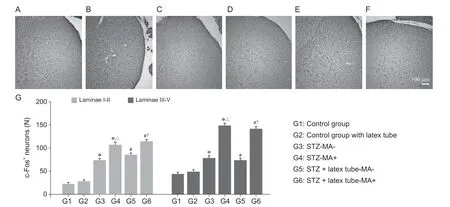
圖5 采用免疫組化實驗檢測各組大鼠脊髓背角淺表板層(I-II)及較深板層(III-V)內c-Fos陽性神經元(A-F)依次表示第1~6組。與對照組(A, B)相比,各實驗組(C-F)的淺表、較深板層內均存在不同數量的c-Fos陽性神經元,以第4、6組(D, E)居多;(G)各組大鼠脊髓背角淺表、較深板層內c-Fos陽性神經元數量統計結果。比例尺= 100 微米*P < 0.05,與1組相比;#P < 0.05,與2組相比;△ P < 0.05,與3組相比;?P < 0.05,與5組相比。Fig. 5 c-Fos positive neurons in the superficial lamina (I-II) and deeper lamina (III-V) of spinal DH were detected by immunohistochemistry(A-F) showed groups 1-6 in turn. When compared with the control groups (A, B), various c-Fos positive neurons could be noted in both superficial and deeper laminae in all experimental groups (C-F), with larger number of c-Fos positive neurons in group 4 and group 6 (D, E); (G) Statistical results of the number of c-Fos positive neurons in the superficial and deeper layers of spinal DH in each group. Scale bar = 100 μm*P < 0.05, compared with group 1; #P < 0.05, compared with group 2; △ P < 0.05, compared with group 3; ?P < 0.05, compared with group 5.
討 論
糖尿病可導致周圍神經因腫脹而易受解剖狹窄的卡壓性損害,后者很大程度取決于神經腫脹程度及其與解剖狹窄的匹配情況[13,14],因此本研究采用既往報道的糖尿病大鼠神經卡壓模型,通過在糖尿病大鼠周圍神經行等管徑的乳膠管置入來提高神經卡壓的發生率[8],因乳膠管內徑與坐骨神經相仿,初始置入時并不壓迫神經,僅神經在高糖狀態下發生腫脹后才出現受壓,本研究發現與傳統STZ誘導的DPN模型相比,神經壓迫因素與DPN大鼠機械性痛覺超敏的發生率呈正相關。
MBP是中樞和周圍神經系統髓鞘的重要組成部分,是檢測脫髓鞘病變的重要指標之一[15],因此通過MBP的定量研究(見圖2C, D),我們明確了機械性痛覺超敏陽性組比陰性組大鼠出現更為嚴重的周圍神經脫髓鞘病變。且神經形態計數學結果也顯示,機械性痛覺超敏陽性組比陰性組出現更為顯著的有髓纖維損害(見表1),既往研究已證實有髓神經纖維比無髓神經纖維更容易受到機械壓迫性損傷[16,17],因此,綜合本研究發現,DPN機械性痛覺超敏與有髓神經纖維的壓迫性損害密切相關。這也為臨床上采用神經減壓術可有效緩解疼痛,尤其是機械性痛覺超敏提供理論和實驗依據[18]。
本研究進一步利用可顯示神經元激活狀態的c-Fos蛋白對機械性痛覺超敏陽性與陰性組大鼠進行DRG及脊髓背角神經元激活狀態的對比研究,結合本研究所采用的疼痛行為學檢查,分別采用NF-200和CGRP標記有髓纖維和肽能無髓纖維及其相關神經元,前者傳導粗觸覺傳入,大部分投射至脊髓背角較深部板層(III-V);后者傳導痛溫覺傳入,投射至脊髓背角淺表板層(I-II)。通過DRG的免疫熒光雙標實驗,發現機械性痛覺超敏與DRG內有髓神經纖維相關神經元(NF-200陽性)的激活密切相關(見圖5A, C),而后者已被證實可由周圍神經的脫髓鞘病變導致,其機制包括DRG神經元表型的改變(包括肽類及離子通道的表達變化等)、神經元的高興奮性及異位沖動傳導,這些改變通常伴有初級傳入纖維的異常自發性電活動及脊髓背角水平的中樞重塑變化[19]。因此,結合以上研究結果,我們推測有髓神經纖維的損害(脫髓鞘病變)可通過以上途徑導致DRG內相關神經元的激活,易化有髓纖維介導的非傷害性刺激(粗觸覺)的傳入,后者在某些病理狀態下(如糖尿病)可被感知為傷害性感受,即表現為機械性痛覺超敏。雖然也存在不同的觀點認為機械性痛覺超敏是由于外周神經損傷后有髓神經纖維傳入信號減少引起,但有髓神經纖維受到易化后傳入增強引起機械性痛覺超敏這一結論也得到了電生理研究的驗證和支持[20]。Xu等在一項體內研究通過阻斷有髓Aβ纖維成功抑制神經病理性疼痛中的機械性痛覺超敏的發生[21],也支持了這一觀點。
本研究在證實糖尿病大鼠脊髓背角神經元激活的基礎上[22,23],進一步發現機械性痛覺超敏陽性組大鼠的脊髓背角淺表(I-II)、較深(III-V)板層的激活神經元數量較陰性組顯著增多,提示脊髓背角的神經元激活數量與機械性痛覺超敏的發生發展密切相關,該結果也支持了上述有髓神經纖維傳入增強導致機械性痛覺超敏的論點。且根據疼痛門控理論,Aβ纖維與脊髓背角淺表板層(I-II)傷害性知覺感受區之間存在投射關系,而在高糖環境的病理作用下,Aβ纖維在生理狀態下受到脊髓背角中間神經元的抑制作用被解除(去抑制效應),使得其介導的非傷害性觸覺刺激由脊髓背角較深板層(III-V)傳入淺表板層(I-II),引起傷害性感受[24]。結合該理論,本研究的結果也驗證了脊髓背角的中樞重塑變化在機械性痛覺超敏發生發展中的作用。因此,本研究在周圍神經(神經纖維、DRG)及中樞(脊髓背角)水平明確了機械性痛覺超敏陽性與陰性的差異。
除了機械性痛覺超敏,本研究觀察到大部分糖尿病大鼠出現熱痛覺過敏,相應地發現糖尿病周圍神經普遍存在無髓纖維的退變(見圖3和表1),DRG內無髓纖維相關的CGRP陽性神經元普遍受到激活,且在機械性痛覺超敏陽性與陰性組之間未見明顯差異(見圖4B, C),結合無髓纖維容易受到糖尿病炎性因素損害的特點[17,25],可認為無髓纖維的損害及DRG內CGRP陽性神經元的激活與糖尿病熱痛覺過敏的發生發展關系密切。
本研究通過將DPN疼痛癥狀進一步分類,在周圍神經系統和脊髓中樞水平發現機械性痛覺超敏陽性與陰性的糖尿病大鼠之間的差異,證實DPN神經病理性疼痛一類異質性的病變,為今后不同表型的痛性DPN的比較研究提供理論依據及思路。

