柚皮苷對Aβ25-35 誘導PC12 細胞保護作用的代謝組學研究
張 悅徐占玲孫慧峰雷 霞劉國良姚 遠張 寧*劉 斌*
(1.黑龍江中醫藥大學藥學院,黑龍江 哈爾濱 150040;2.黑龍江中醫藥大學佳木斯學院,黑龍江佳木斯 154007)
阿爾茨海默病(Alzheimer disease,AD)是一種與衰老密切相關的神經系統退行性疾病[1],以認知缺陷和神經元喪失為特征,迄今缺少有效的治療藥物。所以,研發有效防治AD 的藥物是非常必要的。
AD 發病機制十分復雜,β 淀粉樣蛋白(amyloid-β,Aβ)被認為是誘發AD 發生發展的關鍵因素[2]。近年來,黃酮類等天然多酚類物質的抗氧化特性在對神經退行性疾病方面潛在、有益的作用成為科學研究的重點[3]。柚皮苷全稱為柚皮素-7-O-新橙皮糖苷,是一種天然的二氫黃酮類化合物,以往對柚皮苷的研究大都集中在治療骨質疏松[4]、預防動脈粥樣硬化[5]等方面。現在,研究人員將注意力轉向柚皮苷的神經損傷保護等方面。Okuyama 等[6]將富含橙皮苷和柚皮苷果汁的干燥粉末給予腦缺血小鼠,發現口服后可以顯著抑制腦缺血誘導的海馬神經細胞死亡,具有改善小膠質細胞活化的能力。Singh 等[7]灌胃給予腦出血小鼠不同劑量的柚皮苷,再對探討動物進行一系列行為測試,用強迫游泳試驗和水迷宮試驗評估卒中后抑郁和記憶障礙,研究表明,柚皮苷可改善腦出血誘導的神經認知缺陷,還能通過下調海馬中乙酰基膽堿酯酶活性和誘導型一氧化氮合酶(iNOS)信號傳導途徑來消除順鉑引起的認知缺陷和膽堿能功能障礙[8]。由此可見,柚皮苷可能會成為治療神經退行性疾病的佼佼者,但作用機制尚不清楚。
代謝組學以代謝產物或代謝網絡為基礎探究常見復雜疾病的發病機制或宿主環境發病機制的相互影響,在臨床前和臨床研究上都有廣泛的應用[9]。代謝體是基因-環境相互作用的最終產物之一,它能識別并鑒別AD 的病理生理特征[10]。氣相色譜-質譜(GC-MS)具有高分辨率、高靈敏度、有可供參考的標準圖譜庫、可對代謝產物定性等特點,已經成為代謝組學實驗室的重要組成部分。
本研究首先采用Aβ25-35誘導PC12 細胞建立細胞損傷模型,將柚皮苷作用于損傷模型,利用GC-MS 技術對細胞進行代謝組學研究,檢測并解析給予柚皮苷后Aβ25-35誘導PC12 細胞內小分子代謝物及相關分子通路的變化,為AD病理機制研究提供實驗數據和理論依據。
1 材料
1.1 試劑與藥物 柚皮苷(純度98%,批號LL60O53)購自北京百靈威科技股份有限公司。PC12 細胞(北京協和細胞資源中心);Aβ25-35(北京博奧森生物技術有限公司);DMEM 高糖培養基、雙抗、活性炭-葡聚糖苷處理的胎牛血清(美國HyClone 公司);二甲基亞砜(DMSO)、噻唑藍(MTT)購于美國Sigma 公司;磷酸鹽緩沖液(PBS)購于北京索萊寶科技有限公司。
1.2 儀器 Agilent 6890N 型氣相色譜儀、Agilent 5975B 型質譜儀、DB-5MS 彈性石英毛細管柱(30 m×0.25 mm,0.25 μm)(美國安捷倫公司);MK3 型酶標儀(上海熱電儀器有限公司);IX-71-21PH 型倒置顯微鏡(日本Olympus 公司);HF90 型二氧化碳培養箱(上海立新儀器有限公司)。
2 方法
2.1 細胞實驗
2.1.1 細胞培養 PC12 細胞(大鼠腎上腺嗜鉻細胞瘤細胞)在含10% 胎牛血清、100 U/mL 青霉素、100 μg/mL鏈霉素的DMEM 培養液中生長,37 ℃下通入5%的CO2進行培養,每2~3 d 傳代1 次,取對數生長期細胞用于實驗。
2.1.2 MTT 法測定細胞活力 將細胞分為空白組(加入含10%胎牛血清的DMEM 培養液)、Aβ25-35模型組(分別用10、20、40 μmol/L 的Aβ25-35處理PC12 細胞24 h)、給藥組(分別先給予柚皮苷1.0×10-3、1.0×10-2、1.0×10-1μmol/L處理2 h 后,再加入20 μmol/L Aβ25-35孵育24 h),每組6 個平行。
取對數生長的PC12 細胞,消化離心,棄掉上清,沉淀用DMEM 完全培養基重懸至均勻懸液,以2×104/mL 細胞濃度接種于96 孔培養板,放進細胞培養箱中培養約24 h,細胞進入對數期后吸棄舊的培養液,按照分組狀況加入相應溶液(200 μL)孵育24 h 后加入MTT 溶液,每孔20 μL,在細胞培養箱中再孵育4 h,取出,吸棄上清,每孔加入150 μL DMSO,在37 ℃恒溫振蕩器中振蕩10 min,充分溶解藍紫色甲臜結晶,用酶標儀在570 nm 波長下進行吸光度檢測,每個樣本3 次,取平均值。細胞增殖率=(OD實驗組/OD空白組)×100%。
2.1.3 統計學分析 以AIA 格式文件收集獲得的原始數據,用MZmine 2.5 軟件進行前處理,之后導入SIMCA-P軟件中進行PCA 和PLS-DA 分析統計,VIP 預測以及SPSS19.0 軟件做t 檢驗,篩選出潛在的代謝標記物。PC12細胞吸光度值及增值率結果用SPSS 19.0 軟件統計。數據以()表示,多組間比較使用單因素方差分析,組間均數兩兩比較使用LSD 檢驗,S-N-K 法進行統計后校正,P<0.05表示差異有統計學意義。
2.2 GC-MS 分析
2.2.1 GC-MS 條件 色譜條件為DB-5Ms 彈性石英毛細管柱(30 m×0.25 mm,0.5 μm);進樣時溫度270 ℃;以高純氦氣為載氣;載氣體積流量1.0 mL/min,溶劑延遲3 min;分流采樣5∶1;進樣1 μL。質譜條件為四級桿溫度150 ℃;電離方式EI;離子源溫度230 ℃;電子能量70 eV;質量掃描方式全掃描,掃描間隔0.2 s;電子倍增器電壓0.90 kV。細胞樣品梯度加熱程序為初始溫度70 ℃,運行3 min,以10 ℃/min 升至180 ℃,5 ℃/min 升至290 ℃,運行9 min。
2.2.2 細胞提取及衍生方法 取成對數生長期細胞,丟棄舊DMEM 完全培養基,用生理鹽水洗滌3 次,棄去生理鹽水,液氮淬滅,加入1.5 mL 乙腈-水(4∶1),用細胞刮刀刮下細胞,將細胞懸浮液轉移到離心管中,渦旋,細胞經超聲細胞破碎儀破碎(功率為20%,工作2 s,間歇2 s)7 min,4 ℃、4 000 r/min 離心15 min,去除蛋白等大分子物質。取1.2 mL 上清液置于離心管中,在40 ℃下氮吹,殘余物用50 μL 甲氧胺鹽酸鹽(15 mg/mL)復溶,渦旋,30 ℃水加熱90 min,37 ℃下加入70 μL MSTFA,持續30 min,取上清進行GC-MS 分析。
2.2.3 分組 空白組為PC12 細胞培養于新鮮的DMEM 完全培養基,不加Aβ;模型組為20 μmol/L Aβ25-35孵育PC12細胞24 h;給藥組為1.0×10-1μmol/L 柚皮苷孵育PC12 細胞2 h 后,加入20 μmol/L Aβ25-35后再孵育24 h。
2.2.4 數據提取 GC-MS 得到的原始數據利用自動質譜去卷積鑒定(AMDIS)系統以AIA 的格式導出文件,將其導入Matlab 軟件,得到有代謝物保留時間和相應峰面積組成信息的峰表。
2.2.5 模式識別與差異表達代謝物鑒定 將獲得的峰表導入SIMCA-P 12.0 軟件,進行主成分分析(PCA)和最小二乘法判別分析(PLS-DA),找到差異表達代謝物。再利用NIST 質譜數據庫對空白組和模型組共有的內源性代謝物作鑒定,以匹配度>70% 為衡量標準,得到可信的差異代謝物的結構和名稱。
3 結果
3.1 細胞增殖率測定 與空白組比較,20 μmol/L Aβ25-35作用于細胞24 h 后細胞增殖率下降(P<0.01),并且增殖率隨著Aβ25-35終濃度的增加而減小,說明造模成功。根據實驗結果結合文獻[11],最后選用20 μmol/L Aβ25-35作用PC12 細胞24 h 來制備AD 的體外細胞模型。見表1。
表1 不同濃度的Aβ25-35處理24 h 對PC12 細胞增殖率的影響(,n=6)
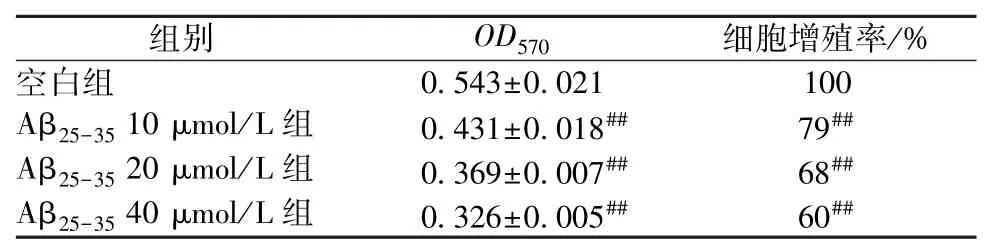
表1 不同濃度的Aβ25-35處理24 h 對PC12 細胞增殖率的影響(,n=6)
注:與空白組比較,##P<0.01。
由表2 可以看出,與Aβ25-35模型組比較,柚皮苷處理后PC12 細胞增殖率增加(P<0.01),說明柚皮苷能夠保護細胞,起到抗Aβ 損傷的作用。
表2 柚皮苷對Aβ25-35損傷PC12 細胞增殖率的影響(,n=6)
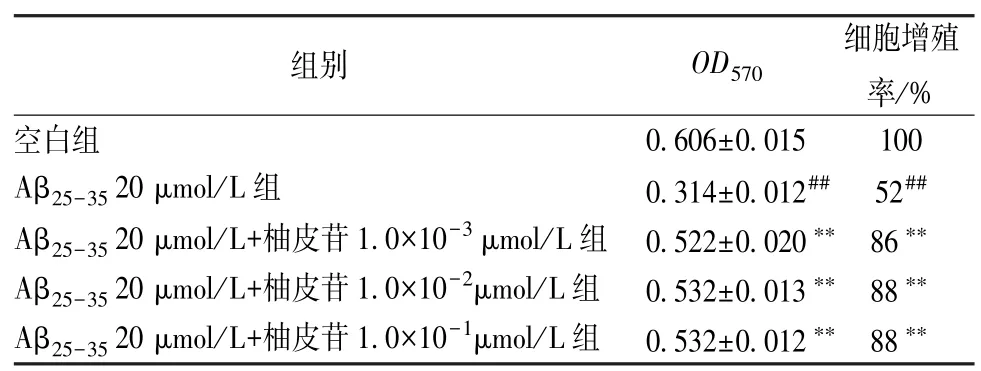
表2 柚皮苷對Aβ25-35損傷PC12 細胞增殖率的影響(,n=6)
注:與空白組比較,##P<0.01;與Aβ25-35 20 μmol/L 組比較,**P<0.01。
3.2 GC-MS 分析 利用GC-MS 法對樣品進行掃描,得到細胞代謝樣本的總離子流圖,見圖1。根據各個化合物的質荷比、保留時間、保留指數等進行鑒定,共鑒定出152個化合物,包括氨基酸類、脂肪酸類、糖類等小分子成分。
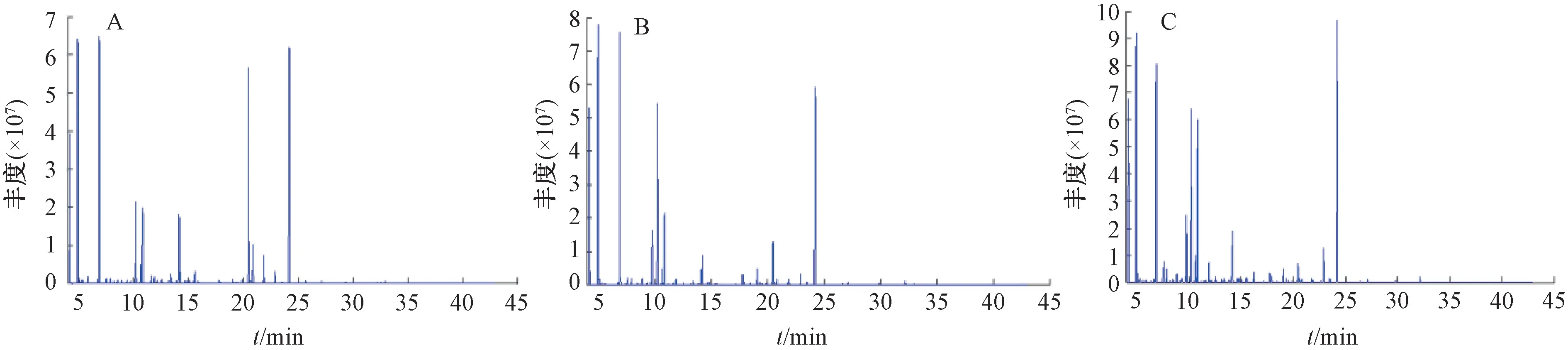
圖1 PC12 細胞代謝物的GC-MS 基峰色譜圖
4 討論
PCA 分析顯示,各組樣品之間有較好的分離度,說明模型組使細胞代謝通路發生改變,即造模成功,通過三維PLS-DA 示意圖進一步地證明了各組之間分離度良好。選取VIP 值>1.0 且P<0.05 的物質,然后對照質譜庫信息獲得27 個潛在生物標記物,并對化合物含量變化進行了分析,見表3。
表3 潛在生物標記物信息()
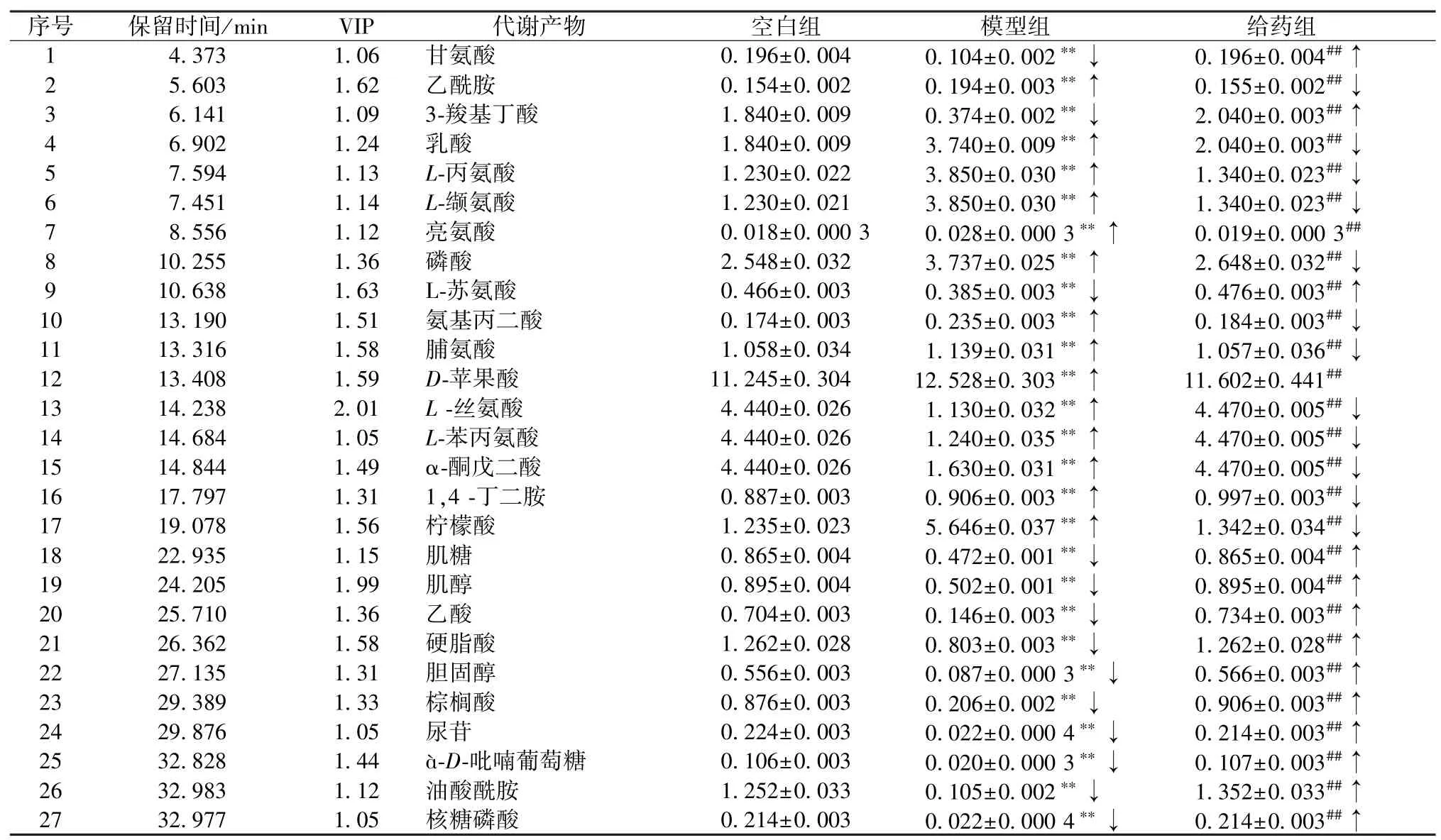
表3 潛在生物標記物信息()
注:↓表示下降,↑表示升高。與空白組比較,**P<0.01;與模型組比較,##P<0.01。
表3 顯示,模型組中氨基酸代謝途徑發生了變化,包括谷氨酸、絲氨酸、苯丙氨酸等。谷氨酸是神經遞質GABA 合成的前體,也是人類中樞神經系統中最豐富的興奮性神經遞質,從突觸囊泡釋放后將結合NMDA 受體激活細胞[12];丙氨酸由丙氨酸轉氨酶胺化而成,涉及丙氨酸、丙酮酸、α-酮戊二酸的相互轉化[13];谷氨酸和丙氨酸參與細胞生物能量學,模型組丙氨酸水平較低,表明模型組存在能量缺乏和線粒體功能障礙[14]。以絲氨酸為原料合成甘氨酸和半胱氨酸,前者是一種神經系統抑制性神經遞質,本研究中其含量發生了變化。以往發現在AD 大鼠模型中,海馬、頂葉皮層D-絲氨酸水平升高[15];L-絲氨酸水平也有所上升;絲氨酸消旋酶產生L-絲氨酸,后者水平降低;苯丙氨酸是芳香族氨基酸神經遞質,其改變在癡呆過程中起著關鍵作用[16],表明模型組細胞內氨基酸代謝紊亂。
高度不飽和脂肪酸可以引起脂質過氧化,促進神經毒性的產生。參與脂質代謝的差異代謝物有棕櫚酸、硬脂酸、蘋果酸和膽固醇,模型組細胞內棕櫚酸、硬脂酸及膽固醇減少,蘋果酸增加,柚皮苷可以使這些代謝物的含量恢復到空白組水平。APP/PS1 小鼠組織中磷脂含量明顯下降,這與磷脂酶活性增加有關[17]。硬脂酸是磷脂形成的最豐富的脂肪酸,脂肪代謝異常會導致細胞膜的功能異常。在以往對AD 患者血液的研究中,發現患者的棕櫚酸明顯低于正常組[18],這與本實驗結果一致。有研究表明膽固醇異常與AD 發病有關,用T0901317 激活APP/PS1 小鼠腦內的肝X 受體,能使額葉皮層和海馬腦區膜膽固醇明顯降低,減少老年斑的沉積,改善小鼠記憶能力[19],除了脂質代謝發生變化還有許多與能量相關的代謝產物也發生了變化。
葡萄糖代謝、磷酸肌醇代謝與碳水化合物代謝有著密切的聯系,葡萄糖代謝異常是AD 典型病理特征[20]。本研究中與糖代謝相關的代謝物有檸檬酸、α-D-吡喃葡萄糖等,模型組à-D-吡喃葡萄糖和檸檬酸的含有量發生了變化,葡萄糖代謝出現異常。肌醇參與多種細胞功能,如信號傳導過程、細胞生長和分化等[21],還是一種重要的膜成分,其腦衍生物參與突觸轉運和神經遞質分泌,并調節自噬[22]。模型組中肌醇含量發生改變,說明碳水化合物代謝異常。
綜上所述,本研究以GC-MS 代謝組學為理論依據,對空白組、模型組和給藥組代謝物進行多元統計分析,篩選出可能的生物標志物。Aβ25-35損傷組有多種代謝產物的含量發生了改變,這些物質主要與氨基酸代謝、碳水化合物代謝及脂質代謝等相關聯,說明柚皮苷主要通過影響多種氨基酸和能量代謝發揮對Aβ25-35損傷的PC12 細胞的保護作用。

