威寧雞GnRH1、GnRH2 基因SNPs 鑒定及其與蛋品質性狀的關聯研究
歐茂均,王天松,張 勇,張習本*,郭徵力,曾姍姍,李未博,陳澤林,葉紅英,張林達
(1.畢節市畜牧獸醫科學研究所,貴州畢節 551700;2.貴州大學高原山地動物遺傳育種與繁殖教育部重點實驗室,貴州大學動物科學學院,貴州省動物遺傳育種與繁殖重點實驗室,貴州貴陽 550025)
促性腺激素釋放激素(Gonadotropin Releasing Hormone,GnRH)是脊椎動物下丘腦-垂體-性腺軸(HPG)的關鍵信號分子,是一種保守的神經肽。GnRH 通過刺激促性腺激素釋放激素腦垂體前葉激素釋放激素的釋放來維持生殖功能,同時還以自分泌和旁分泌的方式作用于垂體外組織,在脊椎動物性腺的發育和生殖功能維持中起著重要作用。哺乳動物GnRH在20 世紀70 年代首次從豬和綿羊中鑒定出來,具有刺激垂體性腺細胞釋放促黃體素(Luteinizing hormone,LH)和促卵泡素(Follicle-Stimulating Hormone,FSH)的作用[1-3]。GnRH在脊椎動物中具有多種亞型,即GnRH1、GnRH2和GnRH3,而GnRH3基因很可能已在四足動物基因庫中丟失[4]。GnRH1 是由下丘腦神經元產生的一種十肽,以脈動的方式分泌到垂體門脈毛細血管,到達垂體前葉。GnRH1基因在鼠和人中進化上保守的調控元件包括3 個增強子和近端啟動子,研究表明誘導GnRH1啟動子的活性對GnRH神經元成熟過程中激活或抑制GnRH1的轉錄起關鍵作用[5]。GnRH2 是一種7 跨膜G 蛋白偶聯受體,與αQ/11 相互作用介導細胞信號。研究發現GnRH2可通過增加A 型精子數量來促進原始精子細胞發生精原細胞、精子和睪酮釋放[6-7]。目前許多學者利用組織定位以及RT-PCR、qPCR 等手段初步斷定GnRH具有神經調節、控制繁殖行為和影響感觀系統等功能,并在組織中廣泛表達[8-11]。GnRH1、GnRH2已被證明可以影響動物的卵巢發育、睪丸等生殖器官的功能[12-13],目前GnRH1、GnRH2基因功能研究報道在魚類上較多,在家禽上研究很少,其SNPs 對雞的產蛋性狀是否有影響需進行深入研究。鑒于GnRH1、GnRH2基因在家禽性腺軸上的關鍵作用,本實驗以威寧雞為研究對象,采用直接測序技術篩選其SNPs 位點,探究威寧雞GnRH1、GnRH2基因SNPs 與蛋品質的相關性,旨在為進一步研究GnRH1、GnRH2調控禽類生殖發育和繁殖的分子機制提供參考。
1 材料與方法
1.1 實驗材料
1.1.1 樣品采集 實驗選取300 日齡、體重相近(1 954±282 g)、健康的威寧雞母雞200 只于翅下靜脈采集血樣及對應雞蛋,樣品均采自貴州納雍源生牧業股份有限公司。
1.1.2 主要試劑及儀器 DNA 提取試劑盒(生工生物工程(上海)股份有限公司)、DM2000-Marker、2×Taq Master Mixture(北京擎科生物科技有限公司)。紫外分光光度計(NanoDrop 2000),購自美國Thermo 公司。蛋殼強度測定儀(型號為EFR-01)購自北京天翔飛域儀器設備有限公司;凝膠成像儀(BioSens SC 710)購自上海山富科技儀器有限公司;PCR 儀(BIO-RAD C1000 TouchTM Thermal Cy-cler)購自美國BIO-RAD公司;蛋品質分析儀(型號為EA-01)購自北京天翔飛域儀器設備有限公司;電泳儀(PowerPacTM HV Power Supply)。
1.2 實驗方法
1.2.1 DNA 提取與引物設計 200 只雞血液DNA 用Ezup 柱式動物基因組DNA 提取試劑盒提取,測定DNA 濃度后用1.2% 瓊脂糖凝膠電泳檢測其完整性。根據GenBank 上提供的雞GnRH1、GnRH2基因序列(登錄號:NC_006109.5、NC_006091.5),用Primer 3 Input 在線設計軟件分別設計GnRH1、GnRH2基因部分外顯子及內含子引物,送生工生物工程(上海)股份有限公司合成,引物序列見表1。

表1 GnRH1、GnRH2 基因引物序列
1.2.2 PCR 擴增及擴增產物測序 PCR 擴增程序為:95℃預變性5 min;95℃變性30 s,退火30 s,72℃延伸30 s,共35 個循環;72℃終延伸7 min。30 μL PCR擴增體系:DNA 模板1 μL,上、下游引物(10 μmol/L)各1 μL,15 μL 2×Es Taq Master Mix,12 μL RNase-Free Water。PCR 擴增產物經1.0% 瓊脂糖凝膠電泳進行檢測合格后,挑選特異性好的PCR 產物送生工生物工程(上海)股份有限公司測序。
1.2.3 蛋品質檢測 蛋重(g):蛋品質分析儀進行稱重。
蛋形指數:用游標卡尺測量雞蛋的長脛和短脛,長脛和短脛之比即為蛋形指數。
蛋殼厚度(mm):去除蛋殼內膜,用游標卡尺測量蛋殼鈍端、中端、銳端的蛋殼厚度,求平均值。
蛋白高度(mm):測量蛋黃邊緣與濃蛋白邊緣中點的濃蛋白高度,測量成正三角形的三個點,取均值。
蛋殼強度(Pa):將蛋垂直放在蛋殼強度測定儀上,鈍端向上,測定蛋殼表面單位面積上承受的壓力。
哈氏單位:根據蛋重和蛋白高度,由公式HU=100log(H-1.7M0.37+7.60)計算哈氏單位,其中HU 表示哈氏單位,M 表示蛋重(g),H 表示蛋白高度(mm)。
蛋黃重(g):將蛋清和蛋黃分離,濾紙吸干蛋黃表面的蛋清并去除系帶等其他物質,用分析天平稱取蛋黃重。
1.3 統計分析 用Megalign、BioEdit 和Seqman 等生物軟件對序列進行比對拼接、確定SNPs 位點,并計算等位基因頻率、基因型頻率、有效等位基因數(Ne)、遺傳雜合度(He)、Hard-weiberg 平衡(χ2)和多態信息含量(PIC)。用Microsoft Excel 2010 進行數據初處理,SPSS 22.0 中一般線性模型對基因型與蛋品質指標進行關聯性分析,模型為Y=μ+G+e,其中,Y 為性狀觀測值,μ 為群體均值;G 為基因型效應或雙倍型效應,e 為隨機殘差。
2 結果與分析
2.1GnRH1、GnRH2基因的PCR 擴增 威寧雞基因組DNA 的OD 值(OD260/280)經檢測在1.8~1.9,表明DNA 純度高。PCR 擴增結果如圖1 所示,目的片段條帶單一明亮,且PCR 擴增產物與預設片段大小相符,擴增產物可用于下一步的實驗研究。
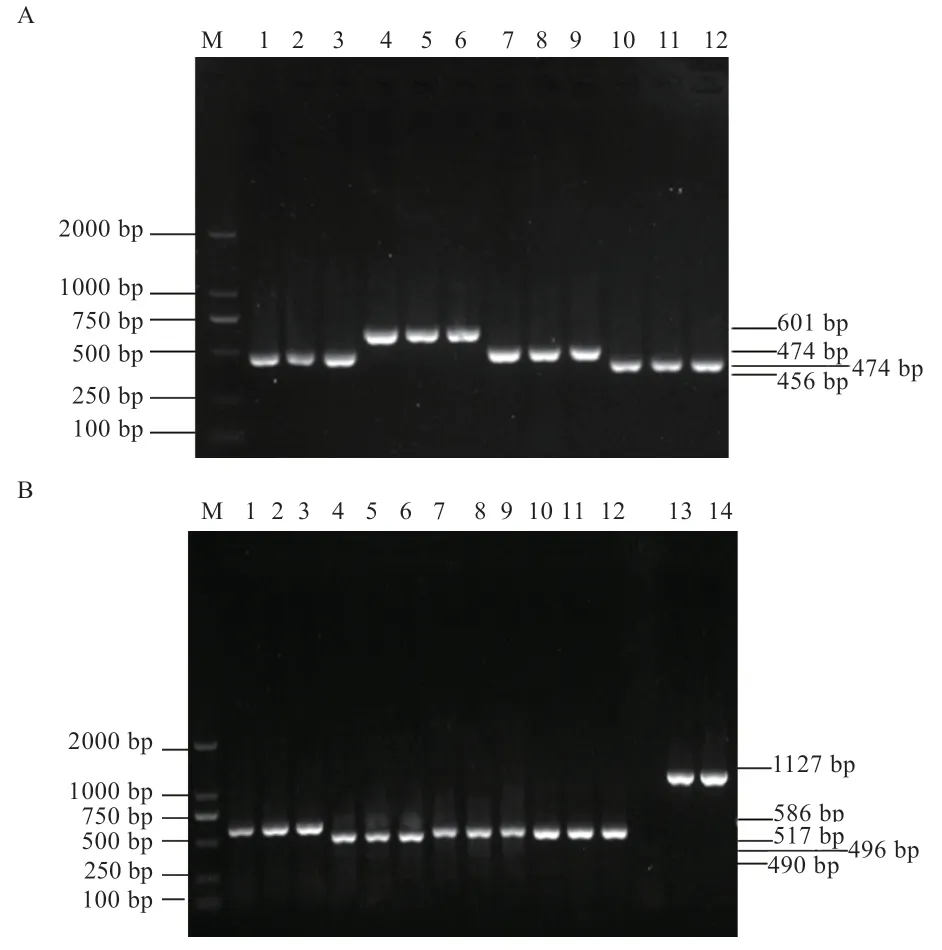
圖1 GnRH1、GnRH2 基因PCR 擴增產物檢測
2.2GnRH1、GnRH2基因SNPs 鑒定 由圖2 可知,在威寧雞GnRH1基因上未發現SNPs 位點,GnRH2基因發現6 個SNPs 位點,分別為位于外顯子1 的g.11 G>C,產生GG、GC 和CC 3 種基因型,屬于錯義突變,精氨酸變為脯氨酸;內含子1 的g.237 T>C,產生TT、TC 和CC 3 種基因型;內含子1 的g.259 T>C,產生TT、TC 和CC 3 種基因型;內含子2 的g.1191 A>G,產生AA、AG 和GG 3 種基因型;內含子4 的g.3535 G>T,產生GG、GT 和TT 3 種基因型;外顯子6 的g.4090 T>C,產生TT、TC 和CC 3 種基因型,導致苯丙氨酸變為絲氨酸,為錯義突變。
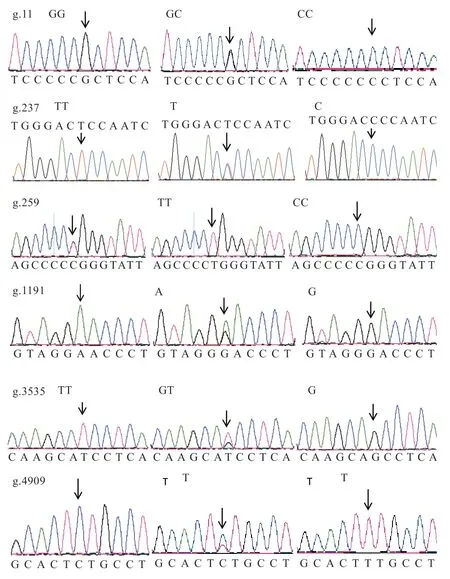
圖2 GnRH2 基因測序峰圖及SNPS 位點
2.3GnRH2基因SNPs 遺傳特性 由表4 可知,威寧雞GnRH2基因g.11 G>C 突變位點中優勢基因型和優勢等位基因分別為GG,G;g.237 T>C 突變位點中優勢基因型和優勢等位基因分別為CC,C;g.259 T>C 突變位點中優勢基因型和優勢等位基因分別為TT,T;g.1191 A>G 突變位點中優勢基因型和優勢等位基因分別為GG,G;g.3535 G>T 突變位點中優勢基因型和優勢等位基因分別為GG,G;g.4090 T>C 突變位點中優勢基因型和優勢等位基因分別為CC,C。6 個突變位點中g.4090 T>C 位點為低度多態(PIC<0.25),其余均為中度多態(0.25<PIC<0.5)。SNPS 位點Hard-weiberg平衡結果表明:g.11 G>C、g.237 T>C、g.259 T>C、g.4090 T>C 位點未偏離Hardy-Weinberg 平衡(P>0.05),g.1191 A>G 和g.3535 G>T 位點偏離Hardy-Weinberg平衡(P<0.05)。
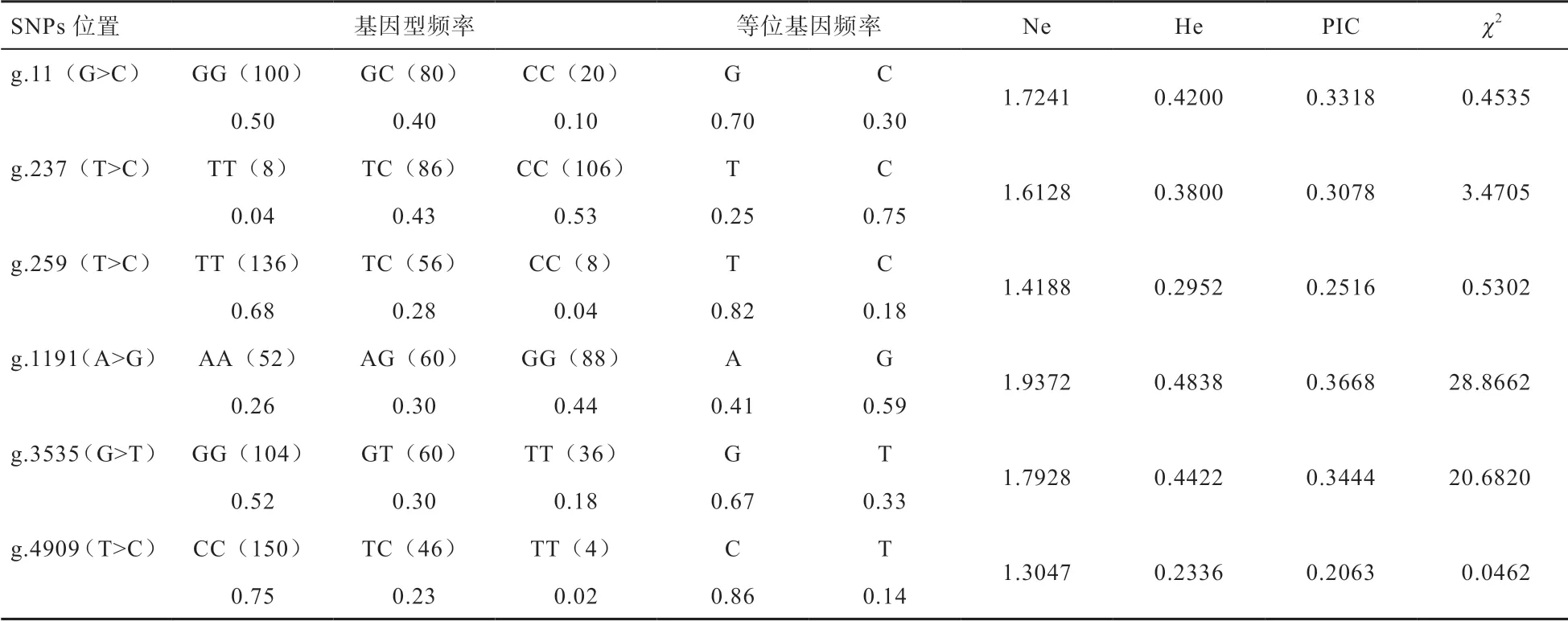
表4 GnRH2 基因SNPs 群體遺傳分析
2.4GnRH2基因SNPs 位點與威寧雞蛋品質的關聯性分析 由表5 可知,g.259 T>C 位點對威寧雞的蛋殼厚度影響達到顯著水平,TT 基因型有利于改善蛋殼厚度。g.1191 A>G 位點對威寧雞的蛋殼強度影響達到顯著水平,AG 基因型有利于改善蛋殼強度。g.11 G>C、g.237 T>C、g.3535 G>T 和g.4090 T>C 4 個SNPS 位點及相應基因型間對威寧雞蛋品質的7個指標均未達到顯著水平。
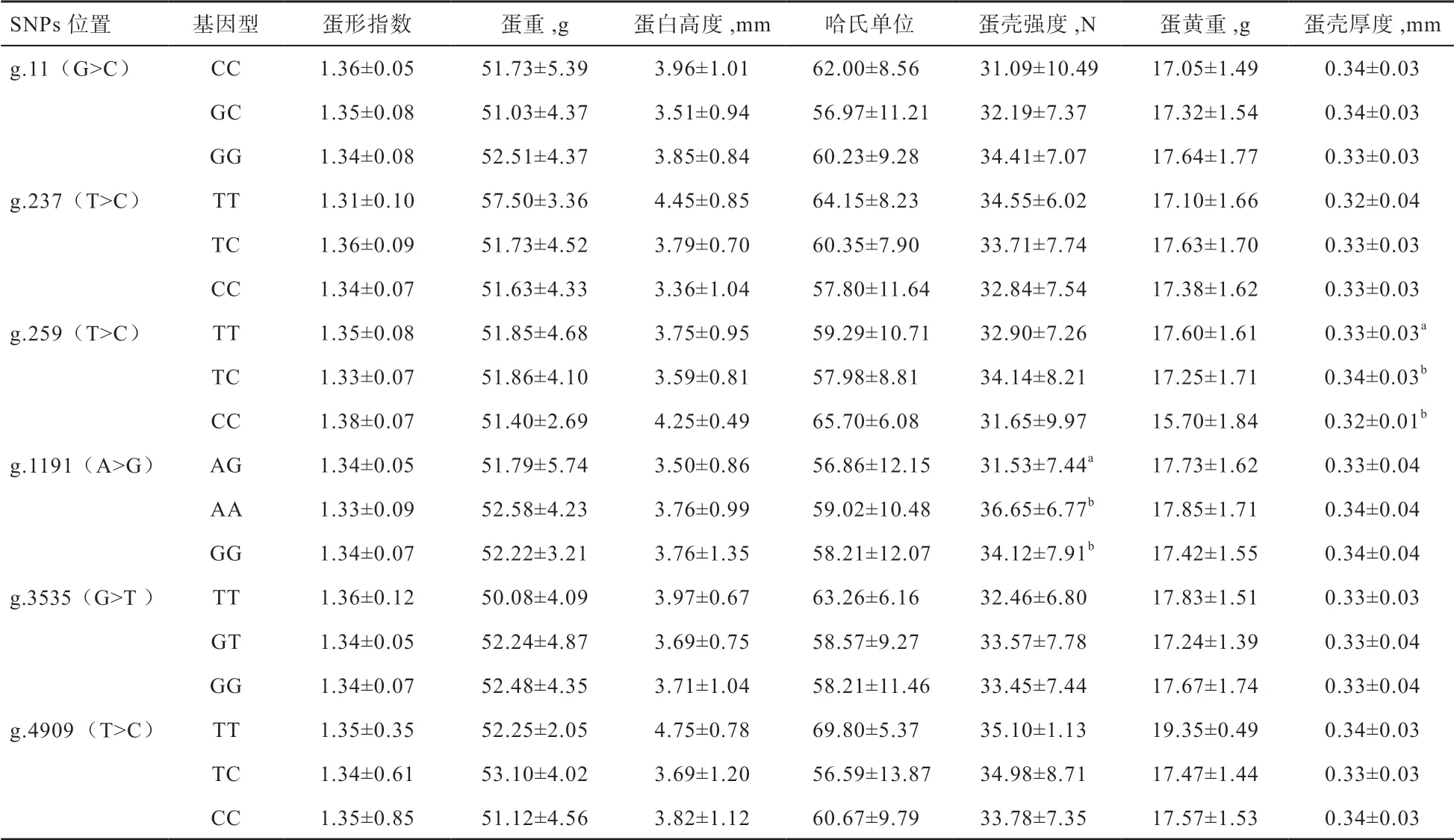
表5 GnRH2 基因SNPS 位點與蛋品質的關聯性分析
3 討 論
GnRH 在動物生殖過程中起著重要的調節作用,它由下丘腦神經元合成,從神經末梢釋放到門脈循環,它與垂體前葉促性腺激素細胞GnRH1型受體結合后,刺激LH 和FSH 的合成和釋放,這2 種多肽通過血液循環進入性腺,刺激性激素的合成和分泌,并觸發配子發生。GnRH1、GnRH2作為卵巢內調節因子,可介導LH與LHR受體的結合,從而影響雞卵泡發育和排卵,同時雞性成熟的啟動得益于接近開產時GnRH1mRNA的高表達[14-15]。鑒于雞GnRH1、GnRH2基因在排卵和產卵中起關鍵作用,本研究通過直接測序法檢測威寧雞GnRH1、GnRH2基因的多態性,并評估這2 個基因的多態性對威寧雞蛋品質性狀的影響。
本研究在威寧雞GnRH1基因上未鑒定出SNPs 位點,這與張瑩等[16]在拉薩白雞群體中研究GnRH-1基因多態性的結果相同,而拉薩白雞GnRH-1基因經酶切反應后發現GG 型均為與開產日齡相關的有利基因型。王娜[17]研究表明GnRH1基因和GnRHR基因也可能與GnRH-依賴性性早熟相關,但在人上尚未發現這2 個基因的突變位點。從各種脊椎動物物種中克隆出編碼GnRH的cDNA 和基因的相關研究,揭示了在所有形式的脊椎動物中GnRH整體結構的保守性,同時GnRH1十肽的結構在哺乳動物的譜系中幾乎完全保守,在非哺乳動物脊椎動物中GnRH1十肽的氨基酸序列在物種間有很大差異[18]。綜上,威寧雞GnRH1基因無SNPs 位點,與GnRH結構的保守性、GnRH1十肽的氨基酸序列在物種間的差異是否有關,有待進一步研究探析。
威寧雞GnRH2基因發現6 個SNPs 位點,多態信息含量分析發現,6 個突變位點中g.4090 T>C 位點為低度多態,其余均為中度多態,說明這6 個位點的遺傳變異較大[19],在威寧雞的遺傳改良中能獲得更多的遺傳進展,在后續的選種選育中可作為威寧雞繁殖力的遺傳標記[20-21]。χ2結果顯示g.1191 A>G 和g.3535 G>T 位點偏離了Hardy-Weinberg 平衡,說明這2 個位點可能與遺傳漂變、環境、人工選擇和育種措施等原因有關[22]。Bhattacharya 等[23]研究了白來航雞的GnRH1和GnRH2基因編碼區多態性,發現GnRH1和GnRH2基因的CDS 區是多態的,GnRH1的單倍型對64 周齡產蛋體重、產蛋量、蛋黃含量、哈式單位和蛋殼參數有顯著影響,GnRH2的單倍型顯著影響白來航雞的性成熟年齡。威寧雞GnRH2基因g.259 T>C 位點、g.1191 A>G 位點對威寧雞的蛋殼厚度和蛋殼強度影響達到顯著水平,TT基因型有利于改善蛋殼厚度,AG 基因型有利于改善蛋殼強度,表明GnRH2基因的單核苷酸多態性與威寧雞的蛋品質性狀密切相關,但是否影響威寧雞的性成熟年齡還需進一步研究驗證,同時推測這2 個位點是威寧雞蛋品質性狀的關鍵位點,可作為威寧雞蛋品質性狀中蛋殼厚度、蛋殼強度的分子標記。分子標記可為后續威寧雞高產蛋雞新品系、配套系等培育提供支持,保種效果的評估也可利用這些多態位點。
4 結 論
本實驗結果顯示,威寧雞GnRH1基因并未發現SNPs 位點。GnRH2基因發現6 個SNPs 位點,均產生3 種基因型,分別位于外顯子1 的g.11 G>C,屬于錯義突變,精氨酸變為脯氨酸;內含子1 的g.237 T>C;內含子1 的g.259 T>C;內含子2 的g.1191 A>G;內含子4 的g.3535 G>T;外顯子6 的g.4090 T>C,導致苯丙氨酸變為絲氨酸,為錯義突變。GnRH2基因g.259 T>C位點顯著影響威寧雞蛋殼厚度,g.1191 A>G 位點顯著影響威寧雞蛋殼強度。因此,GnRH2基因g.259 T>C位點和g.1191 A>G 位點有望作為威寧雞蛋品質性狀相關的關鍵位點和分子標記。

