短鏈脂肪酸、色氨酸代謝物及兩性離子多糖A調控動物炎性腸病通路的研究進展
倪 萍,張海波,廖曉鵬,關瑋琨,黎力之*,郭冬生*
(1.宜春學院生命科學與資源環境學院,江西省高等學校硒農業工程技術研究中心,宜春市功能農業與生態環境重點實驗室,江西宜春 336000;2.宜春學院繼續教育學院,江西宜春 336000)
動物炎性腸病(Inf lammatory Bowel Disease,IBD)是一類影響腸道的慢性炎癥疾病,目前多認為其是環境變化、遺傳易感性及腸道菌群紊亂等因素相互作用的結果[1]。腸道菌群失調,致病菌增多,其釋放的腸毒素導致腸上皮通透性增加,破壞腸道屏障完整性,擾亂抗炎/促炎細胞因子的平衡,釋放大量炎癥介質,引起腸黏膜免疫系統過度反應,誘發IBD,其損傷動物腸道黏膜,導致動物死亡,給動物生產造成了巨大損失[2]。據報道,華東地區的規模化豬場普遍感染亞臨床型回腸炎[3];雞壞死性腸炎一般發生在2~4 周齡肉仔雞中,病死率約為2%~10%[4];鴨腸炎是目前危害水禽健康的重要病原之一,病死率極高[5]。近年來研究發現,腸道菌群產生的短鏈脂肪酸(Short-chain Fatty Acids,SCFAs)、色氨酸代謝物(Tryptophan Catabolites,TC)及兩性離子多糖A(Polysaccharide A,PSA)對白細胞介素-10(Interleukin-10,IL-10)、IL-22 等細胞因子分泌有上調作用,從而緩解IBD[6-8]。例如,SCFAs 激活G蛋白偶聯受體(GPCRs),促進抗炎細胞因子分泌IL-10,對炎癥發揮調控作用[6];TC 活化芳香烴受體(AhR),增加IL-22 生成,維持腸黏膜穩態平衡[7];PSA 通過增強Toll 樣受體2(TLR2)表達,促進調節性T 細胞(Treg)產生IL-10,減輕腸道炎癥[8]。腸道菌群代謝物種類繁多,其中,SCFAs、TC 和PSA 對IBD 的調控作用顯著,且目前還較缺乏此方面的系統綜述。本文以SCFAs、TC和PSA 為例,探討腸道菌群代謝物調控IBD 的作用途徑,為防治動物IBD、促進動物生產提供理論依據。
1 腸道菌群代謝物
1.1 腸道菌群代謝物組成 腸道菌群代謝物種類多、分布廣,哺乳動物血液中來自腸道菌群的代謝物含量達10%,包括SCFAs、TC、PSA、維生素K 和次級膽汁酸等[9]。大部分菌群代謝物由菌群輔助宿主分解營養物質產生。腸道內擬桿菌門和厚壁菌門等厭氧微生物發酵飼糧纖維生成SCFAs,如乙酸、丙酸和丁酸,三者濃度比約為3:1:1,總和達到SCFAs 的95% 以上[10]。SCFAs 濃度主要受腸道共生菌比例影響,微生態失調導致體內不同SCFAs 間比例改變[11]。其次,飼糧纖維含量及其在腸道內的滯留時間對SCFAs 濃度也具有一定影響[11]。腸道菌群還參與色氨酸的代謝,將其分解為吲哚及吲哚酸衍生物(如吲哚-3-乙醛、吲哚-3-乙酸及吲哚乳酸)[12-13]。吲哚作為色氨酸代謝過程的最主要產物,由表達色氨酸酶的共生菌(如副大腸桿菌及擬桿菌)代謝色氨酸產生。研究表明,色氨酸在腸道梭狀芽胞桿菌和羅伊式乳桿菌作用下分解成色胺和吲哚丙酮酸后,轉化為吲哚-3-乙酸和吲哚乳酸[13]。此外,腸道菌群也可自身合成代謝物,例如,脆弱擬桿菌可產生8 種莢膜多糖,PSA 作為其中之一,具有特殊取代基,由帶高電荷重復單元結構組成[14]。其誘導的免疫反應正是取決于重復單元結構中存在的正電荷和負電荷基團[14]。
1.2 腸道菌群代謝物的功能 腸道菌群代謝物不僅能參與體內能量代謝,調控宿主對營養物質的消化吸收,還在維護機體免疫上具有重要作用[6,15]。在眾多菌群代謝物中,SCFAs、TC 和PSA 在保護動物腸道健康方面效果顯著。SCFAs 可增強腸黏膜細胞生長力,維持腸黏膜形態。刁慧[16]研究表明,在豬回腸末端灌注不同濃度的SCFAs,腸道pH 下降,有效抑制了腸上皮細胞凋亡,有利于改善腸黏膜屏障,其中以乙酸61.84 mmol/L、丙酸18.62 mmol/L 和丁酸12.55 mmol/L 混合灌注效果最佳。TC 可激活機體內AhR 信號通路,發揮抗炎作用。研究發現,吲哚-3-乙醛促進小鼠腸道AhR 表達并活化AhR 信號,減輕因白色念珠菌所致的炎癥反應[17]。脆弱擬桿菌產生的PSA 抑制病原菌定植、改善腸道菌群結構,從而提高機體免疫能力。盡管脆弱擬桿菌僅占結腸內菌群總數不足1%,但其產生的PSA 在調節宿主免疫功能上起到關鍵作用[18]。研究顯示,脆弱擬桿菌通過合成釋放PSA,激活TLR 途徑,有助于免疫系統對非致病菌與致病菌的正確識別,維護宿主腸道健康[18]。因此,SCFAs、TC 和PSA 能直接或間接參與腸道免疫反應,維護動物體健康。腸道菌群失衡會造成它們向不利于動物體健康的方向發展,削弱它們對腸道免疫功能的積極影響。
2 常見腸道菌群代謝物對IBD 的影響
2.1 SCFAs 對IBD 的影響 腸道菌群代謝物中SCFAs的研究較多,其通過介導腸黏膜免疫應答增強腸上皮屏障功能,維持腸道穩定[19-20]。IBD 動物模型出現菌群失調現象,會導致SCFAs 顯著減少[21]。研究發現,腸炎山羊經丁酸灌腸或口服丙酸等方法處理后,腸道炎癥得到改善[22]。可見,SCFAs 的濃度與IBD 的發生發展密切相關。如圖1 所示,SCFAs 主要通過激活GPCRs 或抑制組蛋白去乙酰化酶(Histone Deacetylase,HDAC)活性發揮抗炎作用。

圖1 SCFAs 調控腸道炎癥的信號網絡
SCFAs 與GPR41、GPR43 以 及GPR109 結合后激活GPCRs,促進抗炎細胞因子產生,是調控機體腸道炎癥的主要途徑。通過對結腸炎小鼠模型試驗發現,SCFAs 結合腸上皮細胞上的GPR41、GPR43 和GPR109,促使鉀離子外排和超極化,激活炎性小體NOD 樣受體家族蛋白3,促進腸上皮修復細胞因子IL-18 釋放,減輕腸道炎癥[23-25]。而當缺乏上述相關受體時,促炎細胞因子基因表達增強,加劇炎癥反應。此外,不同SCFAs 激活GPCRs 后對IBD 的調控方式不同:乙酸鹽和丙酸鹽激活GPR43 上調叉頭狀螺旋轉錄因子(Forkhead Box P3,Foxp3),誘導T 細胞分化為Treg,促進IL-10 釋放,抑制炎癥反應[26-27];而丁酸鹽通過GPCRs 激活途徑活化結腸內免疫細胞(如巨噬細胞),抑制IL-6、IL-17 表達及輔助性T 細胞17(T Helper Cells 17,Th17)擴增,緩解腸道炎癥[28]。
HDAC 是催化組蛋白去乙酰化反應的一類蛋白酶,SCFAs 利用HDAC 抑制作用,經3 條途徑使抗炎/ 促炎細胞因子處于健康水平,從而降低炎癥反應發生幾率。其一,SCFAs 與HDAC 抑制劑結合后,誘導HDAC 抑制作用,刺激中性粒細胞和單核細胞,致使核轉錄因子κB(Nuclear Transcription Factor-κB,NF-κB)活性降低甚至失活,阻礙IL-2 和IL-6 等促炎細胞因子基因表達,起到抗炎作用[29]。Wen 等[30]在仔豬飼料中添加丁酸鈉,發現血清中IL-6 和腫瘤壞死因子-α(Tumor Necrosis Factor-α,TNF-α)含量降低,腸道NF-κB 的核內功能下降,并有效阻礙了有害菌的生長。其二,SCFAs 抑制HDAC 活性后,通過抑制Foxp3基因中增強子組蛋白H3 乙酰化水平,上調Foxp3基因表達,促進Treg 細胞分化,達到抗炎目的[31]。其中,丙酸和丁酸可通過抑制HDAC 增加Treg 細胞生成,而乙酸由于較缺乏HDAC 抑制活性無法發揮該作用[32]。但有研究表明乙酸可促進正常成年小鼠結腸上皮細胞中AhR 表達及整體組蛋白乙酰化,增強Foxp3基因表達,緩解動物結腸炎[33]。其三,SCFAs 發揮的HDAC 抑制作用調控雷帕霉素靶蛋白通路減少Th17 細胞生成,促進分泌抗炎因子IL-10 的Treg 細胞分化,介導Th17/Treg 平衡,調節機體炎癥反應[34]。研究發現,母畜攝入含SCFAs的飼料,可將其對HDAC 的抑制能力遺傳給后代,提示SCFAs 在維護動物健康,防治腸道疾病方面擁有表觀遺傳潛力[35]。由此推測,在畜禽養殖中可通過增加母體內SCFAs 含量提高其后代免疫能力,降低養殖成本。總之,SCFAs/GPCRs 途徑以及SCFAs 介導HDAC抑制作用,揭示了SCFAs 在維護腸道免疫能力,防治動物IBD 方面擁有巨大的潛力。
2.2 TC 對IBD 的影響 研究表明,飼糧中缺乏色氨酸會降低動物免疫力,導致動物疾病發生率及死亡率升高[36]。仔豬免疫系統尚未發育完全,抗病能力弱,易遭受致病菌侵襲。Zhang 等[37]研究發現,采用富含色氨酸的飼糧飼喂仔豬能有效降低腸道炎癥反應的發生。此外,通過給斷奶仔豬口服大腸桿菌后,飼喂含充足色氨酸的飼糧,結果顯示,試驗組仔豬日增重顯著升高,血液中免疫球蛋白A 含量上升[36]。這些研究結果均表明色氨酸含量增加可降低動物患病風險,改善動物免疫功能。然而,飼糧中色氨酸對動物腸道免疫的影響并不是由其自身作用產生,而與其代謝物密切相關。體內色氨酸有多種代謝途徑,腸道菌群途徑作為其中之一,雖所占比例僅4%~6%,但此途徑下生成的TC 在動物腸道免疫調節方面發揮的關鍵作用不容忽視[38]。
色氨酸沿腸道菌群途徑代謝產生的AhR 信號對腸道穩定至關重要,被認為是腸道免疫反應的受體,有助于維護腸黏膜屏障功能。AhR 是介導機體免疫調節的主要因子,在其眾多配體中,約有50% 與色氨酸或TC(如吲哚-3-丙酸和吲哚乳酸)相關[39]。腸道菌群產生的TC 可通過激活AhR,調控腸道先天淋巴細胞(Innate Lymphoid Cells,ILCs),維護腸黏膜穩態。Kobayashi 等[40]研究發現,飼喂色氨酸可增加野生小鼠AhR mRNA 表達,進而促進ILCs 增殖,引起IL-22含量升高。ILCs 作為機體重要固有免疫細胞,具有御防外來病原體入侵、修復組織損傷及免疫調節等功能。IL-22 能誘導腸上皮細胞分泌抗菌肽及黏蛋白,在對抗腸道病原菌方面有著重要作用。AhR 被TC 活化后,通過上調kit 和Notch 信號通路促進ILCs 增殖分化,IL-22 生成增加,參與IBD 的發展過程[41]。除此之外,吲哚作為體內微生物信號分子之一,具有顯著抗炎作用,在維護動物腸道健康方面起著重要作用。研究表明,TC 吲哚及吲哚衍生物可促進黏附蛋白及腸上皮細胞緊密連接蛋白相關基因表達,從而提高腸道免疫能力,同時增加IL-10 表達量,抑制腸道炎癥反應[38]。綜上所述,色氨酸經腸道菌群分解生成的產物不僅可與AhR 結合,參與維護腸道穩態及動物體免疫調節,還可增強腸上皮細胞緊密連接,促進抗炎因子分泌,發揮積極抗炎作用(圖2)。然而,當體內色氨酸與支鏈氨基酸的比例失衡時,對動物采食量及免疫力產生負面影響[36]。因此,在實際生產中利用色氨酸增強動物免疫力,提高動物生產性能的同時也應注意調控飼料中支鏈氨基酸含量。
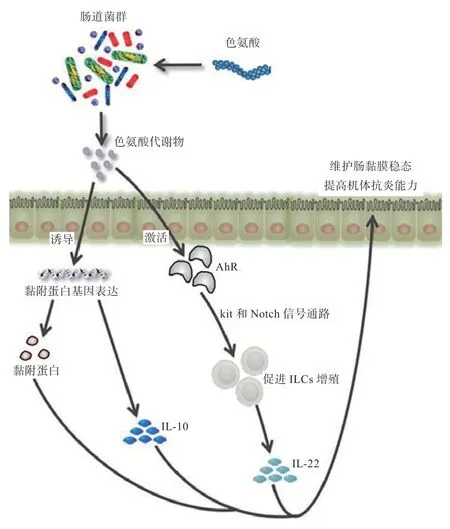
圖2 TC 調控腸道炎癥的信號網絡
2.3 PSA 對IBD 的影響 腸道菌群除作用于營養物質產生SCFAs 及TC 外,還能自身合成代謝物PSA。研究表明,對由三硝基苯磺酸鈉(Trinitrobenzene Sulfonic Acid,TNBS)誘導的腸炎動物模型采用PSA 治療性給藥后,發現IL-23、IL-17 和TNF-α等促炎細胞因子含量顯著降低[42]。這類細胞因子主要由Th17 細胞產生,RORγt 是指導Th17 分化的轉錄因子,動物體經PSA 處理后其表達受到抑制,從而降低由Th17 產生的促炎細胞因子水平,達到抗炎效果。此外,有學者在研究肝螺桿菌誘導感染的結腸炎動物模型中發現,脆弱擬桿菌可作為免疫激活劑刺激Treg 細胞活化,隨后,Treg 細胞通過促進IL-10 分泌而有效抑制促炎細胞因子IL-17 產生,從而緩解IBD[18]。進一步研究表明,即使在PSA存在情況下,缺乏IL-10 的小鼠在TNBS 誘導下也會出現腸炎癥狀[42]。由此可知,IL-10 是PSA 抑制腸炎反應的關鍵,而隨著研究的深入,PSA 調控IL-10 緩解腸道炎癥的通路也逐漸清晰。據報道,樹突狀細胞(Dendritic Cells,DCs)參與PSA 對腸道炎癥的調節[43]。進一步研究發現,DCs 中介導PSA 炎癥調控過程的是pDC,但腸道pDC 如何識別由脆弱擬桿菌產生的PSA還需進一步研究探討[43]。PSA 通過刺激pDC 細胞表面TLR2 活化pDC 細胞,以pDC 細胞表面主要組織相容性復合體II 類、CD86 和可誘導共刺激分子配體為媒介促進Treg 細胞分泌IL-10,從而抑制腸道炎癥[44]。同時,PSA 還可直接刺激CD+4T 細胞表面TLR2,上調CD25及Foxp3基因表達,促使其向Treg 細胞分化,從而增加IL-10 分泌量抑制腸炎[45]。綜上,PSA 通過促進免疫系統中較為有效的抗炎細胞因子IL-10 分泌,抑制與Th17 系譜相關的多種促炎細胞因子產生,實現對IBD的調控。然而,動物體內脆弱擬桿菌不表達PSA。因此,深入研究PSA 調控動物IBD 更為具體的分子機制,有望為防治動物IBD 提供新策略。
3 SCFAs、TC 和PSA 在IBD 中的應用潛力
SCFAs 維護腸上皮屏障功能,參與腸道免疫調節,抑制炎癥發生。在飼糧中添加丁酸鈉,肉雞小腸絨毛高度和黏膜厚度顯著增加,有效防止IL-6、IL-8 和TNF-β等炎癥因子進入機體誘發IBD[46]。給奶牛日糧添加中短鏈和長鏈脂肪酸混合物后,細胞因子IL-10 含量顯著上升,提高奶牛抗炎能力[47]。仔豬日糧中添加0.2%的丁酸可減輕大腸桿菌誘發的腸道炎癥,同時抑制HDAC,增加宿主防御肽含量,有利于動物正常生長發育[48]。此外,仔豬處于炎癥狀態時,對色氨酸的需求量增加,主要通過TC 發揮免疫調節作用[36]。在仔豬日糧中添加色氨酸,結腸炎仔豬腸道通透性顯著下降[49]。可知,飼料中添加色氨酸調控體內TC 含量可達到緩解仔豬結腸炎的目的。通過給予結腸炎小鼠PSA 治療,發現PSA 對腸黏膜有保護作用,說明PSA 具有緩解IBD的能力[50]。而目前由于外源性PSA 調控IBD 的研究對象主要為實驗動物,在畜禽生產中,安全性和有效性還有待進一步探究。綜上,合理利用SCFAs、TC 和PSA可提高動物腸道免疫力,減輕腸道炎癥反應。
4 總結與展望
IBD 對動物危害極大,且在動物生產上尚缺乏有效防治方法。近年來,大量研究表明,腸道菌群代謝物與IBD 密切相關。SCFAs、TC 及PSA 多以對免疫細胞(如Treg 細胞、Th17 細胞)及其分泌的相關細胞因子(如IL-10 及IL-17)調控為主,從而緩解IBD。通過SCFAs、TC 及PSA 對IBD 調節方式的充分探究,為揭示IBD 發生發展的未知領域提供一定的理論支持。未來利用分子生物學技術、云數據分析和多元線性相關法等,深入研究腸道菌群代謝物調控IBD 更為具體的作用機制,將為今后尋找動物IBD 防治方法提供新方向。

