牛骨膠原水解物抑制鰱魚肌原纖維蛋白氧化和增強凝膠特性研究
王 鵬,穆雅慧,何思寧,馬松艷,馬 雪,張雅娜,郭 麗
(綏化學院食品與制藥工程學院,黑龍江綏化 152061)
2018年我國水產加工品總量為634.879萬噸,其中魚糜制品為145.546萬噸,占水產加工品產量的22.92%[1]。隨著全球海水魚類的總體減產,內陸淡水魚類養殖的持續增長,淡水魚類成為魚糜生產最有潛力的原料。鰱魚(Hypophthalmichthys molitrix)養殖產量大,價格低,肉質鮮嫩,是生產魚糜等加工制品的常用蛋白質資源。淡水魚在加工和貯藏過程中,易發生蛋白質變性;同時與傳統的海水魚類相比,淡水魚凝膠形成能力弱,因此需要添加外源物質減少蛋白質氧化降解,增強其凝膠品質[2?3]。大量研究報道表明,魚骨粉及其蛋白水解物具有功能活性,可提高魚肌原纖維蛋白凝膠強度。3%鱈魚魚骨粉可提高海鱸魚肌原纖維蛋白凝膠持水性和凝膠強度[4],納米魚骨能夠增強鰱魚肌球蛋白的凝膠性能[5],骨蛋白水解物能夠抑制鯉魚魚糜的蛋白和脂肪氧化變性,濃度越高效果越明顯[6]。用胰蛋白酶和堿性蛋白酶制備的魚糜加工副產物水解物,具有抗氧化活性,添加到魚糜中,可阻止巰基氧化、羰基化、肌球蛋白變性,可明顯改善凝膠性質和保水能力[7]。
牛骨是牛肉加工過程中產生的主要副產品之一,通常被用于生產骨粉、骨泥、飼料等低價值商品[8],牛骨中含有約14%~23%的膠原蛋白[9],膠原蛋白經酶解后可獲得具有高附加值的水解產物。Gao等[10]發現牛骨膠原水解物對小鼠具有免疫調節作用。張順亮等[11]利用中性蛋白酶酶解、超濾分離獲得小于10 kDa分子質量的牛骨膠原蛋白水解物,在20 mg/mL的濃度下對大腸桿菌抑菌率為93.61%。Ku等[12]研究發現,牛骨膠原蛋白肽具有較強的抗氧化能力,對DPPH自由基清除率高達72.81%。因此,酶解牛骨蛋白是優化利用骨蛋白的途徑之一,而牛骨蛋白酶解物也可作為肉類制品有效的天然抗氧化劑。目前關于骨蛋白酶解物在魚肌原纖維蛋白應用研究較多的來自魚骨和豬骨[6?7],未見關于牛骨膠原水解物在淡水魚凝膠食品中應用的報道。
本研究選擇胃蛋白酶和胰蛋白酶制備牛骨膠原水解物,綜合評價添加不同濃度牛骨膠原水解物對鰱魚肌原纖維蛋白凝膠品質及抗氧化活性的影響,以期為牛骨高附加值產品在魚糜制品中的工業應用提供理論參考。
1 材料與方法
1.1 材料與儀器
牛骨、鮮活鰱魚 大潤發超市;胃蛋白酶(300000 U/g) 上海源葉生物科技有限公司;胰蛋白酶(250000 U/g) 北京奧博星生物技術責任有限公司;8-苯氨基-1-萘磺酸銨鹽(ANS) 深圳市美凱特科技有限公司;1,1-二苯基-2-三硝基苯肼(DPPH)南京奧多福尼生物科技有限公司;2,2'-聯氮-雙-3-乙基苯并噻唑啉-6-磺酸(ABTS) 北京酷爾化學科技有限公司。
TYAIB高壓蒸汽滅菌鍋 上海博訊實業有限公司醫療設備廠;FW135高速萬能粉碎機 天津市泰斯特儀器有限公司;CR-400色差儀 日本柯尼卡美能達公司;GL-16G-II高速冷凍離心機 上海市安亭科學儀器廠;TA-XT.puls質構儀 英國Stable Micro System公司;TENSOR 27傅里葉紅外光譜儀 德國BRUKER科學儀器公司;Hitachi S-3400N掃描電子顯微鏡 日本日立公司。
1.2 實驗方法
1.2.1 牛骨膠原水解物的制備 參考代亞民[13]的方法制備牛骨膠原水解物,并略作修改。將牛股骨整理、剔膜,經121 ℃、0.1 MPa高壓蒸煮3 h后,粉碎、清洗瀝干。取300 g預處理后的牛骨,加入500 g 95%的正己烷,在4 ℃條件下攪拌24 h,每隔6 h更換一次95%正己烷。用蒸餾水反復洗滌,瀝干后備用。將脫脂后的牛骨以料液比1:10加入0.25 mol/L的EDTA溶液(pH7.4)并在4 ℃下振搖脫鈣2 d[14]。
將脫脂、脫鈣后的牛骨在50 ℃下烘干,再用萬能粉碎機將牛骨粉碎,過20目篩,得到牛骨粉。將牛骨粉與蒸餾水按1:6制成懸浮液,在121 ℃條件下處理3 h。然后加入胃蛋白酶以0.5%的酶/底物(w/w)比進行酶解,在pH 2.0,溫度32 ℃的條件下酶解90 min。酶解后在沸水浴中滅酶15 min。冷卻后,再加入胰蛋白酶以0.6%的酶/底物(w/w)比進行酶解,酶解條件為pH 7.5,溫度50 ℃,酶解時間120 min。將得到的酶解液進行冷凍干燥,得到牛骨膠原水解物。
1.2.2 鰱魚肌原纖維蛋白的制備 鮮活鰱魚去皮、骨、內臟,取魚背部肉200 g用組織搗碎機搗碎,加入5倍體積的0.02 mol/L pH 7.5的磷酸鹽緩沖溶液攪拌均勻,肌肉勻漿液在4 ℃、4300 r/min條件下離心15 min后,棄去上清液取出沉淀,在相同條件下用上述5倍體積磷酸鹽緩沖溶液洗滌所得沉淀兩次,所得沉淀用5倍體積0.1 mol/L的NaCl溶液在相同的條件下洗兩次,最后一次離心前抽濾,除去勻漿液中的結締組織,得到的沉淀在4 ℃儲存備用[15]。
1.2.3 牛骨膠原水解物-肌原纖維蛋白懸浮液制備取肌原纖維蛋白,加入0.02 mol/L pH 6.5的磷酸鹽緩沖液(內含0.6 mol/L NaCl)溶解,配制蛋白質最終濃度為40 mg/mL的肌原纖維蛋白懸浮液。再向肌原纖維蛋白懸浮液中分別1%、2%、3%、4%、5%的牛骨膠原水解物(w/肌原纖維蛋白濕重),未添加牛骨膠原水解物為對照,在4 ℃下靜置穩定12 h。
1.2.4 牛骨膠原水解物-肌原纖維蛋白凝膠制備 采用熱導法進行肌原纖維蛋白凝膠制備[15]。將肌原纖維蛋白與添加五種不同濃度牛骨膠原水解物的肌原纖維蛋白,在40 ℃水浴條件下加熱30 min后,再放入90 ℃水浴下加熱20 min,加熱完成后在冰水中冷卻,最后得到肌原纖維蛋白凝膠,在4 ℃條件下平衡24 h備用。
1.3 測定方法
1.3.1 肌原纖維蛋白總巰基和活性巰基的測定 參照吳滿剛[16]的方法,略有改動。取3 mL肌原纖維蛋白稀釋液(4 mg/mL)加入3 mL 0.1 mol/L pH 7.0的磷酸鹽緩沖溶液(內含1 mmol/L EDTA、8 mol/L尿素、1% SDS),加入0.1 mL 1%的DNTB,以不加DNTB為空白,劇烈振蕩后在25 ℃水浴1 h后在離心條件為3000 r/min離心30 min。在412 nm波長下測定上清液的吸光度,計算總巰基含量。測量活性巰基含量時將反應混合液中尿素去除,其余步驟均同上,計算活性巰基含量。

式中:巰基含量單位為mol/105g,A—吸光度,N—稀釋倍數,C—分子吸光系數13600 M?1·cm?1,M—肌原纖維蛋白含量,mg/mL。
1.3.2 肌原纖維蛋白表面疏水性測定 稱取0.120 g ANS,用0.1 mol/L pH7.0的PBS溶解并定容至50 mL配制成ANS溶液。分別取4 mL濃度為0.8、1.6、2.4、3.2、4.0 mg/mL的蛋白液,加入20 μL預先配置的ANS溶液,振蕩混勻。使用熒光分光光度計測定樣品熒光強度,激發波長374 nm,發射波長485 nm。以蛋白濃度為橫坐標,熒光強度為縱坐標作圖,計算線性回歸方程曲線斜率,肌原纖維蛋白表面疏水性即用SoANS表示[17]。
1.3.3 白度的測定 經校準透明盤(L*=52.94,a*=?0.50,b*=4.85)的白度后,用手握住色差儀,將色差儀垂直放在肌原纖維蛋白凝膠表面,每測量一次后,記錄好數據并用擦鏡紙擦干色差儀的鏡頭表面,每次放置力度保持均勻,記錄L*(亮度),a*(紅/綠度)和b*(黃色/藍),平行測定3次。
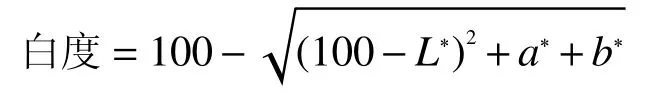
式中:L*—亮度,a*—紅/綠度,b*—黃/藍度。
1.3.4 保水性的測定 稱取2 g肌原纖維蛋白凝膠樣品放入離心管中稱重,設置離心機的轉數為10000 r/min,4 ℃離心3 min,倒掉離心后的水并稱重量離心管和肌原纖維蛋白凝膠的重量,通過公式計算肌原纖維蛋白凝膠保水性,平行測定3次。

式中:M—離心管質量,g;M1—離心管與離心后除去水的肌原纖維蛋白凝膠總重量,g;M2—離心前離心管與肌原纖維蛋白凝膠總重量,g。
1.3.5 凝膠強度的測定 肌原纖維蛋白凝膠置于4 ℃環境中穩定12 h后,去除肌原纖維蛋白凝膠表面的液體,室溫平衡10 min后進行質構分析。選用直徑10 mm的圓柱狀探頭(P/0.5S),設定測試前速度為1 mm/s,測試中速度為0.5 mm/s,測試后速度為10 mm/s,穿刺距離為10 mm,觸發力為10 g,數據速度為100(每秒鐘取點數),通過軟件對凝膠強度數據進行分析[18]。
1.3.6 微觀結構的測定 將肌原纖維蛋白凝膠樣品切成小切條(5 mm×5 mm×5 mm),用2.5%的戊二醛在4 ℃固定24 h。用0.1 mol/L pH 7.0的磷酸鹽緩沖液洗滌肌原纖維蛋白凝膠條三次,以除去戊二醛流體,每次持續10 min。將除去戊二醛的肌原纖維蛋白凝膠條依次在50%、70%、80%、90%和100%乙醇中脫水10 min,重復三次。肌原纖維蛋白凝膠條用100%乙醇:叔丁醇(1:1)和叔丁醇置換15 min后,將肌原纖維蛋白凝膠條冷凍干燥36 h。使用掃描電子顯微鏡測定肌原纖維蛋白凝膠的微觀結構[19]。
1.3.7 紅外光譜分析 肌原纖維蛋白凝膠的紅外光譜采用反射進行測試,取冷凍干燥后樣品,加入溴化鉀研磨,用壓片機進行壓片處理,測試400~4000 cm?1之間的透光率,觀察圖像峰值的變化。
1.3.8 牛骨膠原蛋白水解物-肌原纖維蛋白凝膠抗氧化性的測定
1.3.8.1 ABTS自由基清除能力 參考Re等[20]的方法進行測定。分別取25 mL的7 mmol/L ABTS溶液和25 mL的2.45 mmol/L過硫化鉀溶液混合均勻,置于室溫下暗處放置12~16 h,得到ABTS儲備液,使用前將儲備液用蒸餾水稀釋40~45倍使該溶液在734 nm下的吸光度值在0.70±0.02之間。取不同稀釋倍數的肌原纖維蛋白凝膠溶液0.1 mL加入3.9 mL的ABTS溶液,搖勻,室溫下放置6 mim后,在734 nm處測定吸光度。以蒸餾水代替樣品做空白對照,對ABTS自由基的清除率以下列公式計算:
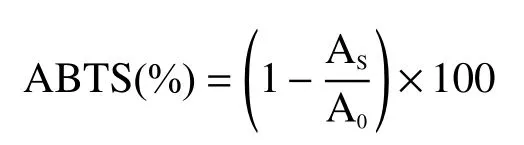
式中:A0—空白對照反應后的吸光度;AS—樣品反應后的吸光度。
1.3.8.2 DPPH自由基清除能力 參考Yamaguchi等[21]的方法進行測定。樣品組Ai用2 mL不同稀釋倍數的肌原纖維蛋白凝膠溶液與DPPH溶液2 mL均勻混合;空白組Aj是用2 mL不同稀釋倍數的肌原纖維蛋白凝膠溶液與2 mL乙醇均勻混合;對照組Ac為2 mL純凈水與DPPH溶液2 mL均勻混合。混合后立即在517 nm下測定吸光值,并在暗處放置30 min后再次測定吸光度。DPPH自由基清除率計算公式為:
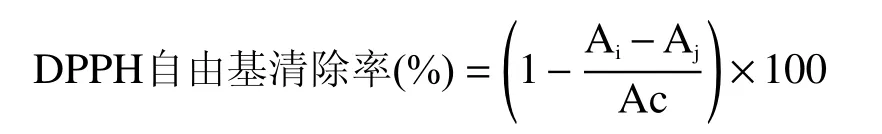
1.3.8.3 羥自由基清除能力 采用鄰二氮菲-Fe2+氧化法檢測復合物對羥自由基的清除能力。在試管中加入2 mL 0.2 mol/L磷酸鹽緩沖液(pH7.4),1.0 mL去離子水,搖勻;加入1.0 mL 0.75 mmol/L FeSO4,充分混勻;加入1.0 mL 0.01% H2O2,振蕩1 min;加入1.0 ml 1.5 mmol/L鄰二氮菲無水乙醇溶液,37 ℃水浴45 min;用725紫外-可見分光光度計于波長526 nm檢測反應體系吸光度值Ap;以1.0 mL去離子水替代1.0 mL H2O2,其余條件相同,測其吸光度值Ab;以不同稀釋倍數的肌原纖維蛋白凝膠溶液1.0 mL替代去離子水,其余條件相同,測其吸光度值As。
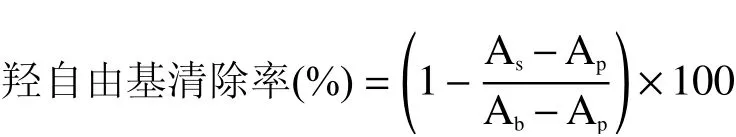
1.4 數據處理
所有實驗數據均采用SPSS統計軟件(19.0)分析,每組實驗重復3次,數據結果以平均值±SD的方式表示。采用ANOVA進行鄧肯氏多重差異分析。
2 結果與分析
2.1 牛骨膠原水解物添加量對肌原纖維蛋白總巰基的影響
總巰基是活性巰基和分子內部巰基的總和,指包埋于蛋白質分子內的和暴露在蛋白質表面的巰基,而活性巰基指暴露在蛋白質表面的巰基。不同牛骨膠原水解物添加量對肌原纖維蛋白總巰基的影響如圖1所示。與未添加牛骨膠原水解物的肌原纖維蛋白相比,添加1%牛骨膠原水解物后,總巰基含量略有增加,此時二硫鍵形成較少,該濃度能有效抑制肌原纖維蛋白凝膠的變性程度,分析得出在此濃度下蛋白聚集主要依靠表面疏水相互作用[22]。隨著牛骨膠原水解物添加量(3%~5%)的增大,總巰基含量呈顯著下降趨勢(P<0.05),杜慧穎等[23]研究發現,在一定濃度范圍內,鯉魚魚鱗蛋白酶解液的增加,可延緩凍藏過程中鯉魚肌原纖維蛋白總巰基含量下降,這與本研究結果相反,分析可能是高濃度牛骨膠原水解物影響了肌原纖維蛋白空間結構,使包埋于分子內部的巰基暴露出來,形成二硫鍵,導致巰基含量下降。后續還有待進一步深入研究。
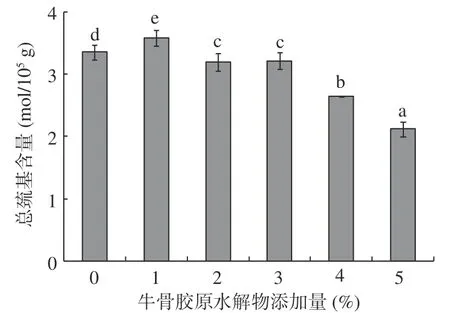
圖1 牛骨膠原水解物對肌原纖維蛋白總巰基的影響Fig.1 Effect of bovine-bone collagen hydrolysate on total sulfhydryl group of myofibrillar protein
2.2 牛骨膠原水解物添加量對肌原纖維蛋白活性巰基的影響
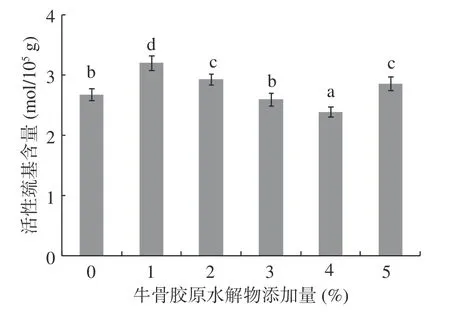
圖2 牛骨膠原水解物對肌原纖維蛋白活性巰基的影響Fig.2 Effect of bovine-bone collagen hydrolysate on active sulfhydryl group of myofibrillar protein gel
肌原纖維蛋白含有大量的活性巰基,這些巰基很容易被氧化為分子內或分子間的二硫鍵,這也是氧化過程中肌原纖維蛋白聚合的主要途徑。不同牛骨膠原水解物添加量對肌原纖維蛋白凝膠活性巰基的影響如圖2所示。當添加1%的牛骨膠原水解物時,活性巰基含量顯著增加(P<0.05)。肌原纖維蛋白分子結構展開,使包埋于內部的巰基不斷暴露出來,造成表面巰基不斷增加[24]。
當牛骨膠原水解物添加量為2%~4%時,活性巰基的含量呈顯著下降趨勢(P<0.05),由于牛骨膠原水解物的添加導致肌原纖維蛋白的游離巰基被氧化為二硫鍵及相關化合物,氧化同時引起蛋白質側鏈結構發生修飾,導致游離巰基含量減少[25]。當牛骨膠原水解物添加量為5%時,活性巰基的含量有所回升,可能因為分子內分子間二硫鍵斷裂[26],使得巰基有所增加。
2.3 牛骨膠原水解物添加量對肌原纖維蛋白凝膠疏水性的影響
不同牛骨膠原水解物添加量對肌原纖維蛋白凝膠表面疏水性的影響如圖3所示。肌原纖維蛋白在形成凝膠后其表面疏水性顯著增加(P<0.05),增幅為73%。肌原纖維蛋白形成凝膠后表面疏水性的增加是由于加熱過程中,蛋白質的二級結構展開使得疏水性基團暴露出來進而增加了蛋白質之間疏水相互作用力[27]。在加熱過程中疏水相互作用逐漸增強成為肌原纖維蛋白凝膠中的主要化學作用力之一[28]。
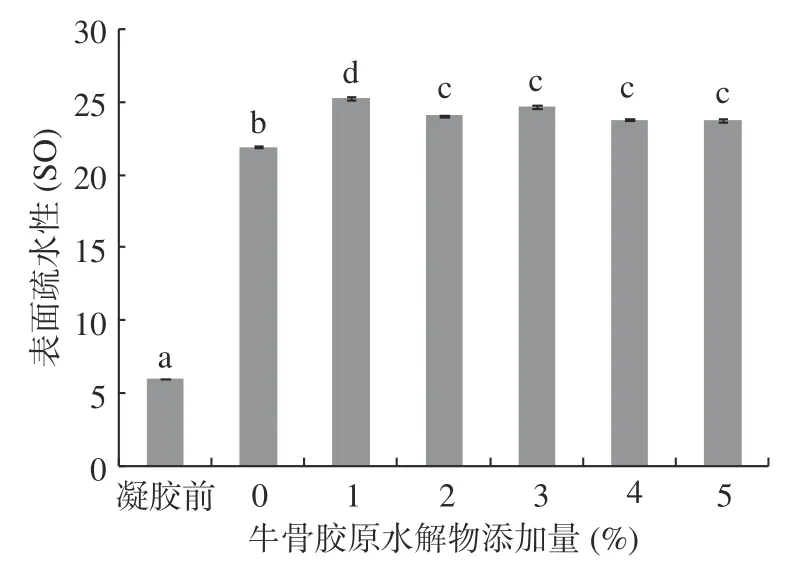
圖3 牛骨膠原水解物對肌原纖維蛋白凝膠表面疏水性的影響Fig.3 Effect of bovine-bone collagen hydrolysate on surface hydrophobicity of myofibrillar protein gel
與未添加牛骨膠原水解物相比,隨著牛骨膠原水解物添加量的增加,肌原纖維蛋白表面疏水性顯著增加(P<0.05),增幅分別為15.4%、9.6%、12.7%、8.5%、8.3%。添加牛骨膠原水解物之后導致了肌原纖維蛋白結構展開,使一些疏水基團暴露出來,且牛骨膠原水解物中甘氨酸含量最多,甘氨酸為疏水性氨基酸[29],從而使肌原纖維蛋白凝膠表面疏水性增加。
牛骨膠原水解物添加量為1%~5%,肌原纖維蛋白凝膠表面疏水性總體呈下降趨勢,隨著牛骨膠原水解物添加量進一步増加,外露的疏水性基團越來越多,疏水相互作用越來越強,部分肌原纖維蛋白分子通過疏水相互作用形成聚集,使暴露在外面的疏水基團又被重新包埋,從而導致蛋白質表面疏水性下降[30]。
2.4 牛骨膠原水解物添加量對肌原纖維蛋白凝膠白度的影響
白度是評價魚類凝膠制品品質的重要指標之一。不同牛骨膠原水解物添加量對肌原纖維蛋白凝膠白度的影響如圖4所示。隨著牛骨膠原水解物添加量的增多,肌原纖維蛋白凝膠白度整體呈現先上升后下降的趨勢,當牛骨膠原水解物添加量為3%時,蛋白凝膠白度達到最高為38.46,這可能是由于一定量的牛骨膠原水解物可以使肌原纖維蛋白凝膠結構致密均勻,從而顯示出更好的光澤度和亮度。
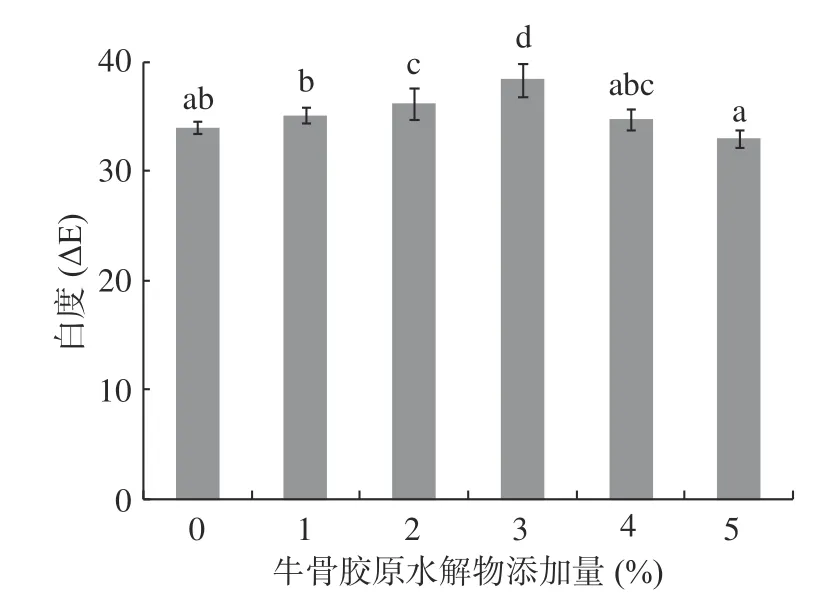
圖4 牛骨膠原水解物對肌原纖維蛋白凝膠白度的影響Fig.4 Effect of bovine-bone collagen hydrolysate on whiteness of myofibrillar protein gel
當牛骨膠原水解物添加量大于3%,肌原纖維蛋白凝膠白度呈現下降趨勢,這可能是隨著水解物添加量增加,其中的甘氨酸含量也隨之增多,甘氨酸作為疏水性氨基酸導致疏水作用力增大,凝膠內部作用力失去平衡,使凝膠結構的空隙不斷增大導致肌原纖維蛋白凝膠白度下降[25];也可能是牛骨膠原水解物添加量較大,攪拌溶解時間增加,進而導致肌原纖維蛋白在空氣中暴露時間較長,從而導致凝膠白度降低,這與李艷青[31]在蛋白質氧化對肌原纖維蛋白凝膠性的影響研究中結論相符。
2.5 牛骨膠原水解物添加量對肌原纖維蛋白凝膠保水性的影響
不同牛骨膠原水解物添加量對肌原纖維蛋白凝膠保水性的影響如圖5所示。隨著牛骨膠原水解物添加的增多,肌原纖維蛋白凝膠的保水性呈先增加后下降趨勢(P<0.05)。與添加1%牛骨膠原水解物樣品相比,未添加牛骨膠原水解物的肌原纖維蛋白呈現出較低的保水性,可能是由于熱激活內源蛋白酶而引起明顯的蛋白水解,改變蛋白結構,進而使其保水能力降低。
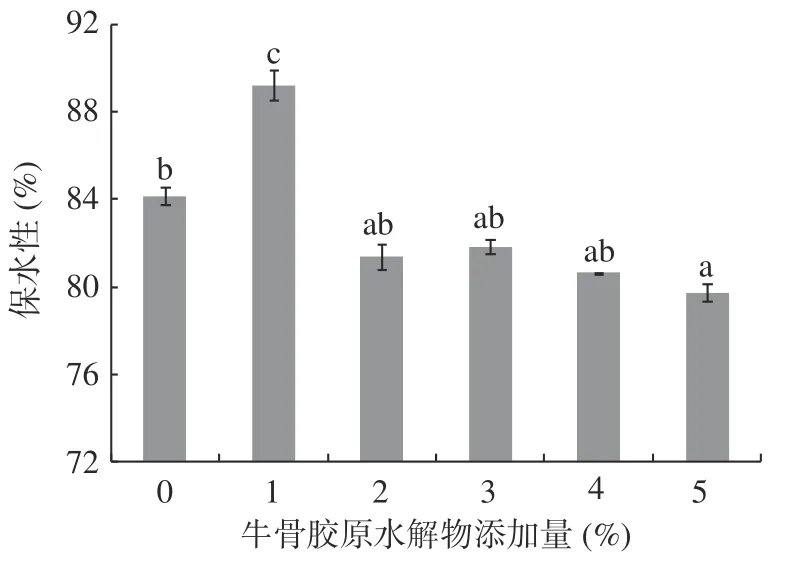
圖5 牛骨膠原水解物對肌原纖維蛋白凝膠保水性的影響Fig.5 Effect of bovine-bone collagen hydrolysate on water retention of myofibrillar protein gel
在牛骨膠原水解物添加量1%時,肌原纖維蛋白凝膠保水性達到最高(P<0.05),為89.25%。分析可能是低濃度的牛骨膠原水解物與肌原纖維蛋白凝膠形成較為致密的三維網絡結構,從而包含更多的水分。之后隨著牛骨膠原水解物添加量的增加,肌原纖維蛋白凝膠保水性逐漸下降。與添加1%牛骨膠原水解物樣品相比,降低幅度分別為8.81%、8.29%、9.66%、10.65%。肌原纖維蛋白凝膠結構的變化與肌原纖維蛋白凝膠保水性的降低有很大關系,當牛骨膠原水解物添加量增大時,牛骨膠原水解物使肌原纖維蛋白濃度降低,阻礙了蛋白質之間的交聯作用,并且影響了水分與肌原纖維蛋白之間氫鍵的形成,因此導致了肌原纖維蛋白凝膠保水性的下降[32?33]。
2.6 牛骨膠原水解物添加量對肌原纖維蛋白凝膠強度的影響
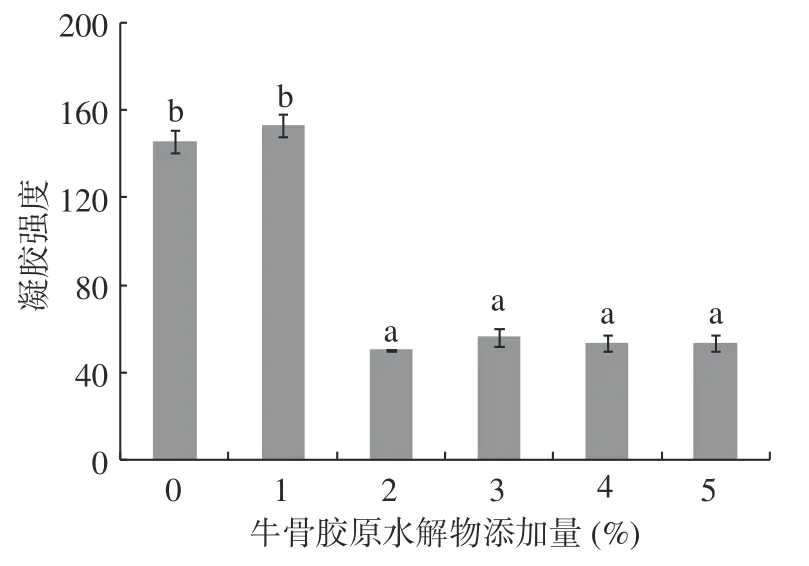
圖6 牛骨膠原水解物對肌原纖維蛋白凝膠強度的影響Fig.6 Effect of bovine-bone collagen hydrolysate on the strength of myofibrillar protein gel
不同牛骨膠原水解物添加量對肌原纖維蛋白凝膠強度的影響如圖6所示。隨著牛骨膠原水解物添加的增多,肌原纖維蛋白凝膠強度呈先增加后下降趨勢(P<0.05)。在添加量為1%時,凝膠強度達到最大,為153.24。之后隨著牛骨膠原水解物添加量的增大,肌原纖維蛋白凝膠強度呈顯著下降趨勢(P<0.05)。推測低濃度牛骨膠原水解物混合添加到肌原纖維蛋白后,在加熱過程中發生共價交聯形成混合凝膠,使凝膠更加致密,進而增加凝膠強度。隨著高濃度牛骨膠原水解物的加入,反而干擾了肌原纖維蛋白的凝膠作用,進而導致凝膠強度下降。
2.7 微觀結構觀察
凝膠的內部結構是確定凝膠強度的最關鍵參數之一。不同牛骨膠原水解物對肌原纖維蛋白凝膠內部結構影響見圖7。由圖7a可見未添加牛骨膠原水解物的肌原纖維蛋白凝膠顯示出較松散且不規則的結構,其中包含有較大的空隙。隨著牛骨膠原水解物添加量不斷增多,肌原纖維蛋白凝膠結構開始發生改變,添加1%牛骨膠原水解物的肌原纖維蛋白凝膠,表現出緊密且有序的蛋白質網絡,且空隙更少(圖7b),這表明1%牛骨膠原水解物可有效抑制肌原纖維蛋白的降解,與此同時牛骨膠原水解物可能作為填充劑,在蛋白質網絡中均勻分配,從而導致內源蛋白酶引起的蛋白水解被抑制[34]。從毛細管現象的作用原理來看,這種結構均勻致密的蛋白質相互交聯網絡結構更有利于水分的保持[35]。這與其凝膠強度大、保水性好結果相符。

圖7 不同牛骨膠原水解物的肌原纖維蛋白凝膠電鏡圖Fig.7 Electron micrograph of myofibrillar protein gel of different bovine-bone collagen hydrolysates
隨著牛骨膠原水解物添加量的增多,肌原纖維蛋白凝膠所形成的網絡結構呈現出無序和松散的網絡,線條粗細不均勻,形成大小不同的空洞(圖7c~f)。這可能是因為在牛骨膠原水解物干擾了肌原纖維蛋白凝膠作用,使其凝膠內部作用力失去平衡,造成凝膠結構的空隙不斷增大,形成不規則的凝膠網狀結構,這也導致肌原纖維蛋白凝膠質的構特性和保水性降低[36?37]。
2.8 紅外光譜分析
紅外光譜能夠提供樣品中分子間和分子內部官能團相互作用的信息,對添加牛骨膠原水解物的肌原纖維蛋白凝膠特征吸收峰進行了歸屬,見圖8。酰胺A帶在3473 cm?1有最大吸收峰,且呈寬峰,這與氫鍵中的O-H振動伸縮有關。添加牛骨膠原水解物后,酰胺A帶在此波數下寬吸收峰出現一定程度的增強,氫鍵影響吸收峰的變化,這表明添加牛骨膠原水解物可能引起了凝膠體系氫鍵的增強,分析可能是牛骨膠原水解物具有的持水能力引起氫鍵的增加。肖旭華[38]研究米渣蛋白對鰱魚糜凝膠體系的影響時,得到與本試驗一致的結論。3060.89 cm?1處的吸收峰是酰胺B帶的C-N伸縮振動產生的,2923.96 cm?1處的吸收峰是酰胺B帶的CH2不對稱伸展振動產生的。
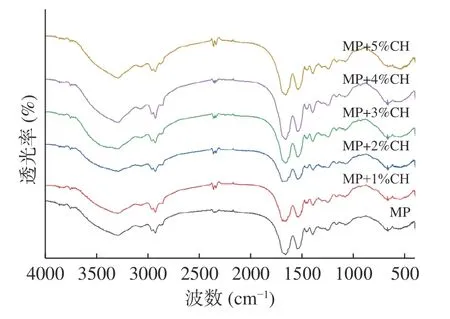
圖8 添加牛骨膠原水解物的肌原纖維蛋白紅外光譜圖Fig.8 Infrared spectra of myofibrillar protein added with bovine-bone collagen hydrolysate
1658.71 cm?1處是酰胺Ⅰ帶的C=O的伸縮振動產生的。1546.84 cm?1處歸屬于酰胺Ⅱ帶的C-N的伸縮振動和N-H的彎曲振動。1244.03 cm?1處歸屬于酰胺Ⅲ帶的C-H的伸縮振動和N-H的彎曲振動。添加牛骨膠原水解物后,肌原纖維蛋白凝膠在酰胺I區的吸收峰無顯著變化;在酰胺II區,肌原纖維蛋白凝膠的最大吸收峰波數發生藍移,這可能是由于蛋白質二級結構發生變化,骨膠原蛋白水解物與肌原纖維蛋白在疏水相互作用、氫鍵等作用下產生了一定的交聯[2]。
2.9 牛骨膠原水解物添加量對肌原纖維蛋白凝膠抗氧化性的影響
牛骨膠原水解物的抗氧化性結果如圖9所示。隨著牛骨膠原水解物添加量的增大,肌原纖維蛋白凝膠對ABTS自由基清除能力呈現增加的趨勢,分析增加的原因可能是酶解牛骨膠原蛋白后產生了大量含有抗氧化活性的氨基酸肽段,使得肌原纖維蛋白凝膠清除ABTS自由基能力增大[39]。當牛骨膠原水解物添加量在3%時,肌原纖維蛋白凝膠的抗氧化能力達到最高,清除率為26.04%。
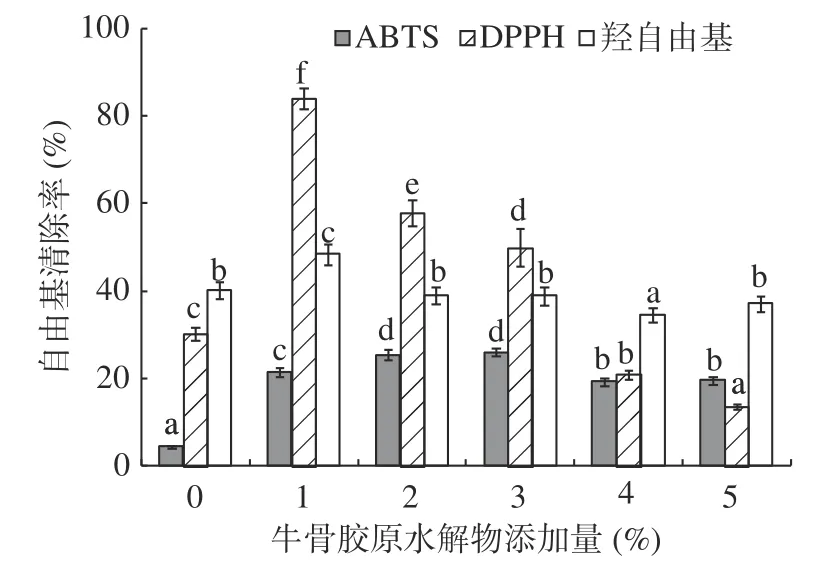
圖9 牛骨膠原水解物對肌原纖維蛋白凝膠ABTS、DPPH和羥自由基清除率的影響Fig.9 Effect of bovine-bone collagen hydrolysate on ABTS,DPPH and hydroxyl radicals scavenging rate of myofibrillar protein gel
DPPH是一類較穩定的芳香類自由基,DPPH也可以反映抗氧化物清除自由基的能力。隨著牛骨膠原水解物添加量的增加,蛋白凝膠清除DPPH自由基的能力呈現先增加后降低的趨勢。當牛骨膠原水解物添加量為1%時,其DPPH自由基清除率達到最高,為83.99%。可能添加該濃度的牛骨膠原水解物會更好地使蛋白分子展開,暴露出更多的疏水基團,使其更易與脂溶性的DPPH自由基反應,從而提升了DPPH自由基清除能力。Deng等[40]利用胃蛋白酶消化魚蛋白獲得的水解產物對DPPH自由基具有一定的清除作用,同時水解產物可明顯抑制冷藏南美對蝦肌原纖維蛋白的氧化。
隨著牛骨膠原水解物添加量的增大,肌原纖維蛋白凝膠對羥自由基的清除能力呈先升高后下降趨勢。在牛骨膠原水解物添加量為1%時,蛋白凝膠對羥自由基清除率達到最高,為48.35%。牛骨膠原水解物中含有的還原性氨基酸,對清除羥自由基具有一定的作用[13]。Zhang等[7]研究也發現,經胰蛋白酶和堿性蛋白酶酶解魚糜處理副產品(SPB),獲得的SPB水解物對silver魚魚糜具有較好的抗氧化作用。
3 結論
本實驗分析了牛骨膠原水解物加入鰱魚肌原纖維蛋白后巰基、表面疏水性、凝膠性能、微觀結構及抗氧化作用的變化。1%牛骨膠原水解物可減緩肌原纖維蛋白總巰基和表面疏水性的下降,保持較高的凝膠強度和保水力,掃描電鏡觀察也同樣顯現出致密的微觀結構。1%牛骨膠原水解物-肌原纖維蛋白凝膠抗氧化作用顯著(P<0.05),對DPPH自由基和羥自由基清除能力均達到最高,分別為83.99%和48.35%。低濃度牛骨膠原水解物具有抑制肌原纖維蛋白氧化和增強凝膠強度的作用,可以作為水和肉蛋白之間的粘合劑,應用于魚糜制品中。

