青錢柳調節糖脂代謝活性成分及作用機制的研究進展
陳曼雨,顧志良
(1.常熟理工學院生物與食品工程學院,常熟江蘇 215500;2.蘇州大學藥學院,蘇州江蘇 215123)
隨著生活方式,環境和飲食習慣的不斷變化,全世界范圍內的肥胖,與肥胖相關的非酒精性脂肪肝疾病(non-alcoholic fatty liver disease,NAFLD),胰島素抵抗和2型糖尿病(type 2 diabetes mellitus,T2DM)等糖脂代謝類疾病的患病率急劇上升[1?3]。國際糖尿病聯合會估計,全球年齡在20~79歲之間的成年人中,有9.3%(4.63億人)患有糖尿病,預計到2045年,這一數值將增加到7億,其中中國占1.472億[4]。除此之外,以脂代謝紊亂為特征的肥胖癥的患病率在過去約50年中,在全球范圍內呈上升趨勢,達到大流行水平,肥胖會大大增加代謝疾病的風險,如T2DM和脂肪肝疾病,無論是在個體還是在人群上,肥胖相關慢性代謝性病的預防和治療策略均未取得成功[5]。脂肪酸代謝紊亂和葡萄糖代謝受損之間存在密切的聯系。脂肪組織功能障礙時,通過增加非脂肪組織(如肝臟,骨骼肌,胰腺,心臟和腎臟)中過多的脂肪儲存,在胰島素抵抗和葡萄糖代謝受損的發展中起主要作用[6]。
天然植物中所含的一些成分可有效改善葡萄糖及脂肪酸代謝紊亂且具有毒性低的特點。青錢柳(Cyclocarya paliurus)是胡桃科青錢柳屬植物,主要分布于江蘇、安徽、浙江、江西、四川、貴州、云南東南部等地。功能性食品的安全性是首要考慮的一項標準,研究表明青錢柳葉水提物在劑量為10 g/kg體重對昆明小鼠沒有遺傳毒性作用,劑量為20 g/kg體重對大鼠沒有生殖毒性,相當于人體推薦劑量的150倍[7],安全性高和毒性低的特點推動了青錢柳的研究與開發。青錢柳含有多種活性成分,主要存在于葉片中,大多為多糖、三萜、黃酮、酚酸等。青錢柳對葡萄糖及脂肪酸代謝的作用一直是研究熱點,且調節糖脂代謝具有多成分、多靶點、多途徑的特點。從2013年10月,國家衛計委批準青錢柳葉作為新食品原料,對青錢柳的研究熱度大大增加。因此,本文結合近年來國內外研究現狀,對青錢柳調節糖脂代謝的活性成分及作用機制進行綜述,以期為青錢柳資源開發及臨床應用提供進一步參考。
1 調節糖脂代謝的藥效物質基礎
1.1 多糖
多糖是青錢柳發揮調節糖脂代謝作用的主要活性成分之一,研究集中在分離純化、含量測定及單糖組成方面(具體見表1)。目前在青錢柳多糖中檢測到的單糖包括鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖、半乳糖等,不同的分離純化方法,得到的多糖含量及單糖組成不同,都具有改善糖脂代謝的作用[8?11]。體內外實驗表明在含量在60%~95%范圍內的多糖可改善大鼠肥胖及胰島素抵抗[12],改善脂質代謝紊亂[13?15],增加葡萄糖消耗的作用[16]。此外,青錢柳多糖可抑制α-葡萄糖苷酶活性[16?19],降低糖尿病大鼠血糖水平[20]。
1.2 三萜
目前已從青錢柳中分離得到近40種三萜類化合物,多數為烏蘇烷型、齊墩果烷型和達瑪烷型三萜皂苷,其中最主要的是包括烏蘇烷型和齊墩果烷型在內的五環三萜。從青錢柳氯仿或乙醇提取物中分離得到的多種三萜類單體化合物(具體見表1)可促進葡萄糖攝取[21?22],改善脂質代謝[23?25]。除此之外,青錢柳總三萜也被證明具有改善糖脂代謝紊亂的作用[26?27]。除表1中所列單體成分外,還含有β-香樹脂醇、熊果酸、齊墩果酸、白樺脂酸、β-乳香酸、馬斯里酸、山楂酸、2α,3α,23-三羥基烏蘇-12,20(30)-二烯-28-齊墩果酸、2α,3α,23-三羥基烏蘇-12-烯-28-齊墩果酸、3β,23-二羥基-12-烯-28-熊果酸、2α,3β,23-三羥基熊果酸-12,20(30)-二烯-獼猴桃酸、2α,3β,23-三羥基熊果酸-11,13(18)-二烯-28-齊墩果酸、3β,23-二羥基-12-烯-28-熊果酸[26,28?31],但未發現它們調節糖脂代謝的相關研究。
1.3 黃酮
黃酮作為青錢柳葉片中主要活性成分之一,對調節糖脂代謝起到十分重要的作用。從青錢柳葉中分離得到的黃酮基本母核多為黃酮醇類,其中山奈酚和槲皮素為最主要的成分,糖苷配基部分以葡萄糖、鼠李糖和葡糖醛酸為主[32?34](具體見表1)。段玉書等[35]發現從青錢柳葉中分離得到的兩種黃酮類化合物阿福豆苷和山柰酚3-O-(4″-O-乙酰基) -α-L-吡喃鼠李糖苷在體外具有抑制α-葡萄糖苷酶的作用。此外,研究發現青錢柳總黃酮具有改善大鼠肝臟脂質沉積[33],調節肥胖小鼠腸道微生物[34],降低糖尿病小鼠血糖水平[36],改善胰島素抵抗的作用[37]。
1.4 酚酸
青錢柳葉中的酚酸多數為綠原酸、隱綠原酸、奎寧酸等[32,38]。Xiao等[32]檢測到青錢柳水提物中含有 1-咖啡酰奎寧酸(1.4 mg/g)、5-咖啡酰奎寧酸(1.5 mg/g)、綠原酸(4.0 mg/g)。Yoshitomi等[38]采用高效液相色譜分析測定青錢柳提取物中綠原酸,隱綠原酸和槲皮素-3-O-β-D-葡萄糖醛酸苷的濃度分別為1.83%,1.02%和29.12%。Zhang等[39]發現從青錢柳葉中分離得到的酚酸類化合物(槲皮素-3-O-β-D-葡糖醛酸、楊梅素-3-O-β-D-葡糖醛酸、咖啡酸)可抑制參與胰島素信號通路的蛋白質酪氨酸磷酸酶1B活性。
2 調節糖代謝的作用機制
2.1 保護胰島細胞
胰島作為分泌胰島素、調節血糖最關鍵的組織,其結構的完整和生理功能的正常發揮在調節葡萄糖穩態上起著重要作用。綜合目前的研究表明青錢柳葉主要從兩方面保護胰島細胞:一是抑制胰腺β細胞凋亡,減輕由凋亡引起的細胞損傷;二是減少活性氧(reactive oxygen species,ROS)生成,保護胰島細胞免受氧化應激損傷。
Li等[40]采用高脂飲食(high fat diet,HFD)聯合低劑量鏈脲佐菌素(streptozotocin,STZ)構建糖尿病大鼠模型,通過對胰腺組織轉錄組分析,發現一些調節胰腺β細胞功能的關鍵基因的表達水平在青錢柳水提物給藥時顯著改變,例如DNA損傷誘導轉錄本4(DNA-damage-inducible transcript 4,Ddit4),成纖維細胞生長因子21(Fibroblast growth factor,Fgf21)和胰島素家族成員,通過GO富集分析發現與細胞凋亡相關,如上調細胞凋亡過程的負調控。Xiao等[32]發現青錢柳提取物增加糖尿病小鼠胰島β細胞數量,減少β細胞凋亡,用STZ誘導NIT-1細胞構建胰腺β細胞的體外凋亡模型,發現其可抑制NIT-1細胞凋亡。
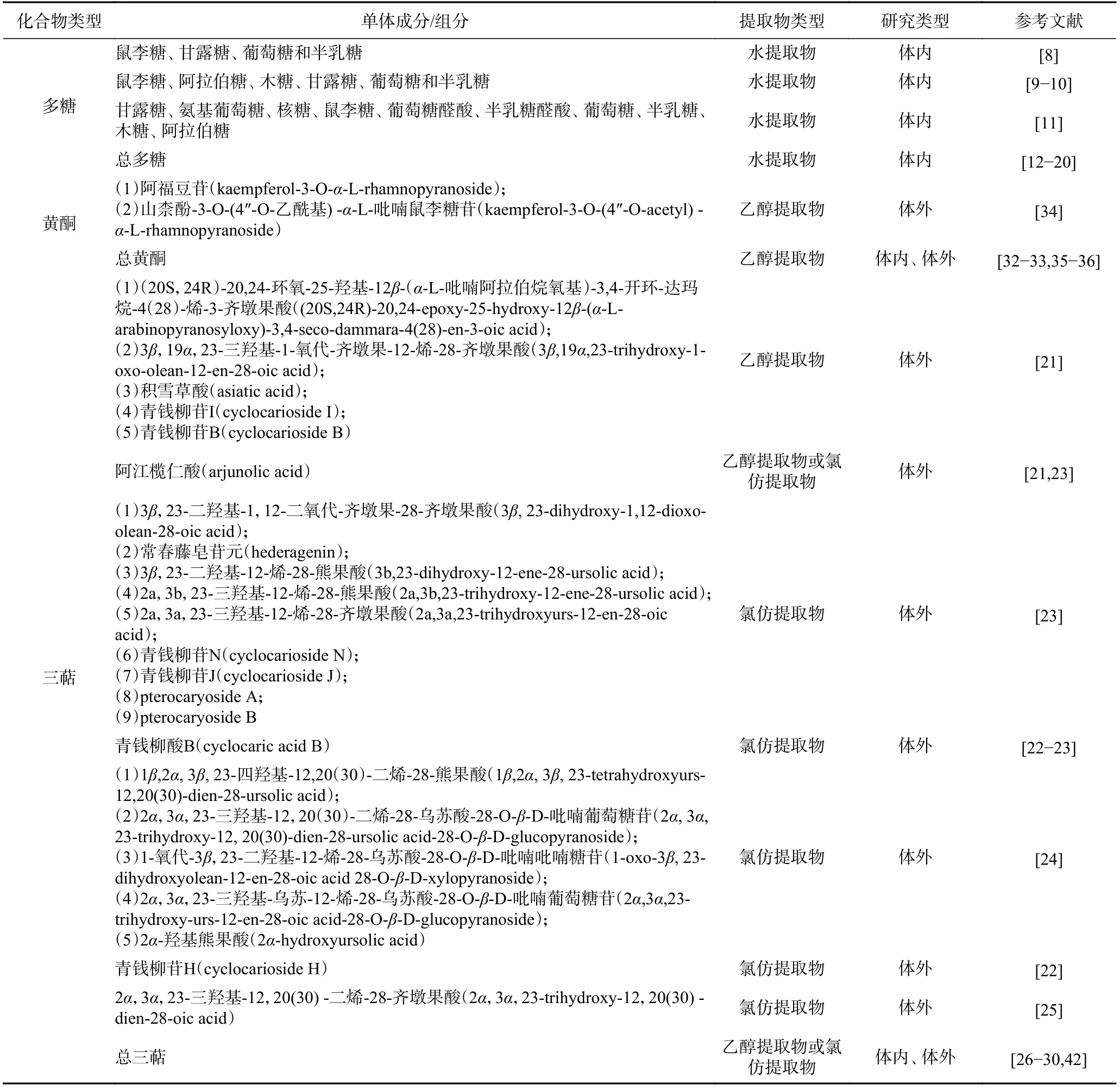
表1 青錢柳改善糖脂代謝的物質基礎Table 1 The material basis of Cyclocarya paliurus improving glucose and lipid metabolism
此外,青錢柳三萜對胰島細胞的保護作用與其減輕氧化損傷有關。周琴等[28]發現青錢柳三萜抑制INS-1細胞ROS產生,增強超氧化物歧化酶(superoxide dismutase,SOD)、過氧化氫酶(catalase,CAT)、谷胱甘肽過氧化物酶(glutathione peroxidase,GSH-Px)的活性,上調抗凋亡蛋白Bcl-2水平,下調促凋亡Bax、caspase-9和caspase-3水平,進而提高細胞存活率。此外,胰腺轉錄組分析表明青錢柳多糖可下調與線粒體和脂肪酸代謝過程相關的基因,從而減少ROS的產生并減輕氧化應激損傷[11]。
2.2 調節胰島素信號通路
胰島素與胰島素受體(insulin receptor,IR)結合后,可激活胰島素受體底物(insulin receptor substrate,IRS),使其酪氨酸磷酸化增加,通過調節磷脂酰肌醇3激酶(phosphoinositide 3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)磷酸化水平調節血糖[41]。綜合目前的研究發現,青錢柳可改善多個組織或細胞的胰島素信號傳導,如肝臟、肌肉組織、脂肪細胞及胰島細胞。青錢柳水提物可上調糖尿病大鼠肝臟IR、IRS2 mRNA水平,降低其血糖水平[42]。除肝臟外,Jiang等[43]發現青錢柳乙醇提取物抑制小鼠肌肉組織IRS-1絲氨酸磷酸化,有效恢復IRS-1酪氨酸磷酸化和下游Akt磷酸化,改善胰島素信號傳導。體外實驗中,發現青錢柳乙醇提取物及三萜類化合物抑制3T3-L1細胞IRS1絲氨酸磷酸化,增加IRS1酪氨酸及Akt磷酸化[22]。青錢柳三萜還可增加高糖誘導的胰島α細胞IRS1/PI3K/Akt磷酸化,而PI3K抑制劑渥曼青霉素可逆轉這一作用[44]。除此之外,組蛋白去乙酰化酶1(Sirtuin 1,Sirt1)也參與IRS1酪氨酸磷酸化的激活和絲氨酸磷酸化的抑制,Yoshitomi等[38]發現青錢柳提取物增加C2C12細胞中Sirt1活性以活化PI3K/Akt,改善胰島素信號傳導。
2.3 促進葡萄糖利用
胰島β細胞釋放胰島素,促進葡萄糖攝取進入肝臟、脂肪及肌肉組織細胞中,增加葡萄糖的消耗,維持血糖的穩定[45]。在正常及炎癥條件下,青錢柳均可獨立于胰島素,促進3T3-L1脂肪細胞中葡萄糖消耗,提示青錢柳具有類胰島素樣作用[43]。同樣發現在沒有胰島素刺激時,青錢柳三萜促進3T3-L1細胞葡萄糖攝取,改善葡萄糖消耗[22]。葡萄糖轉運蛋白4(glucose transporter 4,Glut4)在促進肌肉和脂肪組織中的葡萄糖吸收中起重要作用,Glut4易位至細胞膜可刺激葡萄糖攝取進入細胞。Yoshitomi等[38]發現青錢柳提取物在沒有胰島素的刺激下,增加C2C12細胞AS160磷酸化,促進Glut4易位,導致葡萄糖攝取增加。
在胰島素刺激時,青錢柳同樣具有促進葡萄糖攝取利用的作用。Fang等[21]發現青錢柳三萜增強胰島素刺激的C2C12和3T3-L1細胞葡萄糖攝取,增加3T3-L1細胞中AMP活化蛋白激酶(AMPactivated protein kinase,AMPK)及其下游信號p38的磷酸化,以增強脂肪細胞中胰島素刺激的葡萄糖攝取。
除此之外,體內外研究表明青錢柳多糖、黃酮可通過抑制α-葡萄糖苷酶活性,減慢碳水化合物吸收,降低餐后血糖[16,17,19,35,36]。
2.4 抑制炎癥反應
慢性炎癥是糖尿病自然病程中的常見特征,炎癥物質(例如:腫瘤壞死因子-α(tumor necrosis factor α,TNF-α),白介素(interleukin,IL)-6和抵抗素)的過度分泌會推動糖尿病的進程[46]。青錢柳乙醇提取物通過降低小鼠脂肪組織分泌的炎癥細胞因子TNF-α、IL-6、單核細胞趨化蛋白1(Monocyte chemoattractant protein-1,MCP-1)、抵抗素水平,增加脂聯素水平,抑制炎癥反應[43]。最近一項研究表明,青錢柳三萜給藥后,降低db/db小鼠血清IL-1β,IL-6和TNF-α的水平,抑制Rho相關卷曲螺旋蛋白激酶(Rho-associated coiled-coil-containing protein kinase,ROCK)信號傳導,在db/db小鼠肝臟及棕櫚酸誘導的HepG2細胞中觀察到,青錢柳三萜顯著抑制了Rho / ROCK /核轉錄因子κB(nuclear factor-κB,NF-κB)信號傳導,表明其通過Rho/Rock/NF-κB信號通路抑制糖尿病引起的肝炎[26]。
2.5 調節miRNAs表達
microRNAs(miRNAs)作為主要的轉錄調節因子,在多種生物過程中發揮至關重要的作用,例如,miR-29的失調影響了糖尿病患者骨骼肌中的葡萄糖代謝[47]。Li等[40]通過HFD-STZ構建糖尿病大鼠模型,對肝臟進行miRNA測序及差異表達分析,顯示miR-200和miR-375的表達隨著青錢柳水提物干預而下調,從而減少氧化損傷以保護肝臟。在另一項研究中,發現青錢柳多糖通過上調miR-199a-5p/miR-31a-5p保護糖尿病大鼠肝臟免受氧化應激和細胞凋亡[11]。
2.6 免疫調節作用
免疫細胞數量和功能改變會導致糖尿病患者自身免疫激活,進而削弱β細胞的胰島素分泌并促進高血糖的發生[48]。硒元素是人體必需的微量元素,與糖尿病存在密切關系,相比于單獨亞硒酸鈉或青錢柳多糖處理,富硒青錢柳多糖可以更好地提高糖尿病小鼠胸腺指數,增強脾淋巴細胞增殖,改善免疫力[49]。另一方面,青錢柳水提物給藥后可抑制以環磷腺苷(cyclic adenosine monophosphate,cAMP))/環磷鳥苷(cyclic guanosine monophosphate,cGMP)比值升高和內分泌激素T3、T4水平增加的糖尿病大鼠內分泌免疫功能亢進[50]。
綜上,青錢柳主要通過保護胰島細胞、調節胰島素信號通路、抑制炎癥反應、調節miRNAs表達以及免疫調節作用改善糖代謝紊亂。
3 調節脂代謝的作用機制
3.1 調節脂代謝相關基因表達及酶的水平
3.1.1 抑制脂肪酸合成或脂肪生成 肝臟脂質利用或輸出,以及脂質攝取或合成之間的不平衡可導致肝臟脂肪變性的發生。甾醇調節元件結合蛋白1c(sterol regulatory element-binding protein 1c,SREBP-1c)通過調節其下游基因表達,例如脂肪酸合成酶(fatty acid synthase,FAS)、乙酰輔酶A羧化酶1(acetyl-CoA carboxylase 1,ACC-1),在肝臟脂肪生成中起重要作用[51]。Lin等[27]通過HFD誘導大鼠肝脂肪變性,發現青錢柳三萜降低SREBP1、ACC1、FAS 蛋白水平和mRNA表達,改善肝脂肪沉積。在細胞模型中,許光遠等[52]采用游離脂肪酸誘導H4-ⅡE細胞脂質沉積,發現青錢柳總皂苷通過上調AMPK、ACC蛋白磷酸化水平,下調SREBP1c、FAS mRNA表達,減少了H4-IIE細胞中脂質沉積。此外,青錢柳多糖也可下調高脂血癥大鼠肝臟FAS mRNA水平[14]。
過氧化物酶體增殖物激活受體γ(peroxisome proliferator-activated receptor gamma,PPARγ)和CCAAT /增強子結合蛋白α(CCAAT/enhancer binding proteinα,C/EBPα)是脂肪形成中的關鍵轉錄因子,它們正調控著彼此的表達[53]。Hu等[9]研究發現青錢柳多糖下調HFD所致高脂血癥大鼠肝臟C/EBPα、PPARγ蛋白水平和mRNA表達,以抑制內臟脂肪細胞的過度肥大。
3.1.2 促進脂肪分解 脂蛋白脂肪酶(lipoprotein lipase,LPL)和激素敏感性脂肪酶(hormone-sensitive lipase,HSL)是參與脂肪分解的兩個關鍵酶[54]。胡文兵等[55]研究發現青錢柳多糖通過增加高脂血癥小鼠肝臟HSL mRNA水平,促進脂肪分解代謝。此外,青錢柳多糖還通過增加肝臟LPL和HSL活性,降低高脂血癥大鼠血清脂質含量[9]。
脂肪甘油三酯脂肪酶(adipose triglyceride lipase,ATGL)是繼HSL后另一個發現的控制脂質分解和介導甘油三酯水解的限速酶,可將甘油三酯轉化為一分子游離脂肪酸和一分子二酰基甘油[56]。青錢柳多糖干預高脂血癥小鼠后,小鼠肝臟和脂肪組織中ATGL mRNA水平升高,進而降低小鼠血脂水平[57]。
3.1.3 調控膽固醇代謝 高脂血癥是一種脂質代謝紊亂的疾病,以膽固醇、甘油三酯升高為特征,膽固醇生物合成的限速酶羥甲基戊二酰輔酶A(3-hydroxy-3-methylglutaryl-coenzyme A,HMG-CoA)還原酶,其活性下調將抑制肝臟中的膽固醇合成[58]。而 膽 固 醇7α-羥 化 酶(cholesterol 7α-hydroxylase,CYP7A1)催化膽固醇分解代謝和膽汁酸合成的最初步驟。Jiang等[59]采用HFD誘導小鼠高脂血癥,發現青錢柳氯仿及乙醇提取物可抑制HMG-CoA還原酶活性,同時增加CYP7A1活性以及糞便和肝臟膽汁酸水平。此外,青錢柳多糖也可降低高脂血癥大鼠肝臟HMG-CoA還原酶的mRNA水平[10]。
3.1.4 抑制載脂蛋白apoB48 載脂蛋白B48(apolipoprotein B 48,apoB48)在外源脂質的攝取過程中起重要作用,據報道,TNF-α會誘導腸道衍生含apoB48的脂蛋白過度生成[60]。研究發現青錢柳乙醇提取物和三萜通過抑制TNF-α誘導的絲裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)磷酸化,抑制apoB48生成,發揮抗高血脂作用[31,61,62]。Wu等[23]還發現青錢柳三萜化合物顯著減少了油酸誘導的Caco-2細胞中apoB48的過度分泌。
綜上,青錢柳可以通過調節脂肪酸合成或脂肪生成、脂肪分解、膽固醇代謝相關基因表達及酶的水平,以及抑制與脂質攝取有關的載脂蛋白apoB48蛋白水平,改善脂代謝紊亂。
3.2 改善胰島素抵抗
肝臟和肌內甘油三酯含量的增加通常伴隨胰島素抵抗的發生,過量脂肪酸代謝會產生脂質產物,從而減弱胰島素信號[63]。Xu等[12]發現青錢柳水提物可減輕SHR/cp大鼠肥胖和胰島素抵抗,其抗肥胖功能的機制可能是通過激活大鼠下丘腦中胰島素信號傳導(IRS/PI3K/Akt),從而抑制過量能量攝入。在HFD誘導的C57BL / 6J小鼠中,青錢柳三萜增強了PI3K、Akt和糖原合酶3β(glycogen synthase-3β,GSK3β)的磷酸化,在棕櫚酸誘導的HepG2細胞模型中被PI3K抑制劑LY294002逆轉,表明青錢柳三萜可能通過調節PI3K / Akt /GSK3β途徑,改善小鼠胰島素抵抗,對NAFLD發揮治療作用[30]。此外,結合脂質組學發現青錢柳水提物可調節糖尿病小鼠血清中包括膽固醇酯、甘油二酯在內的30種脂質代謝,通過網絡藥理學分析預測可能是通過PI3K信號傳導發揮作用[64]。
3.3 抑制脂質過氧化
研究發現,青錢柳多糖或乙醇提取物均可以通過降低丙二醛(malondialdehyde,MDA)或脂質過氧化物水平,增加抗氧化酶SOD、GSH-Px活性,改善高血脂小鼠氧化應激,減少肝臟脂肪變性,降低血脂水平[8,61]。體外實驗中,游離脂肪酸誘導HepG2細胞脂質過氧化,青錢柳三萜類化合物顯著增加SOD活性并降低MDA水平[24]。在HFD誘導的Wister大鼠模型中,青錢柳三萜通過上調血紅素加氧酶1(heme oxygenase 1,HO-1)、奎寧氧化還原酶1(quinine oxidoreductase 1,NQO1)表達,改善氧化應激[65]。在游離脂肪酸誘導的HepG2細胞模型中,同樣觀察到青錢柳三萜增加抗氧化相關蛋白HO-1、NQO-1水平[25]。
3.4 保護線粒體功能
線粒體功能受損可導致NAFLD大鼠線粒體呼吸鏈復合物活性下降和線粒體膜電位(mitochondrial membrane potential,MMP)水平降低,肝細胞色素P450酶2E1(hepatic cytochrome P450 enzyme 2E1,CYP2E1)被激活用于脂肪酸氧化,CYP2E1的過表達可誘導過量的ROS產生,導致NAFLD發展[66]。Zhao等[65]通過HFD誘導Wister大鼠NAFLD,并用游離脂肪酸誘導HepG2細胞脂質沉積,青錢柳三萜干預后,增加大鼠肝臟及HepG2細胞MMP和ATP水平,抑制CYP2E1的表達,恢復了HepG2細胞中線粒體復合物I和IV的活性,通過激活核因子相關因子 2(nuclear factor erythroid 2-related factor 2,Nrf2)改善線粒體功能障礙。在脂多糖(lipopolysaccharide,LPS)/ D-半乳糖胺(D-galactosamine,DGalN)誘導的急性肝衰竭大鼠模型中,發現青錢柳黃酮顯著抑制ROS的產生和MMP的喪失,減輕肝細胞凋亡和線粒體功能障礙[33]。
3.5 其他
腸道微生物對肥胖、糖尿病、NAFLD等代謝類疾病的調節作用一直是近年來研究的熱點,腸道菌群產生的部分代謝產物在預防和治療肥胖癥及其合并癥中具有有益作用[67]。在最近的一項研究中,將成年人糞便微生物群移植到無菌小鼠中,通過高通量測序發現青錢柳黃酮增加肥胖小鼠的糞便微生物群多樣性,調節微生物組成,發揮針對HFD誘導的肥胖的保護作用[34]。此外,DNA甲基化在肥胖和高脂血癥中起重要作用,Yang等[68]表明青錢柳多糖可以降低HFD誘導的SD大鼠瘦素和微粒體甘油三酯轉移蛋白(microsomal triglyceride transfer protein,MTTP)啟動子的DNA甲基化水平,調節其mRNA表達。
綜上,青錢柳通過調節脂代謝相關基因表達及酶的水平、改善胰島素抵抗、抑制脂質過氧化、保護線粒體功能,發揮對脂代謝紊亂的改善作用,除此之外,青錢柳調節脂代謝還與調節腸道微生物及DNA甲基化相關。
4 結語
肥胖、糖尿病、NAFLD等以糖脂代謝紊亂為特征的代謝類疾病的發生發展,已成為影響人們健康和社會經濟的主要問題。青錢柳作為中國特有的單種屬植物,具有多種生物活性。其與調節糖脂代謝相關的主要功能成分為多糖、三萜、黃酮、酚酸等。近年研究表明青錢柳可通過保護胰島β細胞、調節胰島素信號通路、促進葡萄糖利用、抗炎抗氧化等改善糖代謝紊亂,發揮降血糖的作用;通過調節脂代謝相關基因表達及酶的水平、抗氧化、保護線粒體功能等改善脂代謝紊亂,發揮降低血脂及減少肝臟脂質含量的作用。
青錢柳分布較廣,不同產地、溶劑極性,或提取方法的不同造成的主要成分差異大,作為新食品原料,需要進一步確定其活性成分組成及含量。但是青錢柳中的成分復雜多樣,調節糖脂代謝具有多靶點、多途徑的特點,而且進行機制研究的多數為提取物,單體成分主要是體外研究,因此需要進行動物實驗或臨床驗證,深入探究具體的分子作用機制。其次,雖已有大量動物實驗證明青錢柳提取物具有改善糖脂代謝紊亂的作用,目前臨床樣本依然較少,缺乏臨床數據的支撐。
今后可從以下幾個方面進一步研究:增加人群樣本,盡可能增加人群試食試驗研究,為青錢柳作為功能性食品的開發利用提供指導,并利用轉錄組學、代謝組學、腸道微生物測定等先進技術,進一步探究青錢柳調節糖脂代謝具體的作用機制;深入研究青錢柳發揮作用的物質基礎,以開發成分的組成及含量可控且規范化的產品;明確發揮生物活性的最適劑量,與其他具有相似活性的天然產物配伍以獲得協同作用。

