miR-145-3p靶向HDAC4調控人牙周膜成纖維細胞的自噬機制研究
楊正祥 謝陸莉 鄧琳 王瑜
正畸牙齒時移動的基礎是牙周組織進行改建,在該過程中牙周膜發揮橋梁的重要作用,其最先能夠感受到外界的作用力并且將該力傳導至牙槽骨。牙周膜成纖維細胞(periodontal ligament fibroblasts,PDLFs)是牙周膜中最主要的一種細胞,是牙周組織的再生以及形成新的附著的一種重要成分[1]。但是在牙周遭受創傷或者炎癥時,牙周膜的再生細胞數量的減少以及其生物學功能的減弱阻礙了該牙周組織完全再生的能力[2]。自噬(Autophagy)即Ⅱ型程序性死亡,是一種新的細胞程序性死亡方式,對維持細胞內環境的穩定有重要作用。在該過程中,細胞中多余的或功能障礙的細胞器、蛋白質等經過溶酶體進行降解[3]。MicroRNAs(miRNA)是一種長度約22 nt的內源性表達的非編碼RNA,在轉錄調控的過程中具有重要作用,能夠與靶基因互相作用而調控基因的表達,參與細胞的生物學過程[4]。miR-145是新發現的一種miRNA,包括miR-145-3p和miR-145-5p兩種結構,可以調控多種細胞的生物學過程[5]。本研究探討miR-145-3p對HPDLFs細胞自噬過程的影響及其可能存在的作用機制。
1 材料與方法
1.1 HPDLFs的采集及培養 收集12~18歲因正畸需要減數而拔除的健康前磨牙,立即放入含有青-鏈霉素的預冷的DMEM培養液中。取牙根1/3處的牙周膜組織,加入4 ml含0.5 g/L胰蛋白酶的DMEM培養液于37℃恒溫培養箱中消化20 min。然后用不含血清的DMEM培養液洗1次棄去上清,將組織塊置于35 mm的培養皿中,并加入含有200 ml/L胎牛血清的DMEM培養液,將組織塊上覆蓋一片無菌蓋玻片保證組織塊與蓋玻片之間的培養液充盈。37℃ CO2培養箱孵育4 h后,加1~2 ml培養液,繼續培養,每3天換1次液。待細胞鋪滿培養皿底大約80%時,進行首次傳代。按1∶3細胞計數傳代,取第5代HPDLFs用于后續實驗。
1.2 材料與儀器
1.2.1 材料:DMEM培養基購自美國Hyclone公司;胎牛血清(fetal calf serum,FBS)購自美國Gibco公司;miR-145-3p-mimic、miR-145-3p-inhibitor和miR-145-3p-NC由廣州銳博生物公司合成;Lipofectamine 2000購自美國Invitrogen公司;青-鏈霉素、胰蛋白酶購自美國Sigma公司;蛋白定量試劑盒、Western Blot發光液購自美國Thermo公司;兔抗波形蛋白、鼠抗泛細胞角蛋白、兔抗Beclin-1、P62、LC3、HDAC4以及鼠抗GAPDH均購自美國Abcam公司;免疫組織化學試劑盒購自武漢博士德生物。
1.2.2 儀器:雙人水平超凈工作臺(上海巴玖實業有限公司);二氧化碳細胞孵育箱(美國Thermo公司);低溫高速離心機(美國Thermo公司);DYC-p32型電泳儀(上海巴玖實業有限公司);轉膜儀(南京生興生物經濟技術有限公司);倒置熒光顯微鏡(DMIL LED Fluo;德國Leica公司);熒光顯微鏡(日本Olympus,BX63)、BIO-RADChemiDOC凝膠成像系統(美國BIO-RAD公司)。
1.3 HPDLFs的鑒定 將HPDLFs的第5代細胞用2.5 g/L胰蛋白酶消化,消化的細胞以2×104個/ml接種在培養皿中的蓋玻片上,待蓋玻片上長滿單層細胞后取出備用。用無菌的PBS溶液洗去蓋玻片上的培養液,用0.4 g/L的多聚甲醛固定液固定20 min,然后用PBS溶液洗3次,吹干,免疫組織化學染色法鑒別波形絲蛋白(vimentin)和角蛋白(Keratin),倒置熒光顯微鏡觀察、拍照。
1.4 細胞轉染 取上述消化好的HPDLFs以2×104個/ml接種在6孔板中,繼續培養4 h,用Lipofectamine 2000轉染試劑盒將miR-145-3p類似物(miR-145-3p-mimics)、miR-145-3p抑制物(miR-145-3p-inhibitor)和陰性對照(miR-145-3p normal control,miR-145-3p-NC)轉染至HPDLFs,轉染48 h。
1.5 質粒轉染 按照Lipofectamine 2000轉染試劑盒說明書,在上述1.4轉染好的細胞中進行帶有GFP-LC3的質粒轉染,加樣后避光靜置15 min,然后加入到盛有400 μl新鮮無血清DMEM培養液的6孔板中,轉染4 h后再加入完全培養基500 μl,24 h后觀察熒光。對10個不同視野的200個細胞計數進行統計分析,Student’st-檢驗分析顯著性差異。每組設置3個復孔,取平均值。
1.6 免疫熒光染色方法檢測細胞自噬 將轉染后的細胞用預冷多聚甲醛在4℃下固定30 min,用質量分數為0.1%的吐溫處理10 min,PBS洗滌,室溫下封閉30 min,加入LC3一抗(1∶100),4℃孵育過夜,PBS洗滌細胞后,加入二抗(1∶1 000),室溫孵育1 h,熒光封片劑封片,顯微鏡下觀察LC3陽性細胞占細胞總數的百分比。每個切片任意選取5個視野。
1.7 Western Blot檢測細胞內相關蛋白表達 將各組細胞轉染48 h后,RIPA裂解液提取總蛋白,將蛋白樣品加入SDS-PAGE凝膠的加樣孔進行電泳,使蛋白轉移至PVDF膜,5%脫脂奶室溫封閉2 h,TBST溫和洗滌3 min后加入相對應的一抗,4℃孵育過夜,TBST洗滌10 min×3次,加入二抗,室溫下孵育1 h,TBST洗滌10 min×3次,加入配制好的ECL發光液,避光孵育5 min,化學發光凝膠成像儀中采集圖片信息,圖片用Image pro plus 6.0軟件進行灰度分析。每個實驗結果獨立重復3次。
1.8 靶基因預測及雙熒光素酶報告基因分析 利用miRanda、TargetScan數據庫預測miR-145-3p的潛在靶基因,其中HDAC4在miR-145-3p的3’-UTR上有結合位點。將第5代細胞以2×104個/ml接種于24孔板,用LipofectamineTM2000將熒光素酶報告載體(HDAC4-3’-UTR-WT或HDAC4-3’-UTR-Mut)與miR-145-3p-mimics/inhibitor/NC共轉染細胞,以Renilla熒光素酶質粒(100 ng/孔)為對照,與載體共轉染。轉染24 h后,用雙熒光素酶報告分析系統(Promega)檢測熒光素酶活性。

2 結果
2.1 HPDLFs的鑒定 免疫組化染色結果表明,成纖維細胞標記物波形蛋白為陽性染色,在胞質內陽性顆粒均勻分布,胞漿染為棕黃色,胞核清晰并無染色;而來源于中胚層的角蛋白呈陰性染色,證明其為間質細胞,且無混雜上皮來源細胞。見圖1。

波形蛋白陽性染色 角蛋白陰性染色
2.2 MiR-145-3p過表達誘導HPDLFs自噬 帶有GFP-LC3的質粒在細胞中轉染成功后,細胞中表達的自噬小體標記物LC3蛋白會發出綠色熒光。結果顯示,miR-145-3p-inhibitor組細胞內有極其微弱的熒光,Blank和miR-145-3p-NC組細胞內熒光強度強于miR-145-3p-inhibitor組(P<0.05),而轉染miR-145-3p-mimics的細胞內熒光強度最高,有大量自噬體形成。見圖2,表1。

圖2 MiR-145-3p誘導HPDLFs自噬

表1 GFP-LC3陽性細胞百分比
2.3 4組轉染細胞內Beclin-1、P62和 LC3的蛋白表達 P62蛋白在miR-145-3p-inhibitor組細胞內表達顯著高于其他3組(P<0.05),而在Blank組、miR-145-3p-mimics組和miR-145-3p-NC組間蛋白表達差異無統計學意義(P>0.05);miR-145-3p-mimics組細胞內Beclin-1和LC3蛋白表達顯著高于其他3組(P<0.05),而在Blank組、miR-145-3p-NC組和miR-145-3p-inhibitor組間蛋白表達差異無統計學意義(P>0.05)。見表2,圖3。
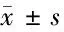
表2 Western Blot檢測細胞內Beclin-1、P62和 LC3的蛋白表達

圖3 Western Blot檢測細胞內Beclin-1、P62和 LC3的蛋白表達
2.4 MiR-145-3p靶基因預測 為確定MiR-145-3p在HPDLFs中發揮生物學功能的靶向作用點,我們使用TargetScan、miRanda等篩選MiR-145-3p潛在的下游靶向蛋白,預測發現MiR-145-3p與HDAC4在3’-UTR可能具有靶向調節關系,HDAC4是MiR-145-3p的一個潛在作用靶點。使用雙熒光素酶報告系統研究MiR-145-3p能否與去乙酰化酶4(histone deacetylase 4,HDAC4)的3’-UTR位點結合,結果顯示,MiR-145-3p能夠與HDAC4基因3’-UTR結合,并抑制熒光素的表達,而在轉染突變載體的細胞內沒有觀察到明顯的熒光素酶活性改變,表明HDAC4是MiR-145-3p的直接靶向蛋白。同時,我們用Western Blot檢測了4組轉染MiR-145-3p基因的細胞內HDAC4蛋白表達情況,結果顯示,轉染miR-145-3p-mimics的細胞內HDAC4的表達顯著低于其他3組(P<0.05),而Blank組、轉染miR-145-3p-NC和miR-145-3p-inhibitor組細胞內HDAC4的表達無顯著性差異。見表3、4,圖4、5。
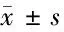
表3 免疫熒光活性
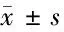
表4 Western Blot檢測細胞內HDAC4蛋白表達

圖4 生物信息軟件檢測HDAC4和MiR-145-3p潛在的結合位點

圖5 Western Blot檢測轉染MiR-145-3p基因的蛋白表達
3 討論
作為miRNA基因家族的成員之一,miR-145也是抑癌基因,在細胞的轉移、侵襲、分化、增殖及凋亡等過程中發揮調控作用[6]。研究表明,人皮膚鱗癌的A431細胞中,miR-145通過靶向中性粒細胞胞漿因子2和IL-2調控JAK/STAT通路從而調節表皮生長因子誘導凋亡[7]。再者,miR-145能夠靶向BNIP3(Bcl-2/E1B-19kDa 相互作用蛋3)以調控細胞的凋亡、線粒體功能異常、ROS等,最終調控線粒體的凋亡信號通路[8]。任明亮等[9]研究表明,miR-145-3p在多發性骨髓瘤中呈現出低表達的趨勢,可能是通過靶向激活P21以及抑制ULK1/LAMP2通路而促進多發性骨髓瘤細胞的自噬、凋亡作用。但是miR-145-3p在人牙周膜成纖維細胞中的作用機制尚不清楚。本研究中,我們首先鑒定了提取的原代細胞,以保證HPDLFs細胞系無其他來源細胞,確保后續實驗順利進行。實驗結果表明,miR-145-3p在HPDLFs細胞中可調控自噬,這種作用可能是通過靶向抑制HDAC4表達實現的。
自噬是在真核生物中廣泛存在的維持自身穩定的機制,通過和溶酶體的互相作用,在自噬有關基因和信號分子參與下,進行降解自身過多或受損的細胞器、蛋白質等從而為細胞的生物合成提供原料和能量,對細胞分化、發育以及內環境的穩定提供重要的保障[10]。Wu等[11]曾證實miR-145-3p能夠通過靶向HDAC4抑制增殖并促進骨肉瘤細胞凋亡和自噬,但對HPDLFs細胞的自噬是否有調控作用尚未可知。LC3(Microtubule-associated protein light chain 3)蛋白位于自噬小體細胞質表面,是自噬小體形成的標志,也是自噬研究中常用的標志物[12]。本研究中體外實驗,miR-145-3p-inhibitor、miR-145-3p-NC、miR-145-3p-mimics分別和帶有GFP-LC3的質粒共轉染后,結果發現miR-145-3p-mimics組細胞中綠色熒光強度最高,而抑制miR-145-3p表達后,幾乎無熒光產生,這提示在促進miR-145-3p表達的HPDLFs細胞中,LC3大量分泌,表明有大量的自噬小體形成,自噬活性升高,維持了HPDLFs細胞內環境穩態。這與Wu等[11]關于miR-145-3p能夠促進細胞自噬的研究結果基本一致。同時,本實驗表明,在抑制miR-145-3p表達的細胞內,自噬溶酶體數量很少,LC3蛋白表達很弱,而促進miR-145-3p表達后,自噬溶酶體大量生成,LC3蛋白表達顯著增加。以上實驗結果提示,miR-145-3p可能是通過提高人牙周膜成纖維細胞的自噬活性,為牙周組織再生能力提供原料和能量等保障。
為進一步探討miR-145-3p促進人牙周膜成纖維細胞的自噬活性的可能的作用機制,我們檢測其他組蛋白HDAC4是否存在靶向關系。HDAC4是一種無DNA結合活性的組蛋白去乙酰化酶,主要是通過和其他的蛋白質結合成有調解活性的抑制轉錄的復合物,并且還能夠使組蛋白去乙酰化使染色體凝聚最終抑制轉錄[13]。Shao等[14]研究表明,miR-138通過HDAC4/PGRN或HDAC4/NF-kB調節類風濕關節炎中相關的炎性細胞因子,并揭示了類風濕關節炎可能通過靶向該機制來加速治療策略的發展。Park等[15]報道在人類乳腺癌TAMR/MCF-7細胞中用HDAC抑制劑MHY218處理后自噬標記物beclin-1和LC3-Ⅱ的表達水平明顯增加。本研究中我們通過靶基因預測和雙熒光素酶報告系統發現,HDAC4是MiR-145-3p的直接靶向蛋白,并且二者之間具有負反饋調節作用。結果表明,在miR-145-3p基因高度表達的細胞中自噬相關蛋白Beclin-1顯著升高,而抑制miR-145-3p表達后,Beclin-1表達明顯下降;而P62蛋白在該2組細胞中的表達呈現出相反的趨勢。提示miR-145-3p在人牙周膜成纖維細胞中促進自噬的作用可能是通過靶向抑制HDAC4的表達而實現的。
綜上所述,miR-145-3p在人牙周膜成纖維細胞中發揮促進自噬的作用,可能是通過抑制靶向基因HDAC4,從而促進自噬相關蛋白Beclin-1、LC3表達并減少P62的表達而實現的。

