特發性肺纖維化的高分辨率CT研究進展
林秋喜 鄧宇
廣州醫科大學附屬第一醫院放射科510120
1 前言
特發性肺纖維化 (idiopathic pulmonary fibrosis,IPF)是一種以慢性、進行性、不可逆性肺纖維化為特征的彌漫性間質性肺疾病,是特發性間質性肺炎最常見的亞型。與其他特發性間質性肺炎相比,IPF 的預后更差,中位生存期僅2~5年,且個體間差異極大。IPF病因尚不明確,有文獻報道年齡、煙草暴露、環境因素、病毒、遺傳基因、慢性胃腸道酸或非酸性物質反流和吸入等危險因素參與了IPF的發生、發展[1]。目前認為,肺泡上皮細胞異常活化和成纖維細胞過度修復是疾病產生的機制[2]。該病發病年齡多在50歲以上,以男性多見,每年發病率為2.8/10萬~9.3/10萬[3],并隨著人口老齡化有逐漸升高趨勢。患者多表現為干咳、呼吸困難、發紺、杵狀指等非特異性臨床表現,雙肺底聞及Velcro啰音,肺功能呈限制性通氣功能障礙伴不同程度的彌散障礙。病理上,IPF 表現為普通型間質性肺炎 (usual interstitial pneumonia,UIP),不同時相病變共存和蜂窩是診斷UIP的重要依據,也是與其他類型特發性間質性肺炎相區別的要點[4]。自2000年ATS、ERS聯合發表第一版 《IPF 診斷與治療國際共識》[5]以來,IPF的國際指南幾經修改,其診治仍是呼吸內科的難點,本文就近年來高分辨率 CT (high resolution computed tomography,HRCT)在IPF 的診斷、療效判斷及預后判斷等方面的研究進展作一綜述。
2 IPF的HRCT研究進展
2.1 HRCT 在IPF 診 斷 地 位 的 演 變 2000 年ATS/ERS發表了 《IPF診斷與治療國際共識》[5],對IPF的診治做出較為全面的概述。該指南指出HRCT 有助于早期診斷IPF,表現為主要累及兩肺胸膜下、基底部的網狀影,可伴有小范圍的磨玻璃樣影,在受累較嚴重的部位,常有牽拉性支氣管擴張和/或胸膜下蜂窩影。
2011 年 ATS、ERS、 日 本 呼 吸 學 會 (Japanese Respiratory Society,JRS)及拉丁美洲胸科協會 (Latin American Thoracic Society,ALAT)共同發表了 《IPF 診治循證指南》[1](以下簡稱2011 年指南),該指南就2000年國際共識發表以來新的研究成果進行循證分析,對IPF的診治指南進行更新。HRCT 作為診斷流程的重要組成部分,將臨床懷疑IPF的表現分為UIP型、可能UIP型和不符合UIP型,其中UIP 表現型對應病理UIP 型陽性率達90%~100%,同時2011年指南強調臨床-病理-影像多學科討論 (multidisciplinary discussion,MDD)的重要性,并將HRCT 對IPF的診斷價值提升到與外科活檢同等重要的地位,即患者HRCT 呈現為UIP型時,IPF的確診無需組織病理學檢查。近年來,多項研究統計分析結果認為2011年指南HRCT 分型過于保守,特別是在一些缺乏蜂窩影、HRCT 表現為 “可能UIP型”的群體中,最終組織病理結果為UIP型的比例很高,尤其是HRCT 表現為 “可能UIP型”伴外周牽拉性支氣管擴張的患者[6-9]。部分學者建議對2011年指南HRCT 分型進一步細化[8-11]。為此,2018 年AST/ERS/JRS/ALAT 共 同 制 定 的 《IPF 臨 床 實 踐 指南》[12](以下簡稱2018 年指南)對HRCT 分型進行修訂(表1),在2011年指南HRCT 分型的基礎上將其分為UIP型 (圖1)、很可能UIP型 (圖2)、不確定UIP 型 (圖3)及其他診斷4種類型。此外,2018年指南除對HRCT 掃描技術、參數及體位作了詳細的規定外,更加重視HRCT 在IPF診斷流程中的作用,基于HRCT 診斷分型的不同,推薦相應的進一步輔助診斷方法。同時,為與HRCT 分型保持一致,2018年指南建議組織病理學分型亦改為UIP 型、很可能UIP 型、不確定UIP 型及其他診斷。除了上述HRCT 分型標準及UIP 組織病理學分型標準進行更新外,2018年指南對IPF的臨床診斷標準并無明顯改動,依然沿用2011年指南的三條標準。
2.2 HRCT 評估IPF 嚴重程度 鑒于IPF 自然病程變化多端,部分患者在沒有臨床干預的情況下也能保持病情穩定,而部分患者則病情快速進展以致呼吸衰竭[14-16],精確評估疾病的嚴重程度有助于及時采取恰當的臨床決策,減輕患者醫療負擔,延緩疾病進展。遺憾的是,到目前為止,仍沒找到可被業界廣泛認可的疾病嚴重程度分級方法。在過去的二三十年,科研人員利用肺功能、影像、組織病理學等數據進行大量的探索,也得到一些比較一致的結論,比如FVC、DLCO 的下降速度與死亡率有關[17],但肺功能測試結果波動性大,單純CT 視覺評估不夠精確、組織病理受取材部位影響等一系列難以克服的短板使疾病嚴重程度分期始終處于實驗探索階段。近年來,隨著計算機視覺技術的發展,基于CT 圖像的計算機輔助診斷似乎讓醫療工作者們看到了曙光。
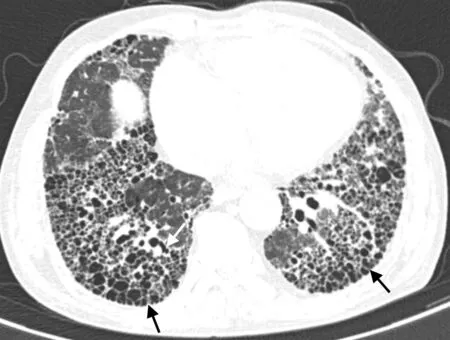
圖1 典型UIP,雙下肺容積縮小,雙下肺及胸膜下可見多層蜂窩形成 (黑箭頭示),蜂窩簇狀層疊,囊壁較厚,并可見牽拉性支氣管擴張 (白箭頭示)
2.2.1 半定量CT 分析 相對于通過對病變范圍及程度所采用的輕度、中度、重度等定性報告,半定量CT 分析則是采取視覺評估的方法,對標準層面病變范圍或肺野的病變體積進行較為精確的估算,再對不同程度的病變賦予分值,最終通過計算標準層面或肺野不同程度病變的平均病變范圍或肺野體積,以加權的方式得出病變積分,但不同研究對病變范圍及程度的統計仍存在差異[18-22]。
多項研究表明,無論是基線水平還是縱向的變化,IPF患者HRCT 纖維化范圍和程度與患者預后存在相關性,尤其是牽拉性支氣管擴張和蜂窩樣改變[18-22]。Skin等[18]為探究臨床、薄層CT 和組織病理學表現對患者預后的影響,對108例UIP/非特異性間質性肺炎 (nonspecific interstitial pneumonia,NSIP)患者的臨床資料進行分析,COX 回歸模型分析結果表明,無論組織病理類型是UIP還是NSIP,薄層CT 上纖維化評分與患者死亡風險相關 (HR=1.200,P=0.043)。Edey等[19]對114 例特發性間質性肺炎患者進行以死亡為終點的隨訪研究,通過對患者HRCT的特征 (磨玻璃密度影、細網狀影、粗糙網狀影、牽拉性支氣管擴張、微囊蜂窩和大囊蜂窩及實變等)進行評估,結果采用COX 回歸模型分析發現患者不良預后與粗糙網狀影、蜂窩影及全肺病變范圍相關;作者特別指出,除外病變范圍的影響,牽拉性支氣管擴張可作為預測患者不良預后的獨立因素;而相比大囊蜂窩影,微囊蜂窩范圍對患者預后影響更大。Hwang等[20]對72例間質性肺疾病患者進行基線和縱向的半定量CT 評估,亦認為基線蜂窩的程度及其在隨訪CT 中的進展是纖維化間質性肺炎患者存活率的重要決定因素。此外,Lee等[21]和Oda等[22]的研究均認為對UIP/NSIP患者CT 分析有助于評估患者預后。

表1 2018年指南高分辨率CT 分型標準[13]
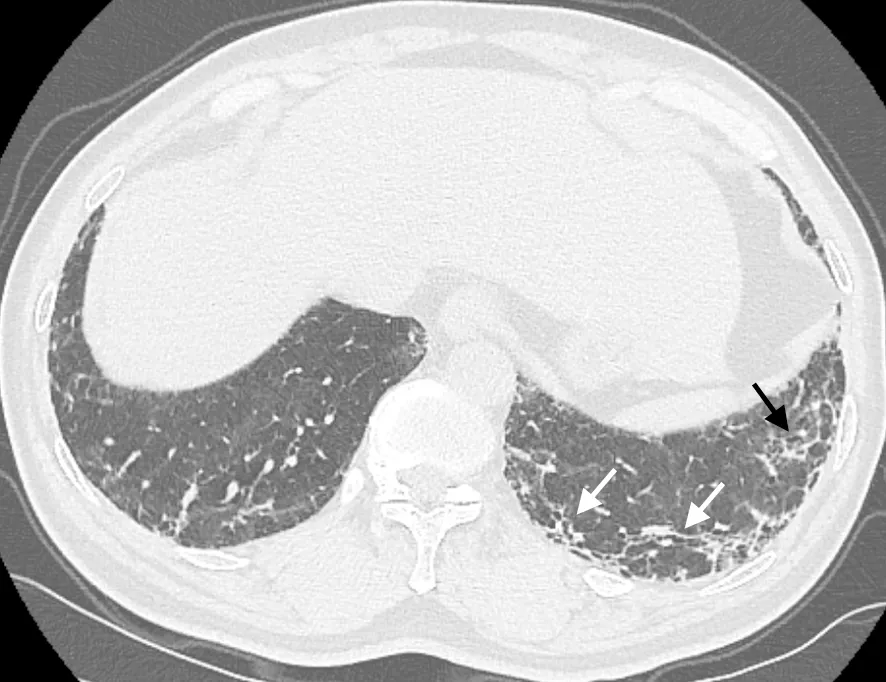
圖2 很可能UIP,兩下肺胸膜下可見網狀及不規則線狀影 (黑箭頭示),同時可見牽拉性支氣管擴張 (白箭頭示)

圖3 不確定UIP,雙下肺胸膜下可見小片狀磨玻璃影及細網狀影 (箭頭示),未見明確的牽拉性支氣管擴張及蜂窩形成
盡管還有眾多的研究支持HRCT 可用于評估IPF患者病情的嚴重程度,但基于HRCT 的病情評估仍未應用于實際的臨床工作當中。以下原因可能限制其實用性:半定量HRCT 視覺評估是主觀的,胸部影像的放射學專家之間亦存在較為明顯的觀察者間及觀察者內差異,例如病變的范圍的估算以及蜂窩肺的識別均難以統一,并且對于有臨床意義的病灶短期變化不敏感;再者,IPF 存在明顯的異質性,以上提及的研究均為回顧性研究,以上結論在實際個體的預測效果如何,仍缺乏大量的前瞻性試驗證明。
2.2.2 定量CT 分析 近年來,隨著計算機圖像處理技術的發展及人工智能醫學在各個領域的滲透,多種基于CT的圖像分析技術也相繼應用于間質性肺疾病的臨床研究,其技術涵蓋了從簡單的CT 值直方圖分析到基于紋理分析和深度學習的復雜領域[23-24]。定量CT 分析作為一種新技術,為間質性肺疾病的評估帶來新的前景[24]。
2.2.2.1 CT 值直方圖峰度/密度測量 CT 值直方圖用于描述CT 圖像亨氏單位 (housefield unit,HU)的分布,可計算平均肺衰減值、方差、偏度和峰度。當肺纖維化或炎癥導致肺部軟組織密度增加時,會增加平均肺衰減值,從而降低直方圖峰值 (峰度)的銳度和曲線向左偏斜的程度。因此,平均肺衰減值、偏度和峰度可用作肺纖維化程度的量度。為探究CT 值直方圖參數與肺功能參數的相關性,Best等[25]對144例IPF患者進行相關資料分析,結果表明兩者存在相關性,其中峰度與肺功能的關系尤為密切,隨后作者在對167例IPF患者的隨訪研究中發現,CT 值直方圖參數的變化可作為疾病進展的指標。Kim 等[26]最近的研究則提出,基線CT 值直方圖參數和基線FVC 和DLCO 有良好相關性,但評估其與FVC和DLCO 隨時間變化的相關性時,CT 值直方圖參數則不具有統計學意義。
2.2.2.2 CALIPER CALIPER 是由美國梅奧診所生物醫學影像資源實驗室開發的用于HRCT 肺部病變定量分析的一款新型軟件。Maldonado等[27]對55例IPF患者進行回顧性研究,結果表明由CALIPER 量化分析的肺內纖維化程度可預測中位隨訪2.4年存活率。為了比較CALIPER 定量分析與傳統的視覺半定量CT 分析兩者的優劣性,Jacob等[28]對283例IPF患者HRCT 分別進行自動化評估及肉眼評估,參照患者肺功能參數結果顯示,在單變量分析中,CALIPER 自動化評估間質性肺疾病病變范圍與肺功能參數的相關性優于傳統的視覺半定量評估。令人意外的是,在此次研究中,科研人員發現剔除的肺血管容積竟與間質性病變程度有著極大的關聯,由此提出肺血管容積 (定義為肺血管容積占肺總容積的百分比)可能作為新參數用于評估IPF 患者嚴重程度。隨后該組研究人員基于CALIPER自動化評估,對比以往常用的評估方法對283例IPF 患者進行死亡率預測,分析結果認為自動化評估參數,尤其是肺血管容積較傳統視覺半定量評估方法能更好地評估患者預后,且CALIPER 參數聯合復合生理指數能夠進一步提高死亡率的預測[29]。此外,在近年的研究當中,該組研究人員還提出,在病變程度較輕的IPF患者,CALIPER 對病變的評估敏感性優于肺功能[30]。
目前,CALIPER 被多個醫療中心應用于數千例的回顧性及前瞻性分析研究,已成功用于預測各種間質性肺疾病的生存和未來生理變化 (如FVC 下降),甚至是抗纖維化藥物臨床試驗療效評估[24]。盡管CALIPER 的分析結果優于人工視覺評估,但其在病灶識別方面也并非盡如人意,仍有待改進。例如在肺氣腫程度評估上,受患者檢查時吸氣程度的影響,CALIPER 并不如傳統的視覺評估。再者,CALIPER 對磨玻璃密度影和網狀影兼有的混合病變統計也與視覺評估存在較大差異,對個別病例的回顧發現,CALIPER 也常將蜂窩樣改變分析成網狀影[28]。
2.2.2.3 其他 目前還有多個處于開發中的定量CT 分析工具,如基于紋理分析的自適應多特征法 (adaptive multiple features method,AMFM)、基于纖維化特征分類的肺纖維化定量 (quantitative lung fibrosis,QLF)、基于卷積神經網絡深度學習的數據驅動紋理分析 (data-driven textural analysis,DTA)等多種分析算法[24]。AMFM 是基于計算機紋理分析的肺實質特征定量化工具,通過訓練集優化紋理特征的分類識別,然后使用貝葉斯分類器應用于測試集,完成肺CT 圖像中不同病變特征的提取,該技術還可延伸為三維紋理分析。有學者應用AMFM 對IPF患者的肺實質區域特征與預后的相關性進行了探索,發現磨玻璃影-網狀影可預測疾病進展,且隨訪變化與FVC 變化相關,因此AMFM 可作為現有IPF 預后標志物的輔助方法[31]。QLF利用監督下的學習范式對支持向量機分類器進行訓練,得出纖維化特征的定量結果,并顯示出較好的診斷效能[26]。DTA 是利用卷積神經網絡進行的非監督特征學習,通過纖維化的感興趣區數目與肺段所有感興趣區數目的比值可得出DTA 纖維化評分。在IPF Network的研究中,患者基線的DTA 纖維化評分及隨訪變化與FVC%pred和DLCO%pred等生理學指標相關[32]。
定量CT 分析的運用為我們帶來敏感性更好、精確度更高、觀察者間差異性更小的病變分析。形態學上一些細微的變化不足以被視覺察覺時,定量CT 分析則起到重要的作用,尤其在藥物的療效評估方面,優于單純的視覺評估。但是,定量CT 分析仍存在某些不足,幾乎所有分析算法在應用前都需要對圖像進行分割和提取,掃描時患者的吸氣程度、圖像層厚、射線強度及重建算法都將對最終圖像的識別及分析產生影響。
總而言之,CT 定量分析將有以下的應用前景:診斷早期間質性肺疾病;評估間質性肺疾病的嚴重程度,尤其是為IPF的分層管理提供依據;對于不能耐受肺功能檢查的患者,CT 定量分析有助于評估患者肺功能;抗纖維化藥物臨床試驗的入組篩選及療效評估。
3 展望
以IPF為代表的特發性間質性肺炎是呼吸內科極為棘手的一類疾病,診斷困難,治療效果不佳。近年來,一些新型的抗纖維化藥物如尼達尼布和吡非尼酮等進入臨床試驗并顯示出良好的療效,為該類患者的治療帶來曙光。IPF作為特發性間質性肺炎中預后最差的亞型,在影像學上如何更好地與其他特發性間質性肺炎鑒別,病變的定量分析是否有助于精確評估疾病嚴重程度等關鍵問題,隨著醫療大數據時代的來臨以及基于深度學習的人工智能輔診的應用,有望獲得更準確的分析、判斷。可以預見,基于HRCT 的定量分析將進一步在IPF 的早期診斷及預后判斷中發揮重要的作用,為IPF患者做出更為精準的個性化臨床決策。
利益沖突所有作者均聲明不存在利益沖突

