玻璃體腔注射康柏西普聯合PPV治療增殖型糖尿病視網膜病變
歐 舟,王 沁,蔣 潔,劉 曦
0引言
增殖型糖尿病視網膜病變(proliferative diabetic retinopathy,PDR)為糖尿病視網膜病變(diabetic retinopathy,DR)晚期表現,屬糖尿病常見眼部嚴重并發癥之一,是導致患者視力下降,甚至致盲的重要原因[1]。PDR增生早期可通過全視網膜激光光凝術控制眼內新生血管增生,但晚期PDR常并發玻璃體積血或新生血管膜,需行玻璃體切割術治療,但該術式操作過程中出血多可能影響手術視野,延長手術時間,增加并發癥,影響術后恢復[2]。近年來越來越多研究認為,血管內皮生長因子(vascular endothelial growth factor,VEGF)可通過促內皮細胞增殖、遷移,提升血管通透性等途徑參與PDR新生血管增殖過程,導致PDR進展,建議應用抗VEGF藥物控制新生血管性眼病進展[3]。但有報道認為,常規抗VEGF藥物如貝伐單抗、雷珠單抗等在抑制視網膜及脈絡膜新生血管生成的同時可能存在一定的毒性反應,影響視網膜光感受器功能[4]。而康柏西普為我國自主研發多靶點抗VEGF藥物,較進口雷珠單抗、貝伐單抗價格低廉,經濟性更高,更符合我國國情。已有報道證實,康柏西普可特異性與VEGF-A/B結合,抑制新生血管增殖,減輕出血及滲漏,降低玻璃體切割術難度[5]。但對其與玻璃體切割術聯合對眼內VEGF相關因子的影響及其應用的安全性尚缺乏系統化報道。為進一步驗證玻璃體腔內注射康柏西普用于PDR治療的價值,現對我院收治的PDR患者64例75眼分別采用單純玻璃體切割術及其術前聯合玻璃體腔注射康柏西普治療,觀察最佳矯正視力(best corrected visual acuity,BCVA)、黃斑中心凹厚度(central macular thickness,CMT)、房水中VEGF相關因子變化、術中情況及術后恢復等方面探討玻璃體切割術前玻璃體腔注射康柏西普的價值,以期為PDR治療提供參考。
1對象和方法
1.1對象前瞻性研究。選取2016-01/2019-10我院收治的PDR患者64例75眼。納入標準:(1)年齡>18歲;(2)依據我國糖尿病視網膜病變臨床診療指南(2014年)確診為PDR[6];(3)經散瞳后眼底檢查確診;(4)伴明顯視力降低;(5)DR分期Ⅴ期,擬行玻璃體切割術治療;(6)入組前未接受手術或抗VEGF藥物治療;(7)眼壓、屈光介質正常;(8)已簽署知情同意書。排除標準:(1)急慢性感染;(2)合并嚴重白內障、青光眼、高眼壓、角膜病、息肉樣視網膜脈絡膜血管病變等其他眼部疾病患者;(3)嚴重心肝腎肺功能不全;(4)嚴重腦血管疾病;(5)精神疾病;(6)孕期或哺乳期女性;(7)自身免疫性疾病;(8)全身惡性腫瘤;(9)無法控制高血壓;(10)長期抗凝藥物服用史;(11)過敏體質。本研究通過醫院倫理委員會審查通過。
1.2方法兩組患者術前均完善視力、裂隙燈顯微鏡、房角鏡、眼部B超、眼壓、熒光素血管造影等眼科檢查。并檢查血糖,術前控制血糖至正常范圍(空腹血糖<7mmol/L,餐后血糖<9.0mmol/L)。兩組患者均由同一手術團隊完成手術治療。觀察組采用玻璃體切割術聯合術前玻璃體腔注射康柏西普治療。術前5d術眼點左氧氟沙星滴眼液,4次/天。玻璃體腔注射康柏西普治療:患者仰臥位,消毒鋪巾,鹽酸奧布卡因滴眼液點眼,表面麻醉,指導患者鼻上方注視,勿轉動眼球,注射針抽取康柏西普0.05mL(0.5mg),垂直眼球壁,自顳下方角鞏膜緣后側約3.5mm處傾斜刺入鞏膜,進入玻璃體腔,避免損傷晶狀體,確定針頭刺入玻璃體腔后,緩慢注入康柏西普0.05mL,結束后緩慢退針,無菌棉球按壓穿刺部位避免藥液反流,結膜囊涂妥布霉素地塞米松眼膏,包扎術眼。術后妥布霉素地塞米松滴眼液點眼,4次/天,連續5d。出現高眼壓者適當予降眼壓藥物控制眼壓。玻璃體腔注射康柏西普5d后行玻璃體切割術,布比卡因(0.75%)+利多卡因(2%)3mL球后、球旁、結膜下浸潤麻醉,經睫狀體扁平部行標準三通道玻璃體切割術,接灌注,導入導光纖維、玻璃體切割頭,2500r/min速率切割玻璃體,清除前部、套管周邊及基底部玻璃體和血性玻璃體液,23G眼內鑷與玻璃體切割口配合剝離纖維增殖膜,徹底剝除視盤纖維血管黏連,玻璃體切割頭切割致密大片黏連視網膜前膜,眼內鑷剝除纖維增生膜,合并視網膜下增殖膜者電凝血管后切開周邊視網膜,眼內鑷游離纖維膜并取出,切開處配合激光光凝,輕微出血者常規壓迫止血或適當提高灌注壓,反復出血者電凝止血;依據眼底情況選擇是否行眼內激光光凝[7],氣液交換,玻璃體腔填充惰性氣體或硅油,術畢結膜囊涂妥布霉素地塞米松眼膏,左氧氟沙星滴眼液點眼,包扎術眼。對照組僅行玻璃體切割術治療,手術方法同觀察組。
觀察指標:(1)BCVA:兩組患者均于術前,術后1wk,1、3mo檢測BCVA(LogMAR);(2)CMT:術前、術后3mo采用光學相干斷層掃描儀測定CMT,重復檢測3次,取平均值;(3)實驗室指標:觀察組患者于玻璃體腔注射康柏西普前、注藥5d后行玻璃體切割術時采集房水標本,對照組于入院散瞳檢查眼底時及行玻璃體切割術時采集房水標本0.1mL,采用酶聯免疫吸附試驗法測定VEGF、胎盤生長因子(placental growth factor,PIGF)、堿性成纖維細胞生長因子(basic fibroblast growth factor,bFGF)濃度,VEGF酶聯免疫吸附試驗試劑盒購自武漢博士德生物工程有限公司,人PIGF及bFGF酶聯免疫吸附試驗試劑盒均購自美國Sigma公司,抗人VEGF/PIGF/bFGF單克隆抗體包被至酶標板,孔板加入樣品與標準品,滴加生物素化抗VEGF/PIGF/bFGF抗體,洗滌液洗滌后甩凈,滴加親和素-過氧化酶復合物,洗滌,滴加顯色液顯色,過氧化物酶催化。Epoch型酶標儀(美國Biotek公司)于450nm波長處測定各孔吸光度值,繪制標準曲線,計算VEGF、PIGF、bFGF濃度。(4)記錄兩組患者手術時間、術中出血量、術后視網膜水腫、眼底出血等癥狀改善時間及滲出吸收時間。(5)記錄兩組患者術后3mo內并發癥發生情況。

2結果
2.1兩組患者術前基本資料比較按照隨機數字表法分為觀察組32例38眼采用玻璃體切割術聯合玻璃體腔注射康柏西普治療與對照組32例37眼采用單純玻璃體切割術治療。兩組患者術前基本資料比較差異無統計學意義(P>0.05,表1)。兩組患者隨訪至術后3mo,無失訪及脫落病例。

表1 兩組患者術前基本資料比較
2.2兩組患者術中情況比較觀察組術中使用電凝20眼(53%);對照組術中電凝26眼(70%),兩組患者術中電凝使用情況比較差異無統計學意義(χ2=2.459,P=0.117)。
2.3兩組患者手術前后BCVA比較兩組患者手術前后BCVA比較差異有統計學意義(F組間=93.542,P組間<0.001;F時間=67.039,P時間<0.001;F交互=40.467,P交互<0.001)。兩組患者術前BCVA比較差異無統計學意義(P>0.05),術后不同時間兩組患者BCVA均較術前改善,差異有統計學意義(P<0.05),觀察組術后不同時間BCVA優于對照組,差異有統計學意義(P<0.05),見表2。
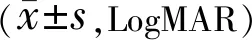
表2 兩組患者手術前后BCVA比較
2.4兩組患者手術前后CMT比較兩組患者術前CMT比較差異無統計學意義(P>0.05),術后3mo兩組患者CMT均較同組術前降低,差異有統計學意義(P<0.001),觀察組術后3mo CMT低于對照組,差異有統計學意義(P<0.001,表3)。
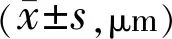
表3 兩組患者手術前后CMT比較
2.5兩組患者實驗室指標比較兩組患者房水基線VEGF、PIGF、bFGF比較差異無統計學意義(P>0.05),術前觀察組VEGF、PIGF、bFGF低于對照組,差異有統計學意義(P<0.001,表4)。

表4 兩組患者實驗室指標比較
2.6兩組患者術中及術后恢復情況比較觀察組患者手術時間短于對照組,術中出血量少于對照組,差異均有統計學意義(P<0.001),觀察組視網膜水腫吸收時間、眼底出血吸收時間及滲出吸收時間均短于對照組,差異有統計學意義(P<0.05,表5)。
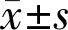
表5 兩組患者術中及術后恢復情況比較
2.7兩組患者并發癥發生率比較兩組患者術后出現術后一過性高眼壓酌情予降壓藥物后改善;玻璃體出血者予口服化瘀藥物治療后出血吸收;新生血管性青光眼行抗青光眼手術治療后好轉;視網膜纖維增殖取出眼內填充物后改善。觀察組總并發癥發生率低于對照組,差異有統計學意義(P<0.05,表6)。

表6 兩組患者并發癥發生率比較 眼(%)
3討論
PDR為糖尿病微血管并發癥之一,統計報道糖尿病患者5a內DR發生率超過40%,其中有較大一部分患者進展為PDR,影響患者視力,增加致盲風險[8]。多項研究證實,新生血管生成與PDR發生密切相關[9-10]。正常生理條件下,眼內血管內皮細胞、視網膜色素上皮細胞及神經膠質細胞均可合成及釋放VEGF,維持眼部血管正常發育。糖尿病持續高血糖狀態下,VEGF釋放增多,提升血管通透性,導致內皮細胞增殖,提升內皮細胞對葡萄糖轉運活性,誘導新生血管生成;同時可通過激活蛋白激酶C等途徑破壞血-視網膜屏障,導致視網膜缺血、缺氧損傷,VEGF異常釋放,誘導新生血管生成,導致DR發生及進展[11-12]。此類患者常因視網膜纖維增殖、玻璃體出血等導致視力下降,嚴重者可能失明[13]。玻璃體切割術是治療纖維增生及增生晚期PDR的常用手段,其中23G微創玻璃體切割術仍為主流術式,可減少牽拉損傷,降低醫源性裂孔發生,同時手術靈活性高、切口小、損傷小[14]。但PDR大多眼底情況復雜,即便通過玻璃體切割或全視網膜光凝仍有部分新生血管繼續發展,導致復發或反復玻璃體出血,影響預后[15]。故多主張先行抗VEGF治療消退新生血管后再行玻璃體切割術。
前期有研究發現,PDR圍術期抗VEGF治療可降低術中出血,改善手術視野,降低手術難度,促進視力恢復[16]。但以往抗VEGF藥物選擇多為進口貝伐單抗、雷珠單抗等,費用高,且存在一定的毒副反應。本研究中,對照組僅應用玻璃體切割術,觀察組術前玻璃體腔注射康柏西普治療,結果發現觀察組術中電凝使用率低于對照組,且術后不同時間BCVA改善情況優于對照組,同時術后3mo CMT顯著低于對照組,獲得與上述研究圍術期應用進口抗VEGF藥物基本一致的結論,術前玻璃體腔注射康柏西普較單純應用玻璃體切割術治療更利于PDR患者術后視力改善,有助于減輕黃斑水腫。考慮機制為:術前玻璃體腔注射康柏西普可通過VEGF-A/B及PIGF多靶點拮抗VEGF生成,抑制玻璃體內VEGF表達及活性,消退PDR眼部新生血管,降低血管通透性,減少黃斑區血管滲漏,抑制新生血管生成,減少術中出血,降低術中新生血管膜剝離難度,避免術中反復止血,電凝或交換器械,有助于徹底清除玻璃體積血,促進黃斑水腫消退,降低CMT,減少其對視神經破壞,促進視力改善。
VEGF是目前公認最強促血管生成因子,PIGF為VEGF家族成員之一,屬分泌型二聚體糖蛋白,與VEGF氨基酸序列同源性較高,早期促血管生成作用不被重視[17]。近年來發現,PIGF具多種生物學功能,可誘導內皮細胞增殖,調節其活性,刺激新生血管生成,促進內皮細胞及單核細胞增殖及遷移,提升血管通透性[18]。動物試驗發現,PIGF過表達可誘導病理性新生血管生成,增加血管滲漏[19]。但對不同程度糖尿病視網膜病變患者房水內PIGF表達尚未確立統一意見,國內對PDR眼內PIGF水平的報道也相對少見。本研究發現,兩組基線VEGF、PIGF均處于較高水平,支撐以上結論及前期相關報道[20-21]提出的VEGF可能參與PDR視網膜新生血管形成的結論,同時本研究還發現PIGF同樣與PDR新生血管增殖及血管滲漏有關,且與組織缺氧、缺血程度密切相關,為本研究的創新點。bFGF又稱肝磷脂結合生長因子,參與內皮細胞有絲分離及趨化、遷移過程,介導基底膜破壞及新生血管形成過程,與VEGF存在類似生物學功能,近年來發現與DR視網膜新生血管生成有關[22]。本研究發現基線時PDR眼內bFGF濃度上升。而觀察組經玻璃體腔注射康柏西普治療5d后眼內VEGF、PIGF、bFGF濃度明顯下降,對照組無任何改善,說明術前輔助應用康柏西普抗VEGF治療可通過抑制促血管內皮生成因子VEGF、PIGF及bFGF生成,減輕脈絡膜血管擴張,消退新生血管,降低血管通透性,阻斷血管內皮異常增殖,降低視網膜脈絡膜厚度,減輕組織缺氧、缺血,改善視網膜微循環,可為玻璃體切割術奠定良好的基礎。但受倫理因素制約,本研究未能獲取術后眼內VEGF、PIGF、bFGF的變化數據,尚有一定的局限,有待后續豐富結論后補充。
此外,本研究還發現,觀察組手術時間較對照組短,術中出血較對照組少,視網膜水腫吸收時間、眼底出血吸收時間及滲出吸收時間均短于對照組,與文曉霞等[23]結論,證明術前玻璃體腔注射康柏西普可加快眼底滲出及出血吸收,可能與康柏西普可通過抑制PIGF、VEGF所誘導VEGF受體激活,抑制新生血管增生,促使增殖膜變薄,降低玻璃體切割術復雜程度,從而減少手術出血,優化視野,術中無需反復切割增殖膜,進而可縮短手術時間,促進視網膜水腫吸收,減少血管滲漏,促進術后恢復有關。在安全性方面,本研究發現,觀察組總并發癥發生率較對照組低,突出表現在玻璃體出血率降低方面,考慮僅行玻璃體切割術可能由于術中新生血管止血不徹底,導致纖維血管膜殘端或基底部滲血,受炎癥刺激,導致血管通透性提升,引起新生血管再次破裂出血[24]。相對而言,術前玻璃體腔注射康柏西普治療可消退新生血管,減少手術出血,降低術后玻璃體出血風險。
綜上,本研究采用術前玻璃體腔注射康柏西普聯合玻璃體切割術治療PDR可降低促血管生成因子VEGF、PIGF、bFGF濃度,抑制新生血管生成,改善視力,促進黃斑水腫吸收,促進視網膜水腫、出血及滲出吸收,減少并發癥。且康柏西普價格較進口抗VEGF藥物低廉,更能被患者接受。但本研究樣本量少,且未能觀察術后眼內促血管生成因子的變化,尚存在一定的局限,有待后期擴充樣本量、并收集術后促血管生成因子變化數據進一步充實結論。

