膜解剖在直腸癌手術中的應用
閆治波 戴勇
Heald等[1]提出的全直腸系膜切除術(total mesorectal excision,TME)顯著降低了中低位直腸癌的局部復發率,毫無懸念的成為中低位直腸癌手術治療的基本方法。30年來,隨著腹腔鏡技術、3D腹腔鏡,特別是達芬奇機器人在結直腸外科的應用,以及各種手術器械、切割止血平臺的發展,提供了干凈、無血、高度清晰且放大的手術視野,讓手術者更加清楚地觀察到腹盆腔筋膜的解剖層次與結構,結合尸體解剖和術中的觀察,逐步提出了膜解剖的概念與相關的手術操作技巧,再將視野拓展到從胚胎發育角度認識膜的形成、演變及與周邊組織器官存在的間隙或層面,逐步建立了系統的膜解剖理論模型。
一、膜解剖理論體系
當前,膜解剖理論模型存在不同的理論體系,比較著名的有日本篠原尚等[2]和Mike[3]的筋膜解剖(interfascial anatomy)理論,愛爾蘭Coffey等[4]提出的系膜解剖(mesenteric anatomy)理論,以及我國龔建平[5]和池畔等[6]支持的膜解剖(membrane anatomy)理論。
篠原尚在1994年從系膜胚胎學起源的角度對傳統外科術式進行了解讀,主要包括腹膜與筋膜的概念、胚胎發育中的胃旋轉及腸旋轉、Gerota筋膜與Toldt筋膜的形成等理論;Mike[3]在2012年從結直腸癌臨床手術實踐方面強調了基于筋膜解剖的技巧。2017年Coffey等[4]通過發表在《胃腸病學和肝病學》一篇評述中,提出系膜解剖理論核心觀點:腸系膜、Tolt筋膜及腹膜反折是連續的,而結直腸手術的核心是腹膜反折切開和系膜筋膜平面的分離。2015年龔建平[5]提出的膜解剖理論,以及池畔等[6]建立的膜解剖理論體系,借鑒了國外的相關經驗,也通過臨床手術、尸體解剖等手段提出了新的觀點,如“第五轉移、第三根治、系膜床、膜橋”等一系列學說也引起學術界的討論。孫凌宇等[7]認為,各個膜解剖理論從不同角度闡釋膜的結構和功能,互為補充,我們應以“兼收并蓄”態度對待它們,求同存異,從宏觀手術指導思想與微觀解剖方面高質量的完成手術。
膜解剖的精準應用可以顯著提高TME標本的優良率,保證直腸系膜的完整性,降低術中出血、做到微出血甚至零出血,且自主神經保護良好,降低術后性功能障礙、排尿困難的發生率[8-10]。同時我們應該認識到,膜解剖根本目的不僅僅是為了追求手術的微出血或者零出血,還因所謂的“膜”可以通過組織屏障局限腫瘤細胞的轉移播散,錯誤的膜解剖手術會導致腫瘤細胞的“第五轉移”,也就是“癌泄露”。防止癌泄露,提高手術徹底根治性、改善預后,是膜解剖手術的根本追求之一[11]。
龔建平[5]在2015年提出的外科膜解剖概念強調“廣義的系膜與系膜床的解剖”,而“廣義的系膜”是指筋膜和漿膜,信封樣包繞著器官及其血管,懸掛于體后壁,無論其形狀如何、無論其游離與否。簡言之就是器官、血管及重要的泌尿生殖神經被膜的封套所包裹。針對于直腸系膜就是指結腸系膜中腹膜和腹膜下筋膜呈Ω形由兩個側方及后方包裹直腸,而腎前筋膜則向下拓展為骶前筋膜和盆壁筋膜。
以膜解剖指導手術首先應該認識到,廣義的系膜與系膜床之間可以有4層膜和5個層面,而且膜的融合具有5層夾心結構,即脂肪、腹膜下筋膜、融合筋膜、腹膜下筋膜和脂肪,這其中是以融合筋膜為中心的。而尋找正確的膜間隙,往往需要遵循兩個理論:第一個指兩膜相對(bi-junction),左腹膜后間隙是由前方的上段直腸固有筋膜及后方腎前筋膜向左拓展而形成,直腸后間隙及腹膜反折以下的直腸周圍間隙是由前方的中下段直腸系膜與后方自腎前筋膜延續過來的骶前筋膜組成,而自主神經系統分別被腎前筋膜及骶前筋膜所覆蓋;國內韓方海等人提出“隔膜見管”的概念,也就是泌尿生殖淺筋膜后方可顯現輸尿管及生殖血管(圖1)。要進入兩片膜之間的間隙,需要利用助手合理的牽拉,顯露腹腔內的天然褶皺,比如直腸旁溝、腹膜反折等處打開另一層膜,也就是“膜橋”,而膜橋則指被腹膜覆蓋的兩片膜的開口處,也就是第二個理論“三三相交(tri-junction)”,打開膜橋,利用超聲刀的切割及空洞化效應,進入膜間隙,則實現了結直腸外科手術的膜解剖的手術(圖2)。
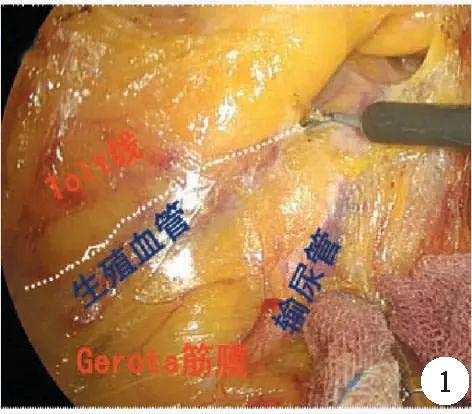
圖1 左腹膜后間隙
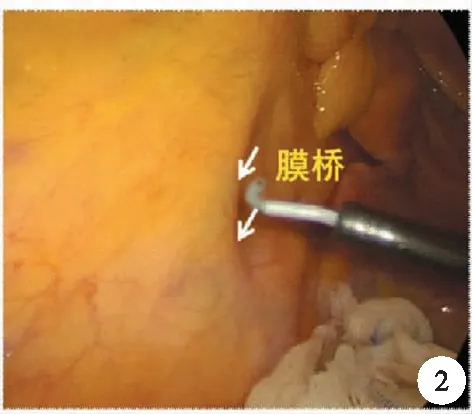
圖2 膜橋的打開處
二、膜解剖指導下的直腸游離
在中低位直腸癌的手術過程中,我們一般遵循骶骨岬直腸旁溝處切開膜橋,先行中央入路,進入后方間隙、前方間隙,然后側方間隙入路習慣。
1.直腸后方游離與膜解剖的關系:實際上,直腸后方的游離是以S4前方為界,此處分為上方的直腸后間隙及下方的肛提肌上間隙,直腸后間隙是指直腸系膜固有筋膜與腹下神經前筋膜(骶前筋膜的前葉)之間的間隙(圖3),其與肛提肌上間隙的界限在直腸骶骨筋膜,也就是Waldeyer筋膜,是由盆壁筋膜臟壁層在骶骨前增厚而形成,Waldeyer筋膜起到固定直腸和進一步隔絕腹腔的作用,術中離斷直腸骶骨筋膜后別有洞天,可再次進入銀發絲狀的結構,也稱為神圣平面(holy plane),此處的直腸被融合的直腸固有筋膜及骶前筋膜前葉所覆蓋,其后方為骶前筋膜后葉(圖4)。其中疏松的結締組織也就是所謂的融合筋膜,而融合筋膜有種表現形式,除了無血管的結締組織外,還有如Toldt筋膜樣的融合筋膜。
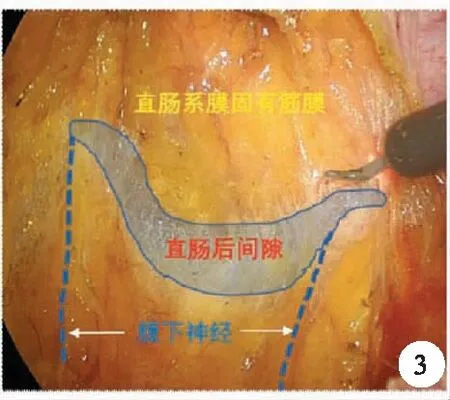
圖3 直腸后間隙
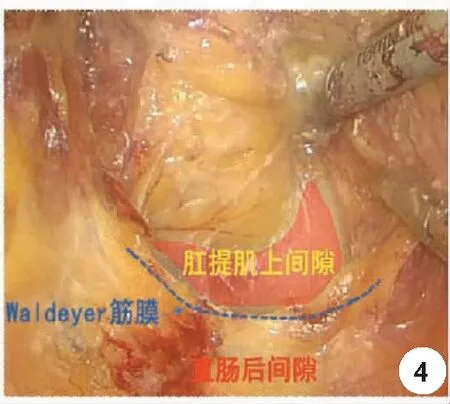
圖4 肛提肌上間隙
2.直腸前方游離:直腸前方的游離關鍵在于對鄧氏筋膜(Denonvilliers筋膜)的膜解剖及分層的認識,而隨著組織學及解剖學的進展,鄧氏筋膜的認識也越來越復雜。1836年,Charles Denonvilliers首先描述了鄧氏筋膜,鄧氏筋膜組織結構屬于纖維層,男性中可以將直腸和膀胱與精囊分開,在女性中可將直腸和宮頸與陰道分開。因此,又稱為直腸生殖隔,可以將直腸前方間隙分為后方的直腸前間隙(鄧氏筋膜后間隙)前方的前列腺后間隙(鄧氏筋膜前間隙),直腸前間隙比前列腺后間隙大,其中結締組織也更疏松,前列腺后間隙中分布血管和進入前列腺的神經支,不易游離,鄧氏筋膜在女性中比較菲薄,且出現率只有20%~30%[12]。因此,本文主要指男性中鄧氏筋膜的膜解剖關系。
有人認為,鄧氏筋膜很有可能是腹膜融合和間充質細胞受壓之后共同形成的[13]。雖然缺乏解剖學及術中證據,但在組織學染色鄧氏筋膜屬于多層結構。也有人認為鄧氏筋膜解剖學上應屬于多層結構[14],比如國內池畔等[6]認為,其包括鄧氏筋膜前葉及鄧氏筋膜后葉,而實際上后葉也就是直腸固有筋膜,這是符合解剖學認知的。
主流的手術入路仍沿用池畔等的方法,在腹膜反折上1.0 cm處切開腹膜,進入前列腺后間隙,分離鄧氏筋膜與精囊腺之間的空間,然后在距離接近完全暴露精囊腺處切斷鄧氏筋膜,進入直腸前間隙,如此可以保證TME的要求,又很好地保護該區域鄧氏筋膜前葉前外側的血管神經束(圖5、圖6)。
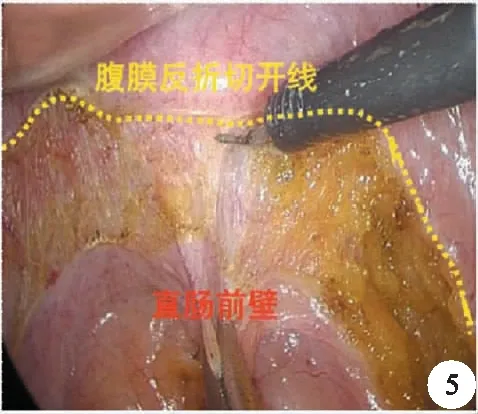
圖5 腹膜反折的切開線
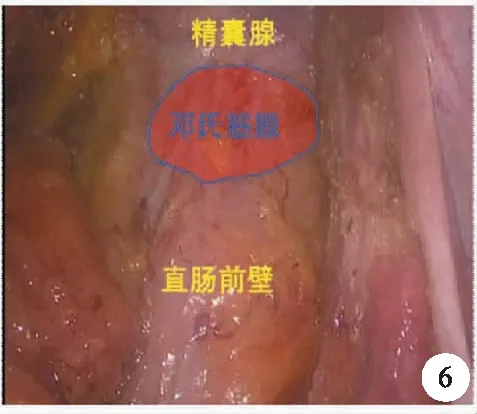
圖6 直腸前壁的游離
然而,衛洪波等認為,鄧氏筋膜前間隙狹小與前列腺融合,且存在前列腺神經支及血管走行,術中切開鄧氏筋膜與精囊腺的附著點,很容易導致出血及造成神經損傷,既然鄧氏筋膜后方與直腸之間存在疏松的網狀結構,手術更應從鄧氏筋膜后葉與前葉之間進行,其通過生理學及組織學研究確認,鄧氏筋膜與盆腔的植物神經功能密切相關[15]。我們認為,對于前壁或者局部分期較晚的腫瘤,累及鄧氏筋膜或者侵及直腸固有筋膜,術前放化療導致局部組織水腫、瘢痕,間隙不清,為根治性目的,切除鄧氏筋膜是必須的。腫瘤與直腸前壁及鄧氏筋膜無明顯關系時,盡量保留鄧氏筋膜,更好地保護精囊腺、前列腺及其內走行的血管神經束。
3.直腸側方游離:相對于直腸前后方游離,側方游離屬于直腸癌手術的難點,在充分游離前后間隙后,發現直腸側方缺乏明顯的間隙,且致密難以分離,這是因為直腸側韌帶的存在,直腸側韌帶有來自盆叢神經的直腸支可以穿過骶前筋膜及相鄰的直腸固有筋膜,其內也可能有直腸中動脈的存在。直腸側韌帶像一座橋一樣將直腸前后方兩個獨立的間隙連接起來,術中可以發現這屬于相對粗糙的脂肪樣組織,因其內包含血管、神經組織,有學者認為以“直腸側蒂”來稱呼更為合適(圖7)[13]。操作中注意保持一定的張力,緊貼直腸固有筋膜進行游離,避免盆叢的損傷,因其內走行的直腸中動脈多為分支走行,直徑較細,可以用超聲刀直接凝閉。
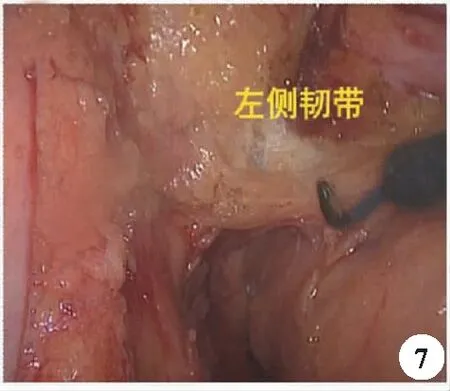
圖7 直腸左側韌帶
4.直腸末端游離:遵循后-前-側方的順序進行游離至盆底后,此處到達后壁的解剖標志為Hiatal韌帶,離斷Hiatal韌帶則到達肛提肌裂孔邊緣,肛提肌裂孔被直腸固有筋膜、肛提肌表面筋膜及前方的Denonvilliers筋膜融合所封閉。此處是直腸系膜及直腸固有筋膜的消失之處,也就是TME的終點線,為保證切緣可能需要繼續游離肛提肌裂孔(圖8)。
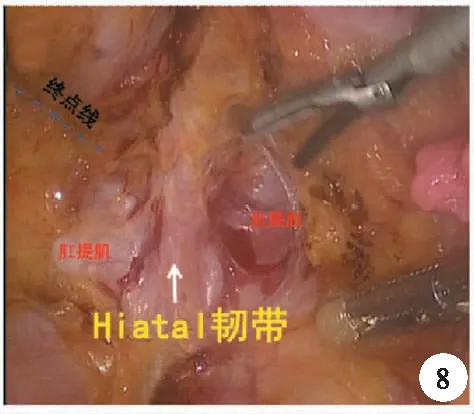
圖8 Hiatal韌帶
三、總結
膜解剖在直腸癌手術中應用意義巨大,在直腸癌手術中要始終牢記筋膜的解剖及盆腔自主神經束的保護。目前,存在直腸膜解剖的理論雖然尚未統一,我們應兼容并蓄的態度去應用,只要術中堅持膜解剖的核心理念及原則不變,注意保持足夠的操作張力,合理應用操作器械及技巧,就能從一臺復雜枯燥的手術中解脫,從膜間隙中尋找并感受精準手術帶來的快樂,并能避免血管神經的副損傷的發生,實現無血手術,最終變成一種具有藝術性的操作流程,也防止了癌泄露。

