單唾液酸神經節苷酯對魚藤酮誘導的大鼠中腦神經元細胞的保護作用
蔣暐卿
(上海市奉賢區古華醫院老年科,上海 201499)
帕金森病(Parkinson's disease,PD)是常見的老年性神經系統變性疾病,其主要發病機制是黑質紋狀體部多巴胺能神經元的變性、凋亡。目前隨著老齡化進程的加劇,帕金森病患病人群在逐年增多,現階段帕金森病的治療以左旋多巴替代治療為主,雖然能一定程度上減緩病程的發展但最終仍無法有效的阻止病情的最終結果。因此開發能有效的延緩病情發展甚至阻斷病程的藥物已相當緊迫。單唾液酸神經節苷酯是一種神經營養劑,目前已廣泛的應用于腦卒中的治療中,它可以促進神經系統的生長、分化,同時可以增強神經生長因子的活性,從而起到修復中樞神經的效果[1]。也有研究[2]認為神經節苷酯的保護神經、維持神經元活性的能力在對于帕金森病的治療方面也有一定的作用。基于此,本研究通過魚藤酮建立帕金森細胞模型,觀察單唾液酸神經節苷酯對多巴胺細胞的保護作用,并探討其可能的機制。
1 材料與方法
1.1 主要試劑及材料 雌性Sprague-Dawley(SD)大鼠24只,由中國科學院上海實驗動物中心提供。DF12/DMEM細胞培養液、胎牛血清、胰蛋白酶、青霉素、鏈霉素、B27(Gibico,美國);MTT、Hoechst 33258(碧云天生物技術有限公司);異硫氰酸熒光素(FITC)和四甲基異硫氰酸羅丹明(TRITC)(Sigma,美國),加入辣根過氧化物酶標記的抗鼠抗體(cell signaling,美國);ECL顯色試劑盒(Thermo,美國);魚藤酮(Sigma,美國);單唾液酸神經節苷酯;酶標儀(Thermo,美國);倒置熒光顯微鏡(IX81,Olympus,日本)。
1.2 動物模型制作及分組 將24只SD大鼠隨機分成隨機分成正常對照組、魚藤酮組、GM1對照組及GM1治療組,各6只。正常對照組不予以任何處理,魚藤酮組從實驗第一日起,每日上午于大鼠背部皮下注射魚藤酮1.5 mg/kg,GM1治療組從實驗第一日起,每日上午于大鼠背部皮下注射魚藤酮1.5 mg/kg,15 min后腹腔注射GM1 20 mg/kg,GM1對照組從實驗第一日起,每日上午腹腔注射GM1 20 mg/kg。連續注射1周,觀察各組大鼠的反應情況。
1.3 中腦原代神經元培養、處理 經過1周處理后,將各組SD大鼠以10%水合氯醛麻醉,在顯微鏡中去軟腦膜,分離腹側中腦,剪碎,以0.05%胰蛋白酶室溫消化10 min,期間不斷振蕩;使用含有10%胎牛血清的DF12/DMEM培養液終止反應,輕柔吹散10次/ml,靜置3 min取上清細胞懸液,以1200 r/min離心5 min,去上清,沉淀加入完全培養基。經臺盼藍染色活細胞計數,以1.5×105/cm2的密度種入預先包被有D-多聚賴氨酸,并且加入完全培養基的培養板中,置37 ℃、CO2培養箱12 h后更換為無血清培養基(DF12含2%B27,青霉素和鏈霉素各50 U/ml),體外培養7 d,并按照A組:正常對照組;B組:魚藤酮模型組;C組:GM1治療組;D組:GM1對照組進行分組,用于后續實驗。
1.4 MTT法檢測細胞存活率 于96孔板中加入各組經過不同處理后的原代神經元培養液,每孔加入MTT液至終濃度為5 mg/ml,加入無細胞孔作為空白對照;37 ℃培養3 h后,吸除培養液,加入150 μl的DMSO振蕩混勻。在酶標儀上以波長560 nm和參比波長630 nm檢測每孔光密度(D)值,細胞存活率=[(實驗組D值-空白組D值)-(對照組D值-空白組D值)]/(對照組D值-空白組D值)×100%。
1.5 免疫熒光染色 接種在玻片上的原代培養神經元經4%多聚甲醛固定30 min,PBS洗3×5 min,以0.2%Triton-X-100 4 ℃孵育12 min,PBS洗3×5 min,用1%山羊血清封閉液孵育30 min,之后加入一抗:兔抗TH抗體(1:200)4 ℃孵育過夜,PBS洗4×5 min,加入FITC(1:500)和TRITC標記(1:1000)的二抗混和液,室溫下避光孵育3 h,去除二抗孵育液,加入Hoechst 33258染核50 s(1:300),PBS洗4×5 min,之后加入抗熒光淬滅劑,用激光共聚焦顯微鏡顯像,熒光強度利用Image-Pro Plus軟件分析。
1.6 統計學方法 所有數據以用SPSS 17.0軟件包分析,計量資料采用()表示,行單因素方差分析,P<0.05表示差異有統計學意義。
2 結果
2.1 各組大鼠行為學表現 各組大鼠在實驗開始前均反應靈敏,攝食正常,無明顯異常表現。正常對照組大鼠和GM1對照組大鼠在整個實驗過程中無明顯行為學無異常改變。魚藤酮組在實驗第1天注射魚藤酮約60 min后5只大鼠出現行走緩慢、步態不穩癥狀,第3天3只大鼠均出現進食減少、豎尾、步態不穩加重、行走困難等現象,第4天5只大鼠均出現上述行為學表現,并隨著時間推移大鼠的表現越來越明顯。GM1治療組大鼠在實驗第1天無明顯異常行為學改變,第3天2只大鼠出現活動減少、攝食減少,第4天相同的2只大鼠出現肢前抬舉困難伴震顫、活動減少、攝食減少,但無明顯豎尾、步態不穩,第7天相同的2只大鼠仍出現前肢抬舉伴震顫、活動減少,但癥狀較前無明顯加重,1只大鼠出現活動減少,但無其它行為學改變,剩余2只大鼠無明顯行為學改變。
2.2 各組細胞存活率比較 MTT實驗顯示:正常對照組細胞存活率為96.64%,魚藤酮組細胞存活率為48.51%,GM1治療組細胞存活率為76.58%,GM1對照組細胞存活率為94.82%。單因素方差分析顯示,魚藤酮組細胞存活率低于正常對照組、GM1對照組,GM1治療組細胞存活率低于正常對照組、GM1對照組,高于魚藤酮組,差異均有統計學意義(P<0.05);正常對照組與GM1對照組細胞存活率比較,差異無統計學意義(P>0.05),見圖1。
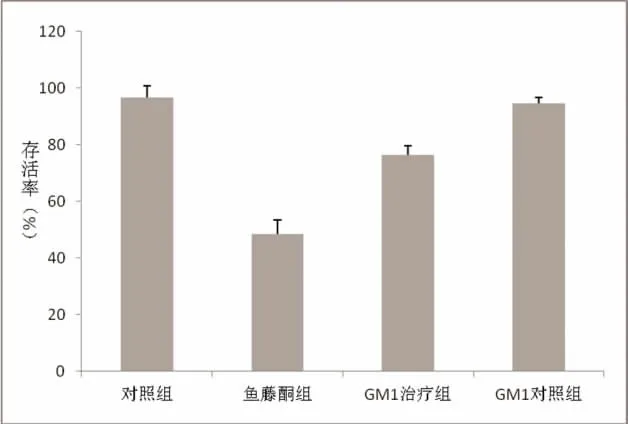
圖1 各組細胞存活率比較
2.3 免疫熒光染色結果 TH免疫組化染色顯示,正常對照組和GM1對照組神經元形態無損傷,神經元突觸無損傷;魚藤酮組TH陽性神經元數量減少,神經形態也嚴重損傷,GM1保護組TH陽性神經元的形狀及突觸的數目長度較魚藤酮組改善。TH陽性神經元計數統計顯示:正常對照組TH陽性細胞存活率為99.86%,魚藤酮組TH陽性細胞存活率為46.54%,GM1保護組TH陽性細胞存活率為74.83%,GM1對照組TH陽性細胞存活率為103.65%,見圖2。
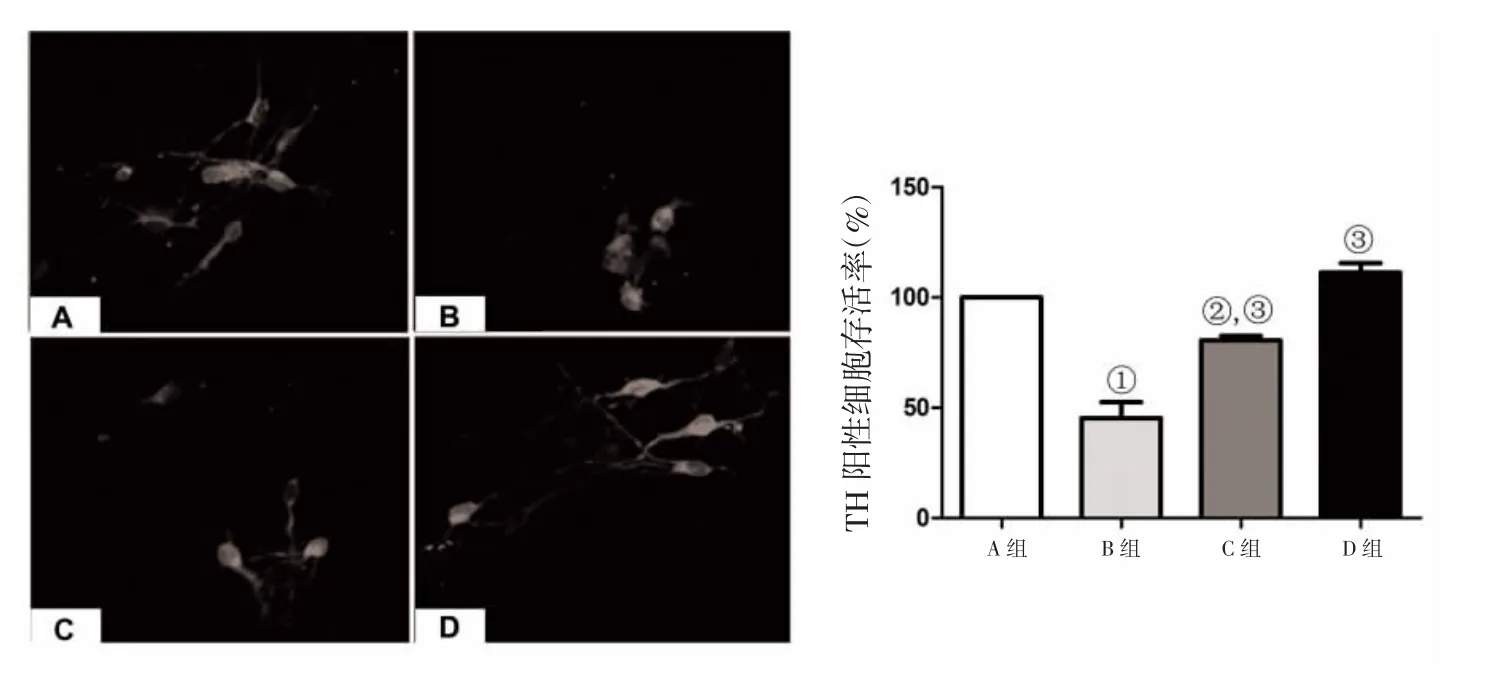
圖2 免疫熒光染色結果
3 討論
魚藤酮是一種由天然植物魚藤中提取的脂溶性物質,并于上世紀40年代起被廣泛的當作殺蟲劑在農業生產中使用,其具有很強的脂溶性,能輕易的通過血腦屏障,進入腦組織內的線粒體中,選擇性的阻斷鐵硫簇N2與泛醌Q的作用從而抑制線粒體呼吸鏈,產生細胞毒性,從而導致細胞凋亡。流行病學研究顯示,長期接觸魚藤酮的人群中其患PD的風險明顯高于普通人群[3]。實驗顯示[4],魚藤酮能使大鼠可出現類似PD的癥狀,而大鼠黑質區的多巴胺神經元則出現大量的死亡,殘存的神經元類內出現類似路易小體的包涵體結構。說明魚藤酮從流行病學角度和動物實驗模型角度均能很好的模擬帕金森病的發生,因此其已被廣泛用于制作PD模型的試劑。
本研究以魚藤酮制備PD大鼠模型,發現魚藤酮組大鼠明顯出現類似帕金森的行為學表現,而通過MMT方法檢測發現魚藤酮組大鼠中腦神經元細胞出現凋亡,同時通過免疫熒光法發現在魚藤酮組中,經過TH免疫組化染色的多巴胺能神經元在形態上出現損傷。
GM1是一種由單個唾液酸殘基和4個己糖基構成的鞘糖脂,主要分布于神經細胞的細胞膜內,它具有保護、營養神經元細胞以及促進神經細胞軸突和突觸生長等多種作用。在神經營養方面,GM1主要通過把跨膜絡氨酸激酶受體A(TrkA)磷酸化將其激活,從而激活下游多種目標蛋白,發揮其生物學作用對神經細胞進行營養,促進受損的神經元進行生長,同時它還能誘導神經營養因子(NT)家族的分泌,而分泌后的NT則可以通過激活神經元本身的Trk受體,從而進行神經營養及促進神經元細胞的生長。在抗細胞氧化方面和細胞毒性方面,GM1可以通過阻止Ca2+內流,降低自由基濃度,防止膜脂質水解,抑制細胞色素C的活性和興奮性氨基酸及花生四烯酸等的毒性作用,從而起到保護細胞作用[2]。在對抗細胞凋亡方面,GM1可以通過抑制α-突觸核蛋白的異常聚集,阻斷其所導致的氧化應激等反應,從而起到抗細胞凋亡的作用[7]。本研究發現,在經過GM1治療后帕金森大鼠的行為學較魚藤酮組改善,這與Forsayeth J等[8]的研究一致;同時,GM1治療組中大鼠中腦神經元細胞的存活率較魚藤酮組上升,進一步通過TH免疫組化染色后發現經過GM1保護后TH陽性神經元的形狀及突觸的數目長度較魚藤酮組改善,這更為直觀的說明GM1可以有效的抑制魚藤酮導致的細胞凋亡,起到保護神經元的作用。
綜上所述,GM1可緩解魚藤酮所誘導的PD大鼠行為學改變,并通過營養神經細胞、抗細胞氧化等作用減少細胞模型中神經元細胞的損傷及變性,對神經元細胞有一定的保護作用。

