O3對射流火焰燃燒特性影響的數值研究
徐 琛,孫繼昊,趙寧波
(1.中國航空綜合技術研究所,北京 100028;2.哈爾濱工程大學動力與能源工程學院,哈爾濱150001)
1 引言
為大幅降低污染物排放,現代燃氣輪機廣泛采用貧預混低排放燃燒技術[1-2]。其中,如何實現貧預混條件下的燃燒火焰穩定控制成為工業界與學術界共同關注的焦點。
作為一種先進的強化與穩定燃燒的方式,非平衡等離子體放電通過產生高能電子、離子、自由基(如O,OH)以及激發態分子(如O2*,O3)來調控化學反應路徑,提高燃燒反應速率[3-4]。現有研究表明,O3存活時間相對較長,可以被輸運至火焰區,是非平衡等離子體實現助燃和提高火焰穩定性的最重要組分之一[5]。Dong 等[6]對甲烷射流火焰的數值模擬研究表明,O3的加入可以提高火焰的傳播速度,使回流區內渦結構變得更加連續。Eha 等[7]在針對甲烷/空氣低旋流火焰開展的實驗和數值模擬研究中,同樣發現O3能提高層流火焰的傳播速度和火焰拉伸率,使得火焰可以在更強的湍流下穩定燃燒。Zhang 等[8]數值分析了O3對合成氣火焰特性及熄火極限的影響,指出O3對于提高層流火焰速度和拓寬穩定燃燒邊界具有顯著影響。此外,Tachibana[9]和Wilk[10]等分別從實驗角度分析了O3對燃燒污染物排放的影響,其結果一致表明,O3的加入雖然可以降低CO、UHC 及碳煙的排放,但是會導致NOx排放略有增加。
鑒于O3對燃燒火焰形態及典型組分濃度影響的復雜性,本文以甲烷/空氣射流火焰為研究對象,采用二維數值模擬方法分析不同O3濃度對火焰位置及CO、NO污染物排放的影響。
2 物理模型與計算域網格劃分
參考Sandia實驗室的開放空間射流火焰研究[11],本文的數值物理模型如圖1(a)所示。其中,射流燃料為25%甲烷和75%空氣(摩爾分數)的混合物,其速度為49.6 m/s,管徑D為7.2 mm;值班燃料為φ=0.77的甲烷已燃氣,其速度為11.4 m/s,管徑為18.2 mm;伴流空氣流速為0.9 m/s。綜合考慮物理模型的對稱性和數值計算量,采用圖1(b)所示的二維計算域進行數值分析。
數值研究過程中,保證燃料量和氧化劑量不變,通過改變射流燃料中O3摩爾分數來分析O3濃度對燃燒特性的影響。表1給出了不同算例下的射流燃料組分。
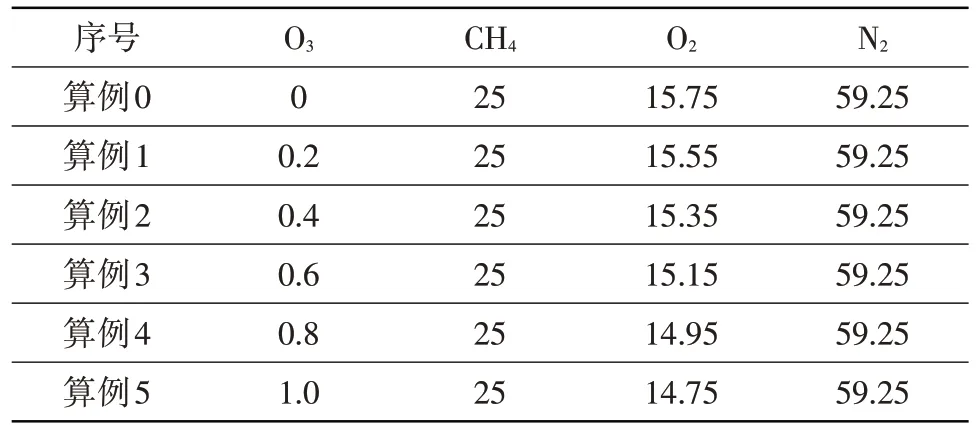
表1 射流燃料組分摩爾分數 %Table 1 Species mole fractions of jet fuel
為滿足網格無關性要求,圖2給出了算例0的網格無關性驗證結果。圖中,X/D為距離噴嘴的相對高度,縱坐標為對稱軸上的軸向速度。從圖中可以看出,當網格數大于5 500時,計算結果基本不隨網格數的增加而改變,認為滿足網格無關性要求。
3 數值方法選取及驗證
針對上述射流火焰無強旋流這一特性,選取Standardk-ε、Standardk-ω湍流模型進行湍流模型驗證,并采用絕熱條件下的標準壁面函數對近壁面進行處理。考慮到湍流燃燒中不同基元反應時間尺度的差異性,選取EDC 模型、組分輸運PDF 模型對燃燒模型進行驗證。為深入分析O3對火焰形態及燃燒反應過程中典型組分的影響,采用341 步甲烷燃燒含O3詳細反應動力學機理[2]。
圖3 給出了算例0 數值模擬結果與實驗數據[11]的對比。從圖中可以看出,采用Standardk-ε湍流模型和EDC 燃燒模型可以較好地計算得到甲烷/空氣射流火焰的溫度場及典型組分濃度分布,后續數值模擬工作將全部基于該模型進行。在X/D>40處,模擬結果與實驗數據之間誤差變大,這主要是由于火焰后方的已燃氣與環境空氣劇烈摻混,而二維網格不能很好地模擬這一現象所致。考慮到本文主要分析O3對火焰形態及燃燒過程中CO 和NOx的生成特性的影響,認為所選取的數值模型仍具有一定的適用性。
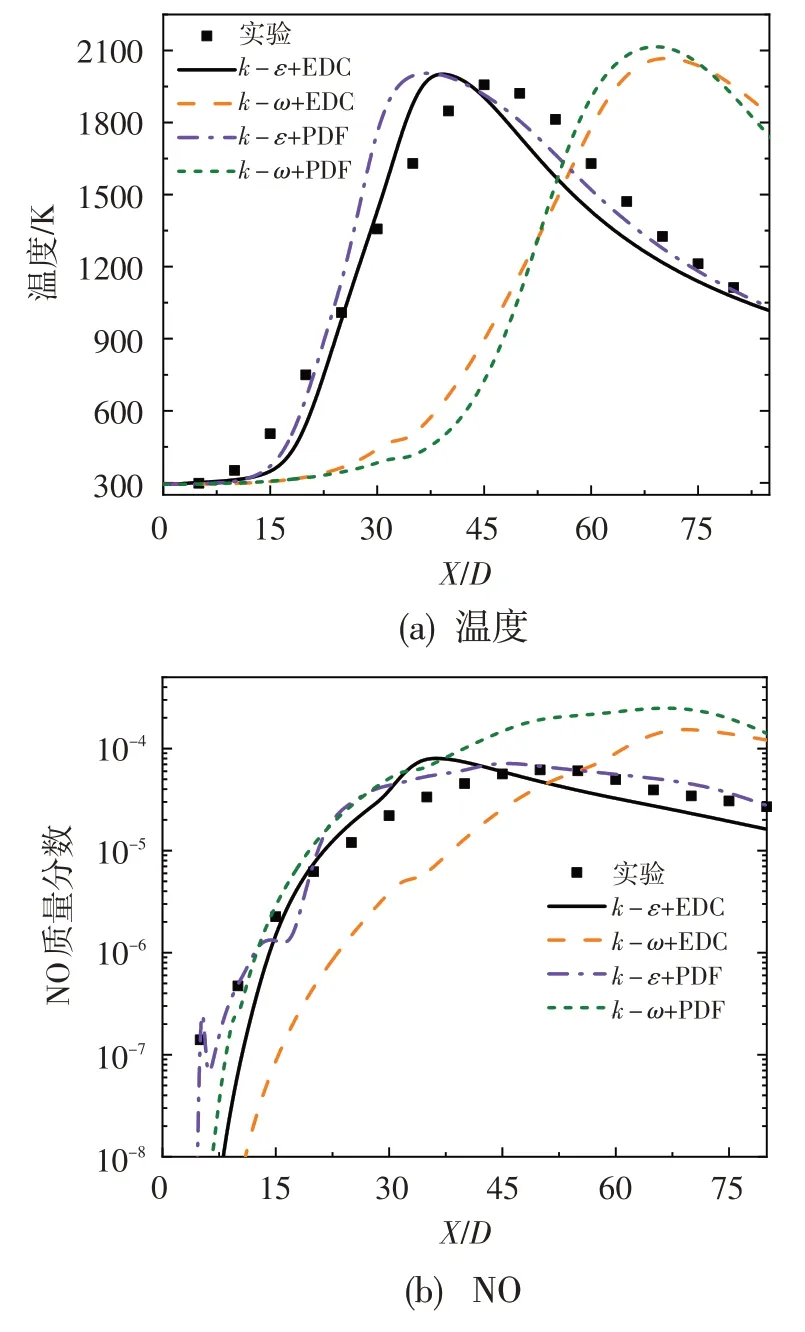
圖3 算例0的數值結果與實驗數據的對比Fig.3 Comparison between numerical results and experimental data of case 0
4 結果分析與討論
4.1 O3濃度對火焰形態的影響
由于CH自由基存活時間較短且基本上只在火焰面位置生成,所以其一定程度上可以反映火焰的形態特征。為明確不同O3濃度對火焰形態的影響,圖4 給出了算例0~算例5 條件下的CH 自由基質量分數云圖。從圖中可以看出,對于算例0和算例1而言,在火焰根部位置處均出現了火焰“斷裂”現象。而隨著O3濃度的不斷增加,CH 自由基高濃度區域逐漸向來流方向發展,且CH 自由基濃度分布變得相對較為連續。當射流入口O3濃度達到0.6%時,火焰根部斷裂現象基本消失。
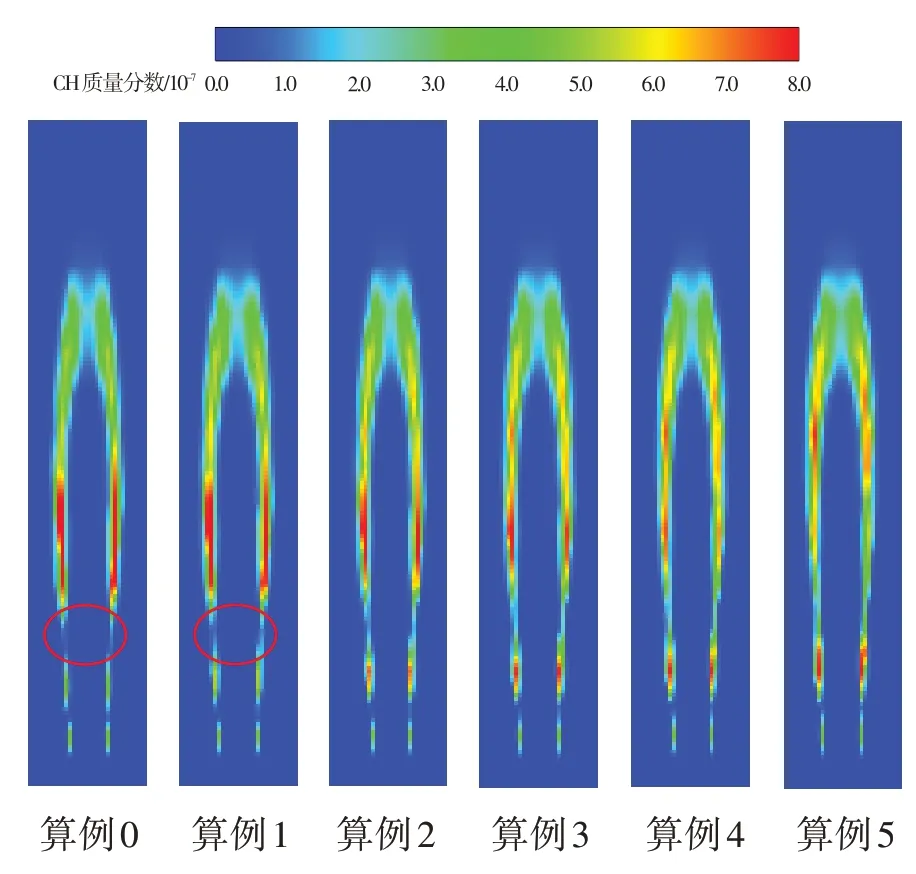
圖4 CH質量分數分布云圖Fig.4 Mass fraction distribution of CH
為分析上述現象產生的原因,圖5 給出了不同O3濃度體條件下燃料的點火延遲時間。可見,隨著射流燃料中O3濃度的增加,點火延遲時間逐漸縮短,并且這種效應在低溫點火條件下更為明顯。點火延遲時間的縮短使得算例1~算例5中的燃料在靠近噴嘴處被氧化,燃燒反應在空間上向來流方向發展。
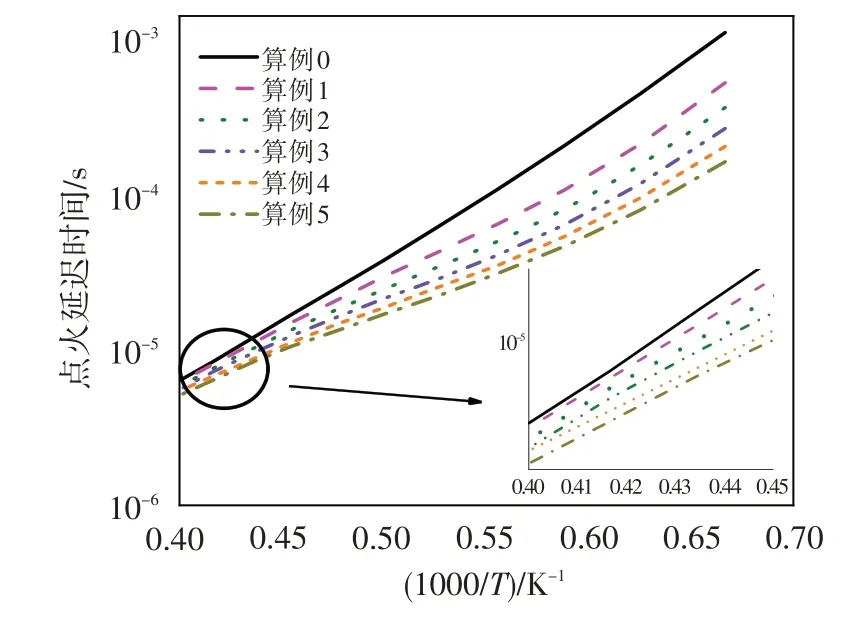
圖5 O3濃度對點火延遲時間的影響Fig.5 The influence of O3 concentration on ignition delay time
為明確O3對甲烷氧化反應的影響,以算例0 和算例5為例開展甲烷氧化敏感性分析,其結果如圖6所示。可以看出,O3的加入使得算例5 中甲烷氧化對H+CH4=CH3+H2和O+CH4=OH+CH3的敏感性系數略有增加,并且算例0和算例5對甲烷氧化最為敏感的反應均為OH+CH4=CH3+H2O。針對這一現象,圖7 給出了OH+CH4=CH3+H2O 反應速率和OH 自由基濃度在對稱軸上的分布情況。如圖所示,隨著O3濃度的增加,該反應在更加靠近噴嘴處發生,即甲烷的氧化反應會更早進行。這是由于O3的強氧化性使得OH 自由基濃度有所升高并更早生成,從而使得燃料燃燒的氧化區提前。然而值得指出的是,隨著O3濃度的增加,反應OH+CH4=CH3+H2O的最大反應速率會有所降低。其主要原因是,O3濃度增加使得甲烷氧化反應提前,后方甲烷濃度降低。此外,在本文所研究的O3濃度范圍內,少量O3的加入即可使燃燒反應的氧化區向來流方向移動,且OH 自由基最大濃度略有增加,但隨著O3濃度的繼續增加,氧化區移動現象和OH自由基最大濃度變化不再顯著。
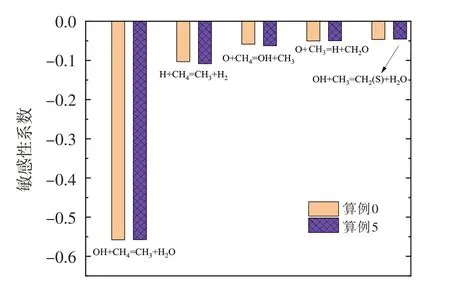
圖6 算例0和算例5的甲烷氧化敏感性分析結果Fig.6 Sensitive analysis of CH4 oxidation of case 0 and case 5
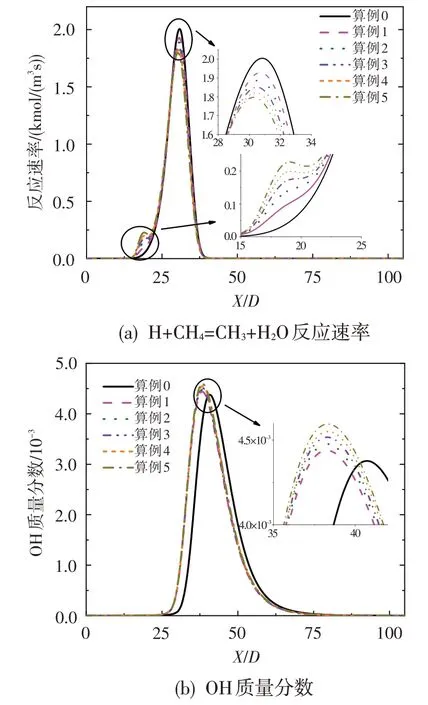
圖7 OH+CH4=CH3+H2O反應速率和OH質量分數沿對稱軸的分布Fig.7 Reaction rate of OH+CH4=CH3+H2O and OH mass fraction along axis
4.2 O3濃度對典型組分的影響
圖8 給出了CO 質量分數沿對稱軸的變化規律。可看出,由于O3具有較強的氧化性,射流火焰中加入少量O3即可使CO 提前生成且CO 最大濃度增加,繼續加入O3時變化不再明顯。此外,O3的加入能降低火焰后方的CO 濃度,但隨著O3濃度的增加,火焰后方的CO濃度下降趨勢減弱。因此,O3可以強化燃燒,提高燃燒效率并降低CO污染物排放。
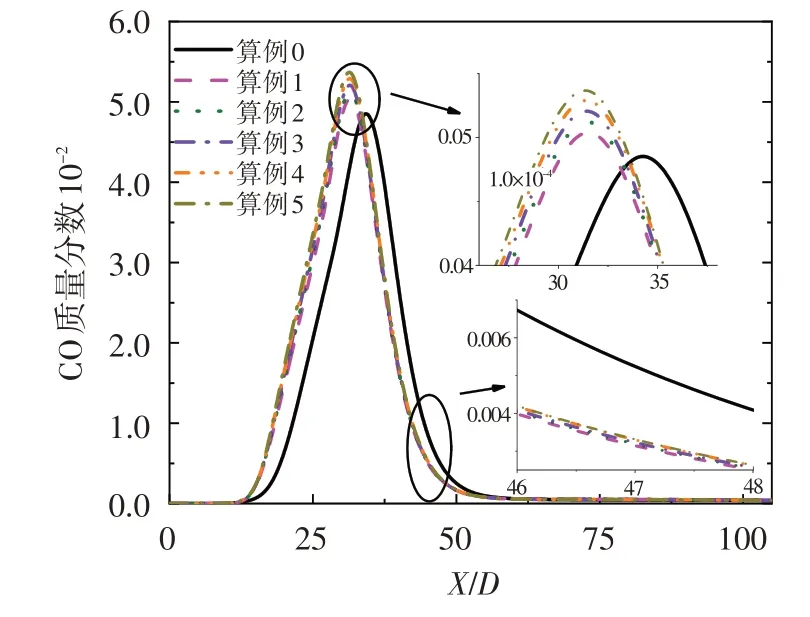
圖8 CO質量分數沿對稱軸的分布Fig.8 Mass fraction of CO along axis
為分析O3加入對射流火焰中NO 生成的影響,圖9 給出了不同算例條件下NO 質量分數和生成速率沿對稱軸的分布情況。可以看出,NO生成量和最大生成速率均隨著O3濃度的增加而有所上升,并且在本文的研究范圍內,NO生成速率增大的趨勢會隨著O3濃度的增加而減弱。此外,由于O3的加入,在X/D=25 之前的低溫燃燒區內,NO 生成的逆反應速率有所增大,并且在X/D=17附近達到最大;同時,隨著O3濃度的增加,逆反應速率逐漸增大。
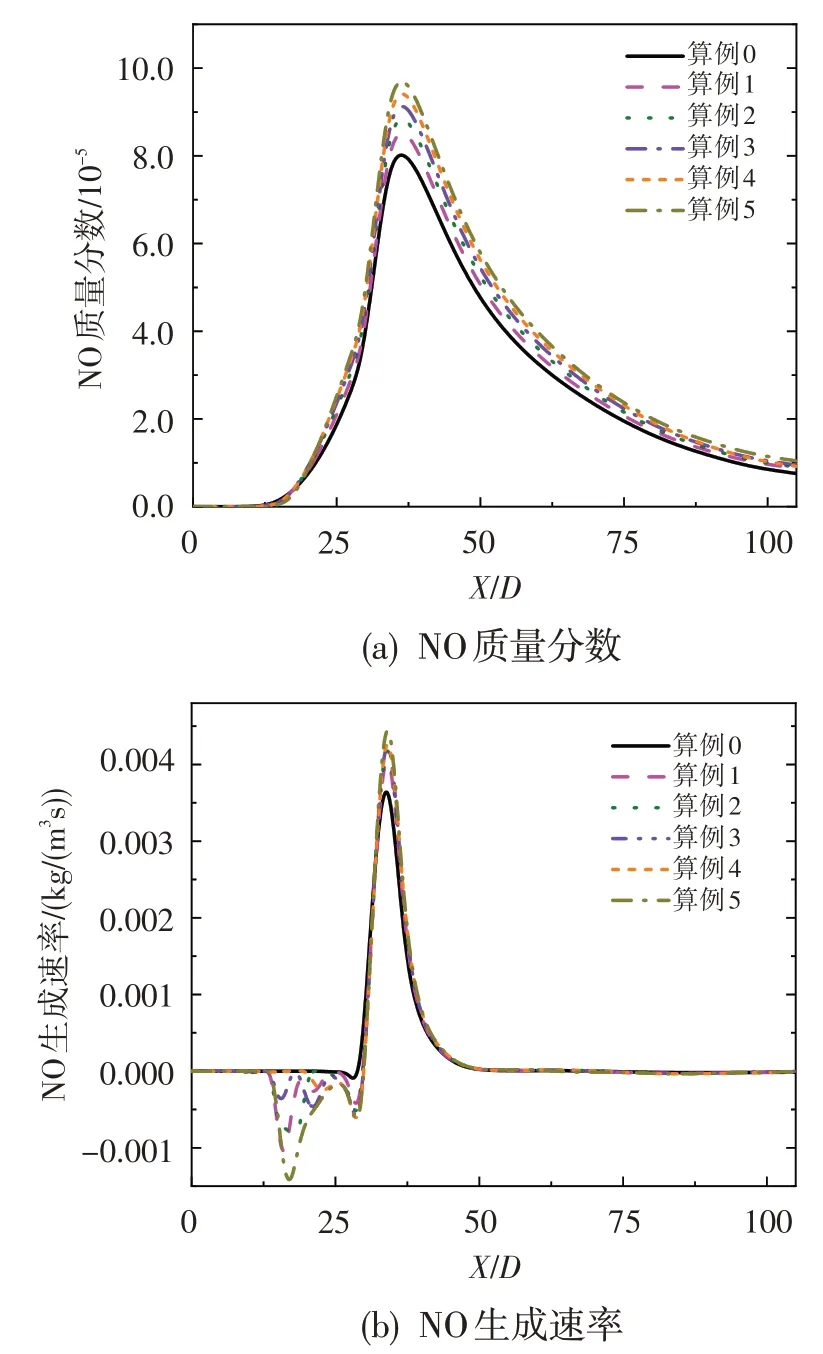
圖9 NO質量分數和生成速率沿對稱軸的分布Fig.9 Mass fraction of NO and NO production rate along axis
為揭示NO 逆反應速率隨O3濃度的變化機理,圖10 給出了算例1~算例5 中O3+NO=O2+NO2反應速率沿對稱軸的分布情況。如圖所示,隨著O3濃度的增加,該反應的正反應速率逐漸增大,并且其最大反應速率處恰好對應于圖8 中NO 逆反應速率最大處。NO 逆反應速率增大的原因,主要是由于O3的強氧化性將一部分NO轉變為了NO2。
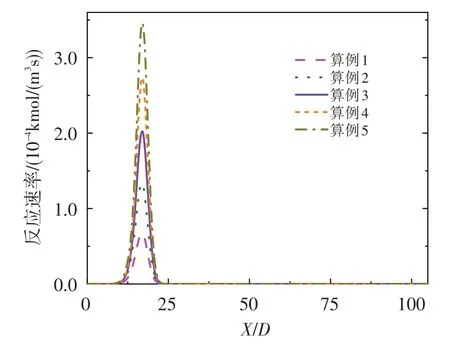
圖10 O3+NO=O2+NO2反應速率沿軸線的分布Fig.10 Reaction rate of O3+NO=O2+NO2 along axis
由于反應N2+O=NO+N(R1)活化能較大,限制了熱力型NO的生成速率,而反應CH+N2=HCN+N(R2)、反應N2+O+(M)=N2O+(M)(R3)分別為NO 生成的快速型機理和N2O 中間體機理的起始反應,限制了快速型NO和N2O中間體NO的生成速率[12]。為明確O3對NO 生成速率的影響,圖11 分別給出了上述三個反應在不同O3濃度下反應速率沿軸線的分布,并給出了不同算例下對稱軸上溫度的變化規律。從圖中可以看出,隨著O3濃度的增加,對稱軸上最高溫度略有上升,但溫度變化量很小,可認為在本文所研究的范圍內,溫度對O3濃度變化不敏感。而從反應R1、R2及R3的速率分布看,隨著O3濃度的增加,三個反應的反應速率均有所增大,但反應R3的速率變化不明顯,即N2O中間體機理對O3不敏感,O3主要促進了熱力型NO和快速型NO的生成。對比圖11(a)、圖10(b)及圖7(b)可以看出,O3對熱力型NO生成的促進不在于提高燃燒溫度,而主要在于O3的氧化性能夠使燃燒區域生成較多的中間組分自由基(如OH)從而促進NO的生成。
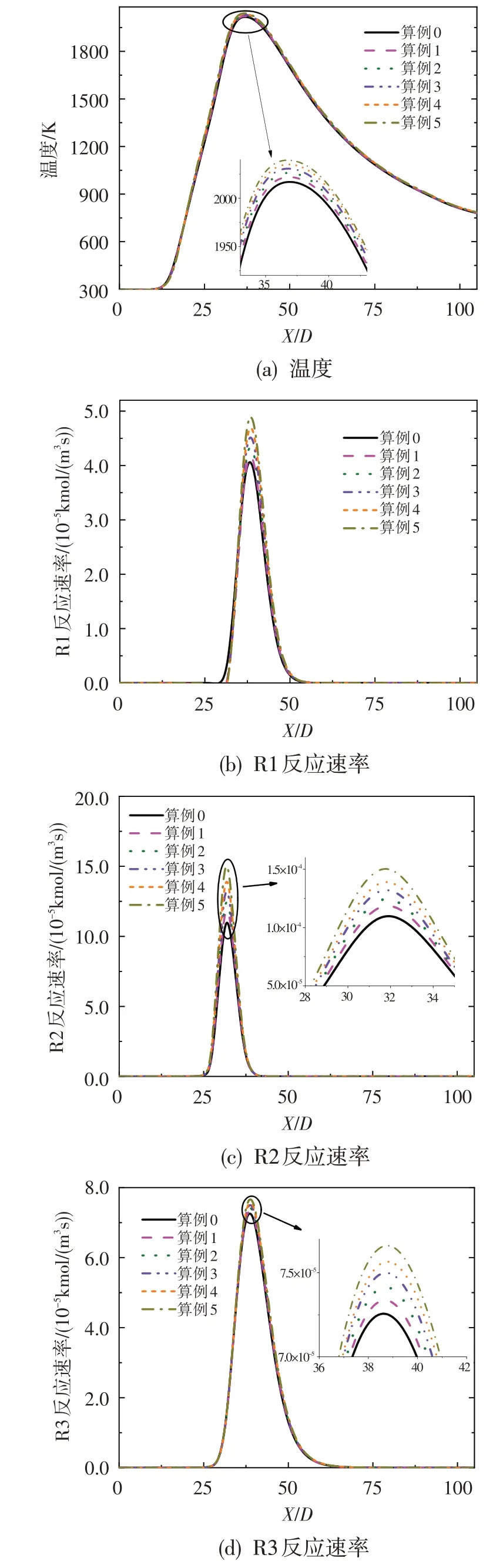
圖11 溫度及反應R1、R2、R3沿軸線的分布Fig.11 Temperature and reaction rate of R1,R2 and R3 along axis
雖然燃燒室NOx排放主要為NO,但NO 在大氣中又可被氧化為NO2[12],因此明確NO2在火焰后方的生成特性十分必要。圖12 給出不同算例下NO2及總NOx(NO+NO2)質量分數沿對稱軸的分布情況。對比圖12、圖9 及圖10 可知,NO2占NOx的比例較小,NOx中的主要成分為NO[12];且隨著O3濃度的增加,在X/D=25 之前NO 經反應O3+NO=O2+NO2生成NO2的速率加快,進而導致該位置NO2濃度增加。此外,少量O3的加入即可顯著增加火焰后方(X/D>50處)NO2生成量,但隨著O3的繼續加入,火焰后方NO2生成量的增加不再顯著。
圖13 給出NO2的生成路徑圖,其中線的粗細表示反應對組分生成或消耗的貢獻大小。對比圖12、圖13可以看出,在NO2濃度達到第一個峰值(X/D=17附近)后,生成的NO2又經反應NO2+H=NO+OH 轉化為NO;而在火焰后方,NO 又經反應NO+O+(M)=NO2+M和反應HO2+NO=NO2+OH氧化為NO2。
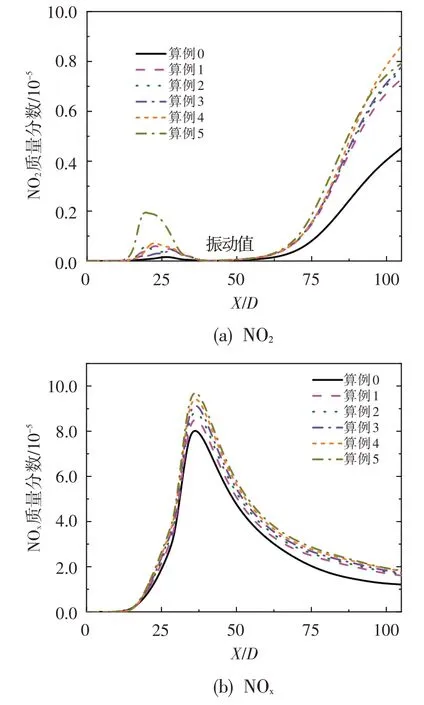
圖12 NO2及NOx質量分數沿對稱軸的分布Fig.12 Mass fractions of NO2 and NOx along axis
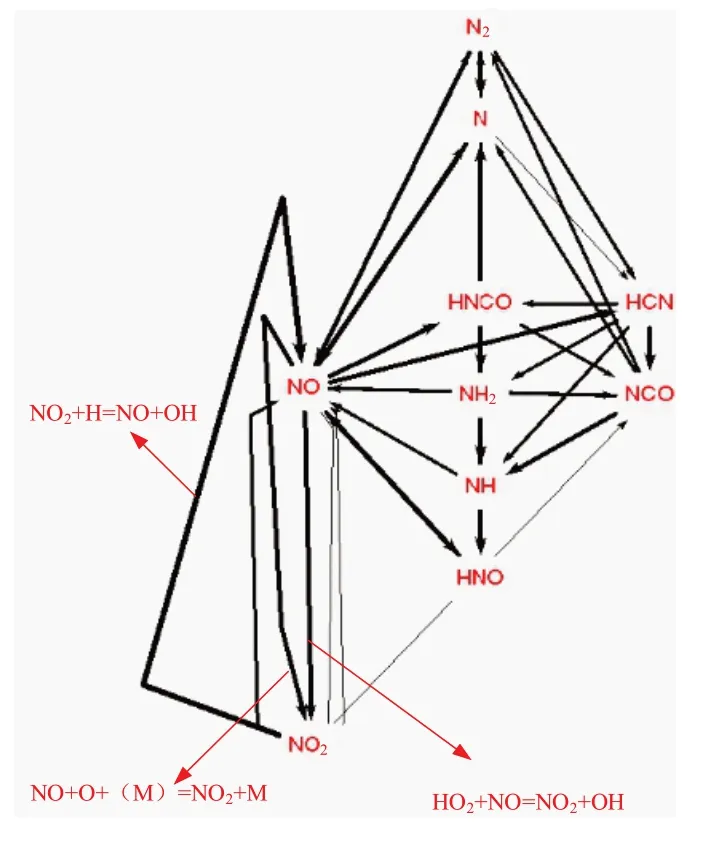
圖13 NO2生成路徑圖Fig.13 NO2 generation path
5 結論
(1)O3可以使燃燒更加穩定,提高燃燒效率并降低CO 排放。在射流燃料中添加O3后,O3的強氧化性使得OH 自由基在更靠近噴嘴的位置處生成,燃燒反應的氧化區提前,導致甲烷氧化反應OH+CH4=CH3+H2O 提早進行,火焰向噴嘴處發展;當射流燃料中O3濃度達到0.6%時,火焰根部斷裂現象消失。
(2)O3的加入會增大NO生成速率,且NO生成速率隨著O3濃度的增加而逐漸增加。主要原因是O3促進了熱力型NO 和快速型NO 的生成,而N2O 中間體機理對O3不敏感;O3主要通過其強氧化性生成較多的自由基(如O、OH)對熱力型NO的生成進行貢獻,而不是通過溫度增加加快反應N2+O=NO+N的反應速率。
(3)O3可以使NO 在低溫燃燒區經反應O3+NO=O2+NO2被氧化為NO2,且該反應速率會隨著O3濃度的增加而逐漸增大。NO2濃度達到第一個峰值后,生成的NO2又經反應NO2+H=NO+OH 轉化為NO;而在火焰后方,NO又經反應NO+O+(M)=NO2+M和反應HO2+NO=NO2+OH氧化為NO2。

