乙型肝炎病毒通過抑制AGE-Rs表達促進AGEs誘導的肝癌細胞增殖
王 標, 陳 艷
肝細胞癌(hepatocellular carcinoma, HCC)是人類最常見的惡性腫瘤之一,死亡率位列癌癥的第2位[1]。目前,乙型肝炎病毒(hepatitis B virus, HBV)慢性感染是HCC最主要的危險因素,占病例總數的50%以上[2]。晚期糖基化終產物(advanced glycation end products,AGEs)是蛋白質、脂肪和核酸與還原糖發生非酶促糖基化反應(Maillard反應)形成的不可逆的終產物[3]。糖尿病患者體內血糖水平高,AGEs病理性增加,從而參與了多種糖尿病并發癥的發生發展過程,例如糖尿病腎病、冠狀動脈粥樣硬化性心臟病(冠心病)、高血壓病、阿爾茨海默癥等[4]。由于肝臟是代謝、降解、清除AGEs的重要器官[5],越來越多的研究關注AGEs與HCC之間的聯系[6-8]。AGEs主要通過與相應的受體(AGE-Rs)結合發揮其生物學功能。目前已發現的AGE-Rs包括AGE受體(receptor for advanced glycation end products,RAGE)、低聚糖轉移酶-48(OST-48, AGE-R1)、80K-H磷酸蛋白(AGE-R2)、β-半乳糖凝集素-3(galectin-3, AGE-R3)以及清道夫受體B類Ⅰ型(MSR-BI, CD36)和A類Ⅱ型(MSR-AⅡ)等[9],其中AGEs與RAGE結合誘導胞內活性氧壓力升高,導致炎癥反應、血管新生和細胞增殖等;與AGE-R1、AGE-R2或AGE-R3結合形成復合物,負責AGEs的脫毒和清除[10]。研究發現,AGE-Rs具有拮抗AGEs-RAGE的作用[9,11-14]。本研究旨在探討HBV對AGE-Rs表達及AGEs誘導的HCC細胞增殖的影響,為探討HBV通過影響AGEs的作用從而促進HCC的可能性提供線索,以期進一步拓展HBV感染引發HCC的致病機制。
1 材料與方法
1.1材料
1.1.1質粒和細胞株 重組質粒pRep-1.2HBV為將1.2倍B基因型HBV的基因組克隆于表達載體pRep10(美國Invitrogen公司)上所得,其對照質粒pRepSal為表達載體pRep10去除表達盒后改造而成[15];HCC細胞株HepG2和HepG2.2.15由本實驗室保存,HepG2.2.15 為攜帶有HBV基因組的肝癌細胞株。
1.1.2主要試劑 DMEM高糖培養基、胰酶、抗生素G418和Puromycin(美國Gibco公司);胎牛血清(德國PAN公司);轉染試劑Lipofectamine 3000(美國Thermo Fisher公司);TRIzol(美國Invitrogen公司);逆轉錄試劑盒PrimeScriptTMRT reagent Kit、TB Green?Premix Ex TaqTM試劑和高保真PrimeSTAR?HS DNA Polymerase(日本TaKaRa公司);引物(福州鉑尚生物技術有限公司);質粒抽提試劑盒(德國Qiagen公司);anti-AGE-R1抗體和anti-AGE-R3抗體(武漢三鷹生物技術有限公司);anti-β-actin抗體和兔二抗(美國Cell Signaling公司);Western及IP細胞裂解液和BCA蛋白濃度測定試劑盒(中國碧云天生物技術公司);CCK-8檢測試劑(日本同仁化學研究所)。
1.2方法
1.2.1細胞培養和細胞轉染 HCC細胞株HepG2和HepG2.2.15用DMEM高糖培養液(含10%胎牛血清)培養于37 ℃的CO2細胞培養箱。HepG2.2.15的培養液中需添加抗生素G418(380 μg/mL)。HepG2和HepG2.2.15細胞以每孔2.5×106個細胞數接種于6 cm的細胞培養皿,24 h后收獲細胞。細胞轉染的前1天,HepG2細胞以每孔6×105個細胞數接種于35 mm的6孔細胞培養皿中,20 h后用轉染試劑Lipofectamine 3000進行轉染,pRepSal、pRep-1.2HBV轉染量為每孔3 μg,轉染后48 h收獲細胞。
1.2.2實時熒光定量PCR 使用TRIzol試劑提取RNA,隨后使用逆轉錄試劑盒PrimeScriptTMRT reagent Kit獲取cDNA,具體步驟參照試劑盒說明書。利用獲得的cDNA和TB Green?Premix Ex TaqTM試劑進行實時熒光定量PCR,每個樣本每種基因做3個復孔,引物序列見表1。
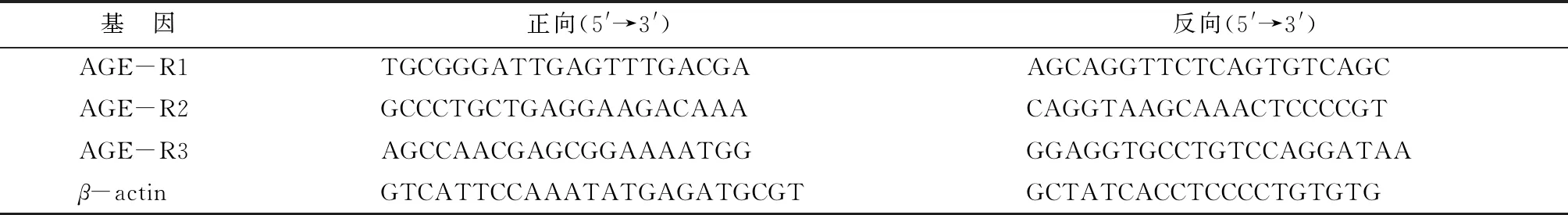
表1 實時熒光定量PCR引物序列Tab.1 Primer sequences for Real-time PCR
1.2.3蛋白質免疫印跡法(Western-blot) 采用Western及IP細胞裂解液提取細胞總蛋白,采用BCA法測定總蛋白濃度后進行Western-blot實驗,以anti-AGE-R1、anti-AGE-R3和anti-β-actin抗體檢測目標蛋白表達。掃描蛋白條帶的灰度值,以β-actin為內參進行標準化,實驗重復3次,取平均值作圖進行分析。
1.2.4CCK-8法檢測細胞增殖 HepG2和HepG2.2.15細胞以每孔5×103個細胞數接種于96孔板,以含AGEs(100 μg/mL)和葡萄糖(5.6 mmol/L)的DMEM培養液培養細胞,每組設置5個復孔,連續檢測7 d。檢測時,去除原培養液,每孔加入90 μL無血清DMEM培養液和10 μL CCK-8孵育1 h,在酶標儀上以450 nm波長測定每孔光密度(OD)值。將第1天的OD值定為1,以天數為橫坐標繪制增殖曲線。
2 結 果
2.1HepG2和HepG2.2.15細胞中AGE-Rs的mRNA表達水平 實時熒光定量PCR結果顯示,與HepG2細胞比較,HepG2.2.15細胞中AGE-R1和AGE-R3的mRNA表達水平均顯著下降(P<0.05),而AGE-R2的mRNA表達水平則無明顯變化(圖1)。
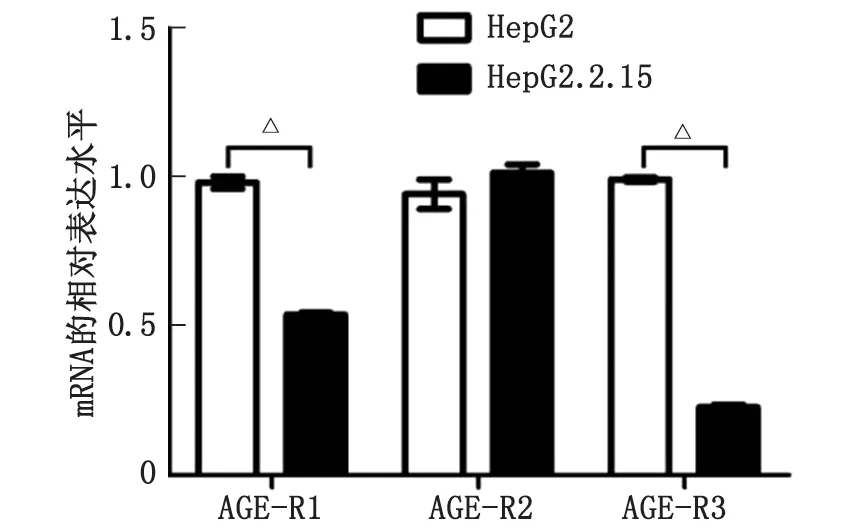
AGE:晚期糖基化終產物。與對照組比較,△:P<0.05。圖1 實時熒光定量PCR檢測HepG2和HepG2.2.15細胞中AGE-Rs mRNA表達Fig.1 The mRNA expression levels of AGEs-Rs in HepG2 and HepG2.2.15 detected by Real-time PCR
2.2過表達1.2 HBV對AGE-Rs mRNA表達水平的影響 HepG2細胞瞬時轉染重組質粒pRep-1.2HBV及其對照質粒pPepSal后,進行實時熒光定量PCR實驗,結果顯示,與pRepSal轉染組比較,轉染pRep-1.2 HBV的HepG2細胞中AGE-R1和AGE-R3的mRNA表達水平均降低(P<0.05),而AGE-R2的mRNA表達水平則無明顯變化(圖2)。
2.3HepG2和HepG2.2.15細胞中AGE-Rs蛋白表達水平 提取HepG2和HepG2.2.15細胞的總蛋白進行Western-blot實驗,結果顯示,與HepG2細胞比較,HepG2.2.15細胞中AGE-R1和AGE-R3的蛋白表達水平均明顯下降,差別具有統計學意義(P<0.05,圖3)。
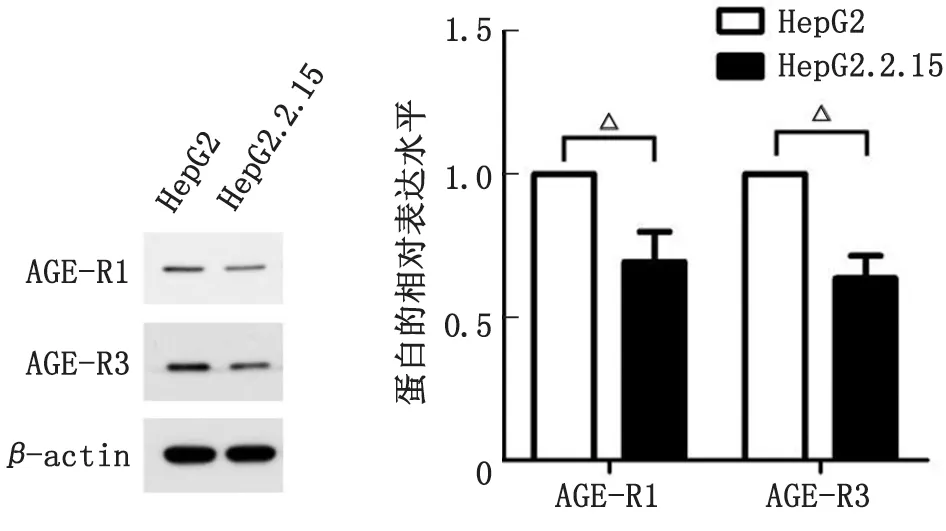
AGE:晚期糖基化終產物。與對照組比較,△:P<0.05。圖3 Western-blot檢測HepG2和HepG2.2.15細胞中AGE-R1和AGE-R3蛋白表達Fig.3 The protein expression levels of AGEs-R1 and AGE-R3 in HepG2 and HepG2.2.15 detected by Western-blot
2.4過表達1.2 HBV對AGE-Rs蛋白表達水平的影響 HepG2細胞瞬時轉染重組質粒pRep-1.2HBV及其對照質粒pRepSal,48 h后提取總蛋白進行Western-blot檢測,結果顯示,與對照組比較,轉染1.2倍HBV基因組的細胞中,AGE-R1 和AGE-R3的蛋白表達水平均顯著下降,差別具有統計學意義(P<0.05,圖4)。

AGE:晚期糖基化終產物。與對照轉染組比較,△:P<0.05。圖4 瞬時轉染HBV對AGE-R1和AGE-R3蛋白表達的影響Fig.4 The influence of transient transfection of HBV on protein expression of AGEs-R1 and AGE-R3
2.5HBV促進AGEs誘導的HCC細胞增殖 為驗證HBV是否通過抑制AGE-R1和AGE-R3表達促進AGEs誘導的HCC細胞HepG2增殖,以100 μg/mL的AGEs誘導HCC細胞HepG2和HepG2.2.15,并采用CCK-8法檢測細胞的增殖情況。結果顯示,從第4天起,在AGEs誘導下,HepG2.2.15細胞的增殖明顯高于HepG2細胞,差別具有統計學意義(P<0.05,圖5),說明HBV可促進AGEs誘導的HCC細胞增殖。
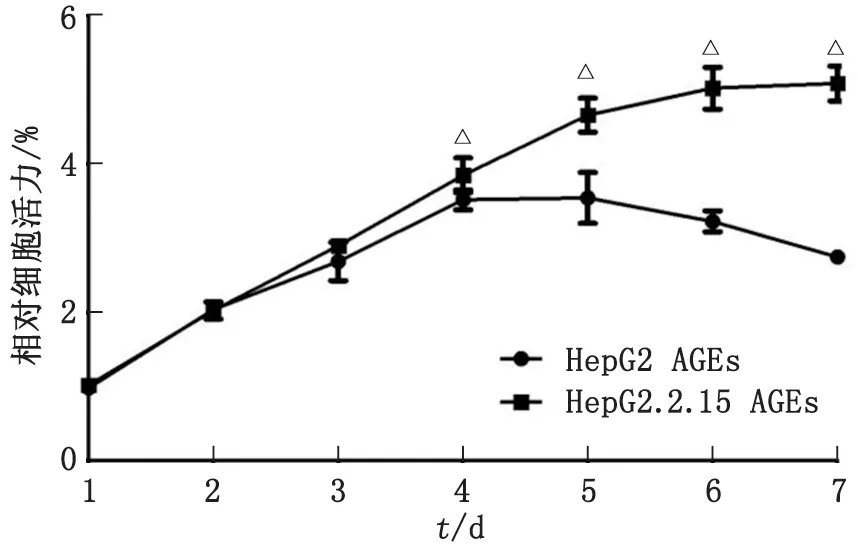
AGE:晚期糖基化終產物。與HepG2 AGEs對照組比較,△:P<0.05。圖5 HBV對AGEs誘導肝癌細胞增殖的影響Fig.5 The influence of HBV on the proliferation of hepatoma cells induced by AGEs
3 討 論
HBV感染是嚴重威脅人們健康的公共衛生問題。全球近30%人口曾感染過HBV,目前慢性乙肝患者已超過3.5億人,且每年約有78萬人死于HBV相關性疾病[16]。在慢性乙肝患者中,25%的患者將逐漸發展為肝纖維化、肝硬化及HCC而危及生命[17]。HBV感染是HCC的關鍵致病因素,因此,深入研究HBV的致癌機制,可為HCC的預防和治療提供有力的理論依據。
AGEs的形成是一個緩慢的過程。最初大分子物質的氨基與糖分子的醛基發生反應,形成可逆的Schiff堿,隨后Schiff堿經過一系列分子重排形成酮氨類化合物,再進一步脫水和凝聚,最終形成不可逆的終產物[18]。AGEs包括外源性和內源性2種。外源性AGEs主要從外界攝入,包括吸煙或進食某些食物;內源性AGEs主要由機體自身合成,在正常個體中,內源性AGEs會隨年齡的增長緩慢形成,而高血糖則大大加快這一過程,因此,糖尿病患者體內AGEs含量較正常人群顯著增高。AGEs含量增多是糖尿病患者的重要病理特征,是多種糖尿病并發癥發生的關鍵致病因子。肝臟是代謝和清除AGEs的重要器官,AGEs可作用于肝臟引發各種肝臟疾病,包括HCC、非酒精性脂肪性肝病和肝硬化[5]。Chen等[6-7]的研究發現,AGEs通過誘導ROS增高,促進碳水化合物反應元件結合蛋白(carbohydrate response element binding protein, ChREBP)的表達和HCC細胞的增殖。Takino等[8]指出,AGEs可提高血管內皮生長因子(vascular endothelial growth factor,VEGF)的表達,增強HCC細胞血管新生的能力。Sato等[19]給大鼠口服AGEs含量較高的飲料,發現大鼠肝臟中AGEs富集并誘導肝細胞VEGF表達,提示食源性的AGEs可能具有致HCC的作用。由此可見,AGEs是糖尿病患者HCC患病率高的一個重要因素。
AGEs的致病作用主要由其受體RAGE介導,AGEs-RAGE可激活胞內多條信號通路,例如NF-κB,MAPK,JAK-STAT及PI3K信號通路,誘導ROS上升,導致炎癥、細胞增殖、血管新生等[20]。除了RAGE之外,AGEs還可與AGE-Rs結合。與RAGE不同的是,AGE-Rs發揮著降解、清除AGEs的作用。AGE-R1和AGE-R3與AGEs具有較高的親和力,而AGE-R2無法直接與AGEs結合,需與AGE-R1以及AGE-R3形成復合物后發揮作用。研究發現,AGE-R1可加速AGEs的清除,抑制RAGE信號通路,從而降低ROS和促炎細胞因子的產生[3]。AGE-R3可干擾RAGE通路,對AGEs誘導的組織損傷發揮保護作用[13]。提示任何引起AGE-Rs表達改變的因素,均可能影響AGEs-RAGE信號通路的致病作用。
本研究關注了HBV對AGE-Rs表達的影響,發現HBV可抑制AGE-R1和AGE-R3的mRNA和蛋白的表達水平,但并不影響AGE-R2的表達,提示HBV可能會抑制肝臟對AGEs的清除,造成AGEs累積,從而增強AGEs-RAGE信號通路,促進HCC的發生。研究發現,AGEs可促進HepG2細胞增殖,而本研究利用CCK-8實驗證實了HBV會促進AGEs作用下的HCC細胞增殖,進一步說明HBV通過抑制AGE-R1和AGE-R3的表達來促進AGEs誘導的HCC細胞增殖。
大量流行病學證據指出,糖尿病可提高HCC的患病風險,使用治療糖尿病的藥物二甲雙胍可以降低HCC的發病率[21-25]。可見,糖尿病也是HCC發生的重要獨立危險因素。Tan等[26]的一項系統性回顧和薈萃分析發現,糖尿病可提高乙肝患者HCC的發生率,這意味著乙肝合并糖尿病將大大提高HCC的發病率。然而,HBV與糖尿病之間是否存在相互影響進而促進HCC的發生發展,目前尚不清楚。本研究發現,HBV可通過抑制AGE-R1和AGE-R3的mRNA和蛋白的表達水平,促進AGEs誘導下HCC細胞的增殖。由于AGEs是糖尿病患者HCC高發的重要致病因素,因此這一結果不僅豐富了HBV的信號調控網絡,也為進一步探討HBV與糖尿病的共同致癌機制奠定了基礎。然而,HBV如何影響AGE-Rs表達,下游哪些信號通路受到影響仍不清楚,目前相關研究仍在進行中。

