生物大分子介導(dǎo)仿生礦化制備磁性納米粒子的研究進展
周雁紅,李夏蘭,張光亞
(華僑大學(xué)化工學(xué)院,福建廈門361021)
磁鐵礦(Fe3O4)納米粒子因其在固定化酶、生物材料的標(biāo)記、磁性分離、核磁共振成像、定向給藥和熱療等方面的突出應(yīng)用,而活躍于大眾視野中[1]。納米材料的應(yīng)用很大程度上依賴于顆粒的大小和形貌,近年來針對其形貌和大小的研究報道也越來越多[2-4]。Fe3O4納米粒子在直徑低于一定尺寸(一般為25~30nm)時,可以表現(xiàn)出一種稱為超順磁性的獨特形式[5],即在外界磁場作用下極易被磁化,外界磁場撤銷后在極短時間內(nèi)退磁,沒有磁滯現(xiàn)象,矯頑力為零[6]。不同種類磁性納米顆粒顯現(xiàn)超順磁性的臨界尺寸是不同的。
然而,傳統(tǒng)共沉淀方法制備Fe3O4納米粒子需要使用有機溶劑和高溫條件,對反應(yīng)條件要求較高,且因排放有毒氣體對環(huán)境造成污染或因反應(yīng)劇烈造成事故。傳統(tǒng)共沉淀法制備出的Fe3O4納米粒子雖具有很高的分散性,但形貌難以精確控制[7]。為解決Fe3O4納米粒子因環(huán)境、反應(yīng)條件及其顆粒尺寸、形貌帶來的重重困難,有研究者開始轉(zhuǎn)向應(yīng)用仿生礦化的方法制備出大小、形貌均一的Fe3O4納米粒子[8-10]。本文介紹了在自然界中微生物體內(nèi)存在的生物大分子(蛋白質(zhì))介導(dǎo)的生物礦化、人工模擬菌體內(nèi)相關(guān)作用蛋白質(zhì)的結(jié)構(gòu)和組成介導(dǎo)體外仿生礦化制備Fe3O4納米粒子及人工合成多肽在介導(dǎo)產(chǎn)生Fe3O4納米粒子中的作用,總結(jié)了在生物礦化、仿生礦化、利用人工模擬生物礦化相關(guān)蛋白對Fe3O4的成核過程的影響及利用人工合成多肽對Fe3O4尺寸的影響,探索Fe3O4的成核機制,討論了核心氨基酸的作用原理,這有助于進一步闡明生物大分子在磁鐵礦成核過程中的機制,有望推動磁性納米材料在生物化工及醫(yī)學(xué)等領(lǐng)域的應(yīng)用。
1 傳統(tǒng)磁性納米材料的制備方法
磁性納米粒子/磁性納米顆粒(magnetic nanoparticles,MNPs)是近年來發(fā)展迅速且極具應(yīng)用價值的新型材料,在現(xiàn)代科學(xué)的眾多領(lǐng)域如生物醫(yī)藥、磁流體、催化作用、核磁共振成像、數(shù)據(jù)儲存和環(huán)境保護中得到越來越廣泛的應(yīng)用。在眾多研究人員的共同努力下,納米技術(shù)在生命科學(xué)和生物醫(yī)藥領(lǐng)域取得重大研究進展,推動了分子生物學(xué)和細(xì)胞生物學(xué)的發(fā)展。磁性納米粒子是納米級的顆粒,一般由鐵、鈷、鎳等金屬氧化物組成的磁性內(nèi)核及包裹在磁性內(nèi)核外的高分子聚合物/硅/羥基磷灰石殼層組成。最常見的內(nèi)核是由具有超順磁或鐵磁性質(zhì)的Fe3O4制成,基于這一磁性性能,磁性納米粒子可以實現(xiàn)定向移動和介質(zhì)分離,常用于生物醫(yī)藥方面諸如蛋白質(zhì)、酶、抗原、抗體、核酸提取的磁性分離、磁性轉(zhuǎn)染、腫瘤熱療和傳感器等[11]。傳統(tǒng)常用制備磁性納米粒子的方法包括熱分解法[12]、微 乳液 法[13]、水 熱 法[14]、化 學(xué) 沉 淀 法[15],見表1。
合成Fe3O4磁性納米粒子的方法在過去幾十年里得到了廣泛研究,常見方法合成納米粒子的透射電鏡圖見圖1。其中熱分解法是在含有表面活性劑作為穩(wěn)定劑的高沸騰有機溶劑中控制氧化得到Fe3O4納米粒子,試劑比例、反應(yīng)時間和反應(yīng)溫度對控制其粒徑和形態(tài)均具有決定作用。如Li等[16]以高沸點、強極性的2-吡咯烷酮作為反應(yīng)傳熱介質(zhì),以乙酰丙酮鐵作為原料,采用熱分解法制備出粒徑分布較窄(平均尺寸為9.8nm±1.4nm)、磁響應(yīng)強且具有良好生物相容性的Fe3O4納米粒子,可用于核磁共振造影劑。微乳液法常用于制備粒徑分布較好的磁流液,反應(yīng)物在微乳液滴作為微型反應(yīng)器的內(nèi)部進行化學(xué)反應(yīng),有效避免粒子之間的團聚現(xiàn)象,從而有效控制顆粒大小,使制備出的粒子具有較窄的粒度分布,獲得各種粒徑的單分散納米粒子。如Asab等[17]采用油包水微乳液法(W/O)制備了3種不同溫度下(30℃、50℃和80℃)的具有熱穩(wěn)定性的高結(jié)晶度花朵狀Fe3O4納米粒子(粒徑 分 別 為7.85nm±0.01nm、8.41nm±0.13nm和10.83nm±0.02nm),通過改變反應(yīng)溫度和前體濃度獲得不同尺寸的納米粒子,微乳液法是獲得可控尺寸納米粒子的一種有效方法。但在實際應(yīng)用中,微乳液技術(shù)合成納米材料條件苛刻、產(chǎn)量低、難以規(guī)模化生產(chǎn)。水熱法采用水作為反應(yīng)介質(zhì),在高溫高壓的反應(yīng)條件下生成反應(yīng)物,經(jīng)分離和熱處理得到納米粉體,制備的Fe3O4納米粒子具有晶體尺寸可控、高單分散性和粒徑一致的特點,但采用水熱法制備納米材料的反應(yīng)過程對其設(shè)備要求苛刻,需要高溫高壓的反應(yīng)環(huán)境,因此這種方法仍需進一步改良。從近年發(fā)展趨勢看,化學(xué)共沉淀法仍然是制備Fe3O4最常用的方法。以二價鐵離子與三價鐵離子的混合鹽溶液(Fe2+∶Fe3+=1∶2)為前體,在室溫條件下,增強溶液的堿性可直接產(chǎn)生磁性納米粒子,機制較為復(fù)雜[18]。經(jīng)過早期的開拓工作,許多研究小組報道了鐵氧化物之間的各種相變,堿性介質(zhì)中鈣鈦礦(akaganeite)向針鐵礦(goethite)和/或赤鐵礦(hematite)的相變[19]、針鐵礦(goethite)轉(zhuǎn)變?yōu)槌噼F礦(hematite)的 過 程[20]、赤 鐵 礦(hematite)轉(zhuǎn) 變 為 磁 鐵 礦(magnetite)[21]和 磷 云 母(lepidocrocite)轉(zhuǎn) 變 為磁鐵礦(magnetite)[22-23]以及相變中間體的針鐵礦(α-FeOOH)、鈣鈦礦(β-FeOOH)、磷云母(γ-FeOOH)[24],其中Fe2+和Fe3+在制備磁性納米粒子的途徑中各自獨立但又相互關(guān)聯(lián)。該工藝因其可規(guī)模化生產(chǎn)、可重復(fù)性好、反應(yīng)條件友好而被認(rèn)為具有重要的工業(yè)價值。然而,通過這種方法制備出的納米粒子尺寸分布范圍較廣[11]。因此,改變方法制備Fe3O4磁性納米粒子、改善磁性納米粒子的尺寸分布和形貌具有重要意義。

表1 常見合成Fe3O4納米粒子方法的比較
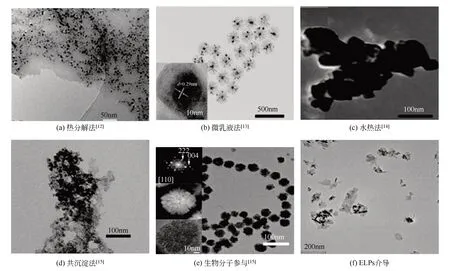
圖1 常見方法合成納米粒子的透射電鏡(TEM)圖
2 生物礦化
生物系統(tǒng)是一個非常優(yōu)秀的自我組裝實例。生物自組裝的例子廣泛活躍于一個大尺度范圍內(nèi),從形成納米病毒的蛋白質(zhì)和核酸的組裝到多細(xì)胞動物[23]。生物礦化是指生物有機體指導(dǎo)無機礦物結(jié)構(gòu)的組裝過程[24],例如在單細(xì)胞放射蟲的細(xì)胞內(nèi)微骨骼中可以觀察到生物礦化的產(chǎn)物,包覆硅藻、軟體動物殼和脊椎動物的骨骼和牙齒的形態(tài)各異的果子[27-29]。在實驗室中,這種定向的生物系統(tǒng)組裝常常會產(chǎn)生復(fù)雜的空間組織層次及精細(xì)的結(jié)構(gòu)(如星形圖案和生長到中尺度或者大尺度的形貌),這與無機材料的生長過程形成了鮮明的對比[28,30]。雖然自然界中生物來源差異很大,產(chǎn)生的納米粒子形貌差異也很大,但仍然可以認(rèn)為生物礦化的產(chǎn)物是通過有機模板中大分子支架和結(jié)合元件來協(xié)調(diào)納米粒子的成核過程,從而進一步控制納米粒子的大小分布及其形貌[31]。生物礦化過程除了具有明顯的生物學(xué)意義外,對無機結(jié)構(gòu)在尺度和形貌上的精細(xì)控制也產(chǎn)生了重大的推動作用[32]。
相比之下,研究者們設(shè)計的具有多尺度自組裝結(jié)構(gòu)元件的能力仍十分有限。但這并不意味著人們對于在納米尺度上精確定制具有特殊結(jié)構(gòu)和功能材料的興趣會戛然而止。相反,這種產(chǎn)生新功能的可能性激發(fā)了持續(xù)增長的研究興趣,成為仿生礦化領(lǐng)域的研究熱點和前沿。
生物有機體借助生物礦化相關(guān)蛋白調(diào)節(jié)晶體成核過程[33]、形貌[34]以及晶體組裝[35],產(chǎn)生精細(xì)結(jié)構(gòu)的生物礦物。近年來,鑒定與磁小體緊密結(jié)合的相關(guān)蛋白質(zhì)成為發(fā)現(xiàn)磁鐵礦生物礦化因子的主要途徑之一,目前已經(jīng)鑒定與之相關(guān)的蛋白質(zhì)結(jié)構(gòu)和功能總結(jié)于表2,幾種生物礦化相關(guān)蛋白3D結(jié)構(gòu)見圖2,因本文中提到的幾種蛋白質(zhì)在蛋白質(zhì)結(jié)構(gòu)數(shù)據(jù)庫(protein data bank,PDB)中未能查找到完整的3D結(jié)構(gòu)圖,故采用蛋白質(zhì)結(jié)構(gòu)預(yù)測(SWISS-MODEL)服務(wù)器進行了同源建模,圖2(f)為PDB中現(xiàn)有的生物礦化相關(guān)蛋白MamA完整3D結(jié)構(gòu),ID:3AS5。通過對生物礦化相關(guān)蛋白Mms5、Mms6、MamC和MamD進行序列相似性對比分析,發(fā)現(xiàn)它們序列上存在一定的相似性,而且二級結(jié)構(gòu)和三級結(jié)構(gòu)也頗為類似,以α-螺旋和無規(guī)則卷曲為主,這可能與它們具有類似的功能相關(guān)。研究表明,這幾種蛋白質(zhì)中共同特征的酸性氨基酸殘基(或含有這些殘基的區(qū)域)負(fù)責(zé)與生物體的相互作用[36-37]。因此,為了進一步闡明生物礦物形態(tài)調(diào)控的特殊機制,對生物礦物相關(guān)蛋白中酸性氨基酸進行了詳細(xì)的研究。有科學(xué)家從Magnetospirillum magneticumAMB-1中合成的磁鐵礦納米粒子的表面分離出對晶體形態(tài)調(diào)控起著關(guān)鍵作用的Mms6蛋白,對其作用部位與產(chǎn)物進行重點研究[38]。實驗表明,Magnetospirillum magneticumAMB-1中表達(dá)缺失部分N端或C端區(qū)域基因的Mms6蛋白的突變體和轉(zhuǎn)化子,破壞了原本的蛋白質(zhì)在晶體成核之前或期間定位到磁小體膜上,缺少與晶格相匹配的負(fù)電荷殘基,Mms6蛋白不能與晶體表面直接結(jié)合,晶體中{110}和高指數(shù)面異常生長,從而導(dǎo)致合成磁性納米粒子形貌的變化。另外,Mms6 C端區(qū)域的Asp123、Glu124和Glu125單個氨基酸的取代結(jié)果表明,Asp123、Glu124和Glu125的取代損害了Mms6蛋白調(diào)節(jié)磁鐵礦晶體在磁細(xì)菌中形態(tài)的功能,且影響自組裝蛋白的鐵結(jié)合能力和穩(wěn)定性,晶體內(nèi){110}晶面異常生長,F(xiàn)e3O4磁性納米粒子形貌發(fā)生改變,表明這3種氨基酸是調(diào)節(jié)Fe3O4形貌的核心殘基。此外,有研究者在被用作鐵離子生物礦化模型系統(tǒng)的趨磁細(xì)菌MTB(magnetotactic bacteria)中發(fā)現(xiàn),與生物礦化作用有重要聯(lián)系的MamC蛋白在控制磁小體在地磁場的定向移動中起關(guān)鍵作用[39]。MTB細(xì)菌中,MamC蛋白通過生物礦化過程產(chǎn)生具有非等距形態(tài)、高化學(xué)純度、單個磁疇尺寸范圍內(nèi)分布且?guī)缀跬昝谰w結(jié)構(gòu)特征的單磁疇磁鐵礦(Fe3O4)或greigite(Fe3S4)納米晶體。納米晶體被形成磁小體細(xì)胞器的脂質(zhì)雙層包圍,因此具有這些特征的磁小體在地球磁場線上被動地排列和主動地運動。

表2 生物礦化相關(guān)蛋白結(jié)構(gòu)及功能特征
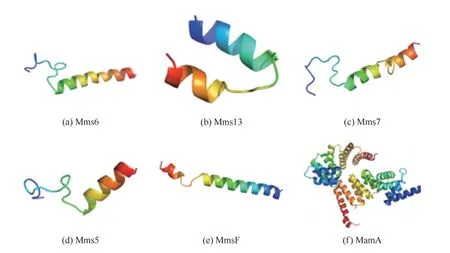
圖2 幾種生物礦化相關(guān)蛋白的3D結(jié)構(gòu)
相較于Mms6和MamC,研究者對其他生物礦化蛋白如Mms16、MamD、MamG和MmsF了解較少,但其作用不可忽視。其中,MamD、MamG在生成磁性納米粒子中發(fā)揮的作用類似于Mms6,但其在菌體中的含量遠(yuǎn)低于Mms6,獲取較困難。Mms16蛋白作為一種磁小體膜外周蛋白,具有細(xì)菌磁性顆粒(bacterial magnetic particles,BMP)膜特異性酶的特征,在形成磁小體時,啟動細(xì)胞質(zhì)膜的內(nèi)陷,形成細(xì)胞內(nèi)囊泡[35]。此外,有研究表明,在沒有其他主要生物礦化蛋白調(diào)節(jié)的情況下,正常表達(dá)MmsF可以恢復(fù)磁鐵礦的合成,而缺失表達(dá)MmsF基因的突變體,則存在明顯的生物礦化缺陷。目前,MmsF在生物礦化中的具體功能尚不明確。但其缺失的影響表明,MmsF對晶體的成核生長和形態(tài)都有貢獻,而且這兩個特征可能是相互關(guān)聯(lián)的[40,47]。
3 體外仿生礦化制備磁性納米粒子
雖然自然界中的生物礦化是通過生理、化學(xué)和生物過程的復(fù)雜相互作用來進行的,但從生物礦化的機理上看,生物礦化是通過有機支架才能夠?qū)ΦV物成核和生長的空間定位進行精確控制[30,41]。因此,通過仿生模板設(shè)計合成的磁性納米結(jié)構(gòu)可以與自然界中生物礦化的產(chǎn)物的結(jié)構(gòu)相比擬,二者有類似的結(jié)構(gòu)及其功能,為此需要逐步摸索分析反應(yīng)條件控制產(chǎn)物的表觀特征及性能。其中,基于對生物、物理和化學(xué)的深刻認(rèn)識,了解晶體成核和生長的基本原理對控制仿生礦化的過程起著關(guān)鍵的作用。目前,基于生物大分子的體外仿生礦化制備磁性納米粒子的研究尚處于起步階段。
3.1 人工模擬Mms6羧基端基序仿生礦化制備Fe3O4磁性納米粒子
在生物體內(nèi),F(xiàn)e3O4磁性納米粒子是在專用的脂質(zhì)體中產(chǎn)生的(磁小體),這一過程由脂質(zhì)體膜內(nèi)的一系列蛋白質(zhì)控制,Mms6是被認(rèn)為在生物礦化作用中發(fā)揮重要作用的一類蛋白質(zhì),且研究較為廣泛[38]。Mms6具有一種特異性的羧基端基序(carboxylic acid motifs),這種基序在生物礦化成核蛋白中很常見[36,42]。亞鐵離子和鐵離子通過鐵轉(zhuǎn)運體被吸收到磁小體的核心,在磁小體內(nèi)腔的酸性氨基酸上積累鐵離子,鐵轉(zhuǎn)運體也作為反轉(zhuǎn)運體泵出內(nèi)部質(zhì)子,質(zhì)子的流出導(dǎo)致酸堿度增加,促進磁鐵礦晶體沉淀,其形成的機理如圖3[43]所示。類似的酸性區(qū)域是磁小體中的Mms蛋白包括Mms7和MmsF,這種現(xiàn)象表明,在囊泡內(nèi)腔的羧酸功能化可以輔助磁鐵礦的礦化過程。有研究者利用PEG113-PHPMA400和PMPC28-PHPMA400模擬這種羧基端基序制備了具有兩親性的人工磁小體,電穿孔法使鐵離子穿過膜進入囊泡中心沉淀的氧化鐵具有潛在的磁熱療的優(yōu)勢特性,可以在10min內(nèi)增加6℃。有可能未來會作為核磁共振成像(MRI)診斷應(yīng)用的造影劑[39]。
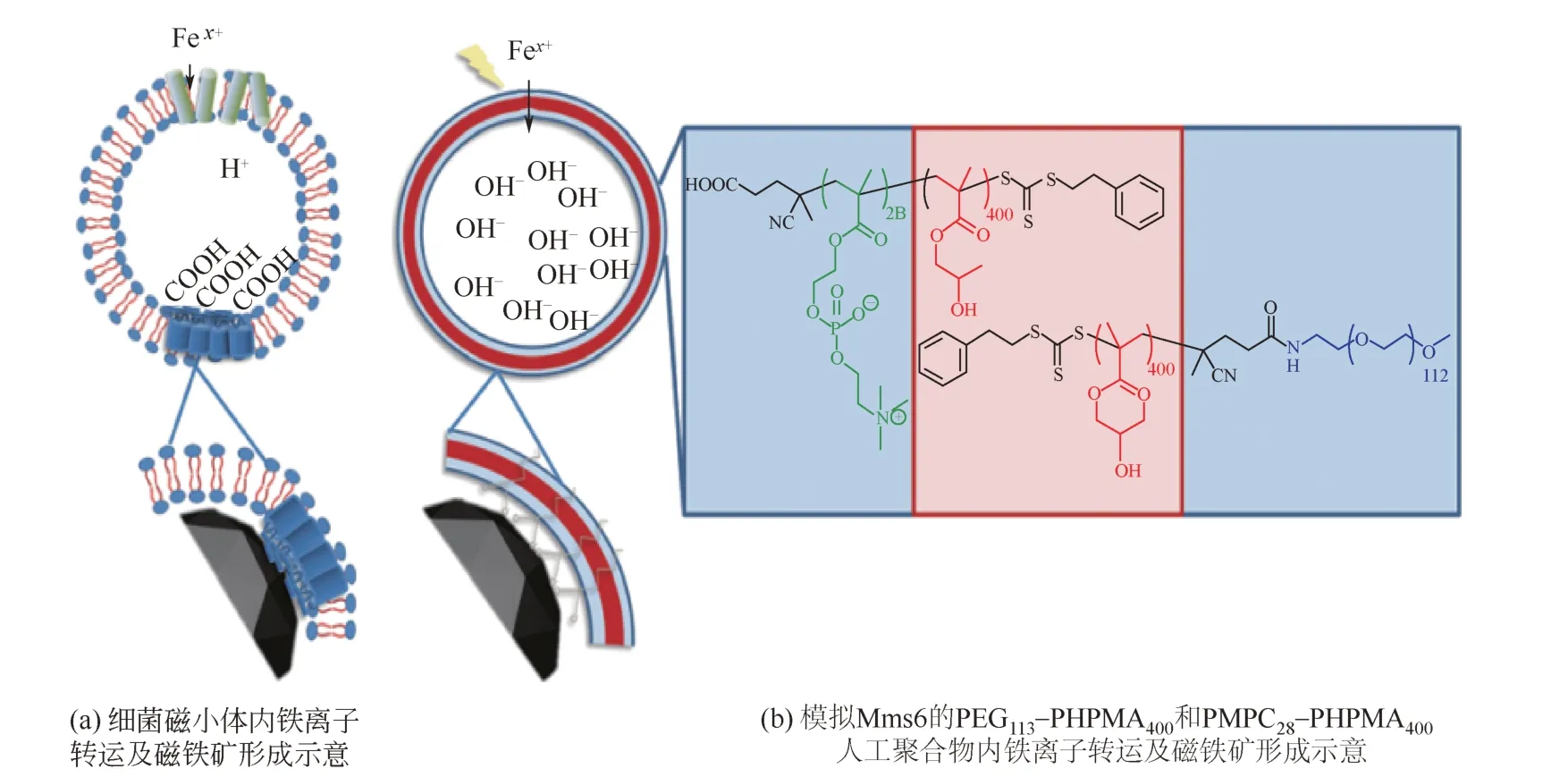
圖3 天然和合成模擬Mms6羧基端基序仿生礦化制備Fe3O4磁性納米粒子[43]
磁小體中的蛋白家族經(jīng)序列相似性對比表明,其N端具有一段共同的GL重復(fù)序列,該序列經(jīng)生物信息學(xué)分析為跨膜片段,AMB-1菌體中Mms6部分基因缺失突變體及轉(zhuǎn)化子的分析表明,Mms6 N端區(qū)域的缺失破壞了蛋白質(zhì)在磁小體表面的正確定位。此外,若Mms6 C端的酸性區(qū)域缺失,則導(dǎo)致產(chǎn)生的晶體不再為規(guī)則的球形[37-38,44-46]。對Mms6 C端區(qū)Asp123、Glu124或Glu125處的單氨基酸進行取代,結(jié)果顯示,這些氨基酸殘基對磁鐵礦晶體形態(tài)有直接的影響。因此,這些連續(xù)的酸性氨基酸殘基被認(rèn)為是體外調(diào)節(jié)磁鐵礦晶體形態(tài)的核心殘基。這對人工模擬Mms6蛋白氨基酸序列設(shè)計具有極其重要的指導(dǎo)意義。
3.2 人工合成多肽Eka仿生礦化制備Fe3O4磁性納米粒子
基于以上研究,人們廣泛尋求模擬磁性納米粒子生物礦化的合成策略,既要創(chuàng)建能夠揭示關(guān)鍵礦化機制的簡化模型系統(tǒng),又要實現(xiàn)可持續(xù)的低礦化[47-50]。有研究者將一種生物聚合物人工合成的多肽Eka用以協(xié)同調(diào)節(jié)合成納米粒子的尺寸大小和形貌[9,51]。通過調(diào)節(jié)多肽物Eka中3種氨基酸的所占比例,并與無生物聚合物的反應(yīng)條件對比,來觀察生成晶體的情況。研究證實了生成晶體的尺寸和形貌明顯依賴于EKa,首先用一系列共聚肽進行了實驗,其中谷氨酸(E)物質(zhì)的量分?jǐn)?shù)為10%~100%,同時保持賴氨酸(K)和丙氨酸(A)含量相等,E含量增多會產(chǎn)生尺寸更小的晶體(從E10的42nm±10nm減小到E100的11nm±4nm),對于E含量較高的多肽,這種效果更明顯。事實上,對于K或A含量變化的多肽,磁鐵礦晶體尺寸也隨E含量的增加而減小。這說明谷氨酸殘基對磁鐵礦的成核有抑制作用,帶負(fù)電荷的谷氨酸殘基顯然與礦物相互作用,從而改變磁鐵礦晶體的尺寸。其次,產(chǎn)物的分散性主要取決于實驗中所使用多肽的pH和賴氨酸的含量。在高賴氨酸(物質(zhì)的量分?jǐn)?shù)>25%)多肽存在時,生長的納米粒子由于磁性聚集而在pH=10時沉淀,在pH=7時分散良好。這表明,K殘基質(zhì)子化后靜電穩(wěn)定性的增加可以保護顆粒避免不受控制的團聚及隨后由于鐵磁性引力的沉淀。相反,低K含量的多肽存在時,生長的晶體在pH=7時缺乏足夠的穩(wěn)定性,但在高pH下,由于磁鐵礦的zeta電位增加而實現(xiàn)穩(wěn)定分散。因此,帶負(fù)電荷的氨基酸(谷氨酸)通過電荷相互作用穩(wěn)定鐵水合物/鐵(Ⅱ)前體,起到磁鐵礦成核抑制劑的作用,多肽分子中谷氨酸的含量可以系統(tǒng)地調(diào)節(jié)晶體的大小和形狀,從而調(diào)節(jié)晶體的磁性。通過添加此類組合的共聚肽優(yōu)化Fe3O4磁性納米粒子的合成似乎成為一種流行趨勢。值得注意的是,此類優(yōu)化過程需要足夠的時間進行多代優(yōu)化,且使用的組合策略對于Fe2+濃度和pH水平至關(guān)重要反應(yīng),這些反應(yīng)條件是影響共聚肽控制結(jié)晶的重要因素。
此外,雖然可從表觀上發(fā)現(xiàn)共聚肽對Fe3O4磁性納米粒子合成的影響,但其內(nèi)在機制尚不明了。因此,有研究者從存在這些多肽的條件入手,同時消除結(jié)構(gòu)效應(yīng)及電荷密度對產(chǎn)物合成的影響,設(shè)計出最佳共聚肽的組成含量,在鐵氧化物形成的條件下,多肽驅(qū)動Fe3O4的形成。研究結(jié)果表明,EKa多肽通過結(jié)合Fe2+改變了成核的條件,與礦物相互作用影響晶體的成核和生長,控制磁性納米離子的形狀和大小[52]。多肽與磁鐵礦表面的相互作用產(chǎn)生可分散的、膠體穩(wěn)定的單疇磁性納米顆粒,可用于分離技術(shù)和合成固體材料,對于將仿生礦化擴展到技術(shù)生產(chǎn)上具有重要的戰(zhàn)略意義[53-55]。
3.3 其他人工合成分子仿生礦化制備Fe3O4磁性納米粒子
近年來,除了人工模擬生物礦化蛋白Mms6及人工合成多肽EKa仿生礦化外,還有一些其他人工合成的分子也用于制備磁性納米粒子Fe3O4。如Rawlings等[40]人工合成了具有可溶性的、結(jié)構(gòu)穩(wěn)定的Mms13cc和MmsFcc螺旋蛋白,利用莖環(huán)結(jié)構(gòu)顯示生物礦化蛋白的活性,將其用于合成磁鐵礦的添加劑時成功地控制了MNP的形成,且調(diào)控合成的效果與天然的Mms13和MmsF生物礦化蛋白相當(dāng);Lenders等[56]人工合成了具有Mms6活性序列(DIESAQSDEEVE)的生物衍生肽M6A,水相中室溫沉淀,優(yōu)化后的方法可以有效控制晶體的成核和組裝,控制鐵氧化物前體相的形成及與Fe2+在pH≈8時的反應(yīng)轉(zhuǎn)化,制備出顆粒尺寸可達(dá)60nm的磁性納米顆粒Fe3O4。Kuhrts等[57]通過使用聚-L-精氨酸模擬細(xì)菌的蛋白質(zhì),僅控制pH即可選擇性地產(chǎn)生超順磁性和穩(wěn)定的單疇磁性納米粒子,見圖1(e),這顯示在聚-L-精氨酸存在的條件下,產(chǎn)物對pH具有極高依賴性,只要增加pH,F(xiàn)e3O4的尺寸就會增加,誘導(dǎo)晶體從單晶到中晶的轉(zhuǎn)變,見圖4。這些充分顯示利用人工合成多肽進行仿生礦化具有廣闊的應(yīng)用前景。需要注意的是,在實驗室研究的同時,研究者們必須注重生物合成分子的活性及結(jié)構(gòu)特征在仿生礦化中的實際影響。
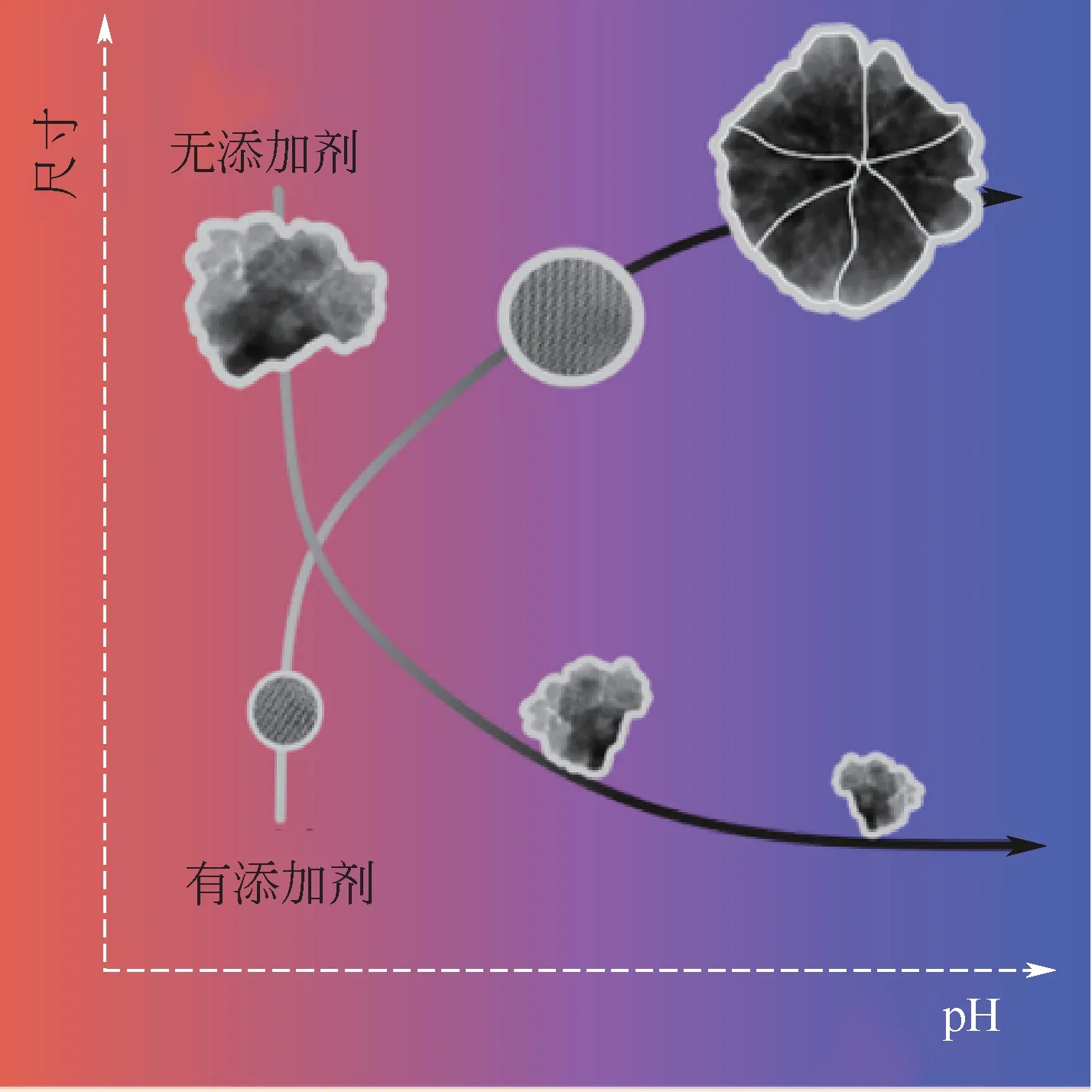
圖4 酸堿度和添加劑對制備Fe3O4磁性納米粒子的影響[57]
除多肽類生物分子能介導(dǎo)磁性納米粒子的產(chǎn)生外,也有使用現(xiàn)有的聚合物仿生合成磁性納米粒子。如由不同的陰離子、陽離子和疏水單體構(gòu)成的丙烯酸酯聚合物等[58]。在實際生產(chǎn)中,綜合考慮其優(yōu)缺點和應(yīng)用目的進行選擇,如使用現(xiàn)有的聚合物減少了在原材料購買上的選擇性難題,但對構(gòu)成聚合物的原材料具體來源并不足夠了解;使用聚合物化學(xué)方法制備磁性納米粒子周期較短,但容易對周圍環(huán)境及操作人員造成污染性傷害;使用聚合物合成磁性納米粒子操作過程簡便且產(chǎn)品純度高,但反應(yīng)過程中影響因素很多且苛刻,很難實現(xiàn)工業(yè)化大批量生產(chǎn)[59]。而使用多肽類生物分子介導(dǎo)生成磁性納米粒子可以對多肽進行多元化的設(shè)計,以實現(xiàn)設(shè)計的預(yù)期目的,但此過程需要大量實驗研究作為依據(jù);多肽類分子能夠更好地模擬磁性細(xì)菌本身蛋白的結(jié)構(gòu),以保證生物分子的活性,在效能方面發(fā)揮更大的優(yōu)勢。但生物分子的儲存時間較短;以多肽類分子介導(dǎo)生成磁性納米粒子操作過程雖然相對安全,對環(huán)境污染較小,但純化制備大量蛋白質(zhì)(多肽)等費用昂貴[51]。
3.4 人工設(shè)計類彈性蛋白多肽序列制備Fe3O4磁性納米粒子
基于傳統(tǒng)色譜柱純化蛋白質(zhì)或多肽遇到的一系列難題,如昂貴和耗時的過程,且不容易規(guī)模化。研究者開始另辟蹊徑尋找借助非色譜的方法純化蛋白質(zhì)或多肽,類彈性蛋白多肽(ELPs)作為一類溫度響應(yīng)型多肽在這一背景下脫穎而出[60]。本文作者課題組也曾設(shè)計了一種新型ELPs,并以ELPs作為純化標(biāo)簽,對目標(biāo)蛋白酶進行分離純化,純化后酶回收率約為66.3%,純化倍數(shù)約為12.5,效果良好[61]。在此同時,本文作者課題組還發(fā)現(xiàn)該ELPs具有介導(dǎo)四甲氧基硅烷(TMOS)仿生硅化的能力,與眾不同的是,該ELPs能在很寬pH范圍內(nèi)(2.2≤pH≤9.6)介導(dǎo)仿生硅化;在更低濃度下,所需時間更短(約100s,僅為上述多肽的1/6);其仿生硅化能力不依賴于磷酸根離子。元素分析結(jié)果證實ELPs被固定于所形成的二氧化硅粒子中。因此,ELPs還可以作為一種非常有效的自固定化載體,以提高固定化酶的pH穩(wěn)定性、熱穩(wěn)定性及儲藏穩(wěn)定性[62-65]。此外,本文作者課題組最新的研究結(jié)果顯示,利用ELPs-Spycather的仿生硅化能力,可以實現(xiàn)在Fe3O4磁芯表面包覆二氧化硅,制備表面修飾的包硅磁性納米顆粒,可以更有效地保留磁性,利于酶的分離和提高蛋白質(zhì)的負(fù)載量。該方法制備條件溫和,所需時間短(11min),遠(yuǎn)低于其他文獻中的用時(4.5~120h)。此外,ELPs-Spycather可長時間被固定于載體上,56h的蛋白泄漏率小于2%。有望成為一種全新的酶自固定化與分離純化集成的技術(shù)手段。
除此之外,本文作者課題組也對制備粒徑分布較窄、晶體尺寸大小形貌均一、形貌具有可控性的Fe3O4納米粒子產(chǎn)生了濃厚的興趣。ELPs的設(shè)計源于自然界中彈性蛋白,除了是一種環(huán)境響應(yīng)型多肽外,它的設(shè)計序列也具有重大的意義[66]。其中包含一段重復(fù)序列(VPGXG)n,X是除脯氨酸外的其他任意氨基酸,這種序列的可設(shè)計性及可編輯性有望賦予ELPs全新的仿生礦化制備磁性納米粒子的能力,在了解多肽仿生制備磁性納米粒子機制的基礎(chǔ)上,可以設(shè)計出具有此功能的ELPs分子,使其在制備Fe3O4中發(fā)揮重要作用,本文作者課題組前期利用ELPs仿生制備的磁性納米粒子經(jīng)X射線衍射(XRD)確認(rèn)為Fe3O4磁性粒子,其電鏡照片如圖1(f)所示,經(jīng)計算其平均粒徑約為32nm。有望開辟人工設(shè)計生物大分子介導(dǎo)制備磁性納米粒子的新領(lǐng)域,相關(guān)的研究工作正在不斷有序推進中。
由于磁性納米粒子常常具有獨特的物理(結(jié)構(gòu)、電子、磁性和光學(xué))和化學(xué)(催化)性質(zhì)。在全球納米材料市場,其價值數(shù)十億美元,對從藥品到電池生產(chǎn)[67]的應(yīng)用來說是巨大而深遠(yuǎn)的。但由于磁性納米粒子的尺寸往往不受控制,而且合成的條件對環(huán)境和人工操作技術(shù)要求較為嚴(yán)格,因此其應(yīng)用受到很大的阻礙。經(jīng)過研究者的不懈努力,發(fā)現(xiàn)利用生物方法在化學(xué)共沉淀的基礎(chǔ)上,有效地利用生物大分子或者多肽介導(dǎo)制備出的磁性納米粒子大小分布范圍較為集中,相對傳統(tǒng)方法分散性更低,形貌具有可確定性,而且通過調(diào)節(jié)反應(yīng)的酸堿性可控制其粒徑大小[38]。人工合成模擬生物礦化的相關(guān)結(jié)合蛋白也可以高效產(chǎn)生預(yù)期的磁性納米顆粒,與其他介導(dǎo)仿生礦化的有機分子相比,多肽類生物分子存在諸多優(yōu)勢[68-69]。例如,生物相容性更好,制備磁性納米材料的條件更加溫和;多肽類生物分子易通過基因工程技術(shù)或化學(xué)法制備;多肽豐富的結(jié)構(gòu)和組裝驅(qū)動力可精確調(diào)控納米材料的形貌和尺寸。因此,人工合成的模擬生物礦化的蛋白質(zhì)或多肽類生物大分子在藥品研發(fā)、癌癥治療和核磁共振成像等方面具有更為廣闊的應(yīng)用前景[39,42]。目前,生物合成的磁性納米粒子在生物醫(yī)學(xué)領(lǐng)域中被應(yīng)用于對各種疾病的檢測、治療和預(yù)防。如Strehl等[70]利用抗體、酶和藥物等生物相容性材料封裝磁性納米顆粒,通過外部磁場對其進行導(dǎo)向,從而到達(dá)特定的靶向組織或器官。Wang等[71]利用非功能化的磁性納米顆粒標(biāo)記淋巴細(xì)胞或白細(xì)胞等。除此之外,簡便有效的生態(tài)友好型磁性納米顆粒當(dāng)前的主要進展還在于對有毒農(nóng)藥、染料、金屬和廢水的檢測、降解和處理,以維護穩(wěn)定的生態(tài)系統(tǒng)。如,Das等[72]將尺寸為10~15nm左右的漆酶固定化于磁性納米顆粒并成功用于降解農(nóng)藥毒死蜱。Guo等[73]將磁性納米顆粒用于去除2,4-二氯苯酚。
人工合成多肽促進合成磁性納米粒子仍然是當(dāng)前及今后研究的重點和熱點。人工合成多肽或蛋白質(zhì)在設(shè)計上相對簡單,也可以通過生物發(fā)酵法制備,但有不少科學(xué)問題亟需解決:①人工合成的蛋白質(zhì)在其結(jié)構(gòu)上無法與生物體內(nèi)的天然蛋白質(zhì)相比擬,無法在其應(yīng)用方面發(fā)揮與生物礦化蛋白在細(xì)菌體內(nèi)相當(dāng)?shù)淖饔茫踔量赡苡捎谌斯ず铣傻牡鞍踪|(zhì)在其結(jié)構(gòu)或輔因子上的無法重復(fù)性造成功能的突變,這些是當(dāng)前仿生礦化所遇到的最嚴(yán)重挑戰(zhàn);②生物分子(多肽)容易受到環(huán)境中強酸、強堿以及保存周期的影響,導(dǎo)致其結(jié)構(gòu)和性能發(fā)生變化,如果不加修飾直接將其投放于實際生產(chǎn)中,則不能充分體現(xiàn)其價值。因此,需要設(shè)計出高度模擬生物礦化蛋白中發(fā)揮核心作用的結(jié)構(gòu)片段,并充分考慮生物體微環(huán)境中輔因子的參與,這成為目前該領(lǐng)域急需解決的關(guān)鍵問題;③多肽類分子調(diào)控磁性粒子合成過程及其對磁性粒子形貌、大小的影響規(guī)律不明,仿生礦化過程中多肽分子和磁性粒子間相互作用的微觀過程亟待闡明;④現(xiàn)有合成磁性納米顆粒的方法中,反應(yīng)物被部分混合,未反應(yīng)的組分影響最終產(chǎn)物,使得獲得所需產(chǎn)物的再現(xiàn)性極低,因此開發(fā)反應(yīng)后純化最終產(chǎn)物的方法勢在必行[74-75]。
4 結(jié)語
生物合成綠色新型多功能化的磁性納米顆粒可通過發(fā)掘細(xì)菌、真菌、藻類、酵母和病毒等微生物以及生物分子有機酸、醛類物質(zhì)的潛力來實現(xiàn)。縱觀磁性納米顆粒在化學(xué)、生物、醫(yī)學(xué)和環(huán)境資源等領(lǐng)域中應(yīng)用,不難發(fā)現(xiàn)納米顆粒的尺寸、形貌、磁學(xué)性質(zhì)等物理特征在其中至關(guān)重要。目前,已有研究表明,蛋白質(zhì)等生物大分子可以控制仿生礦化制備磁性納米顆粒的尺寸及形貌,但由于生物分子通常表現(xiàn)出復(fù)雜的結(jié)構(gòu),因此研究生物大分子在仿生礦化中的具體影響機制變得非常困難。因此,今后的研究重點應(yīng)包括(但不限于)以下幾點:①進一步闡明相關(guān)礦化蛋白在磁性粒子仿生礦化過程中所起的作用,在此基礎(chǔ)上,將人工合成的生物大分子與生物體內(nèi)礦化蛋白進行同源性比對,以評估生物分子在仿生礦化過程中的決定性因素;②依據(jù)細(xì)胞內(nèi)生物礦化相關(guān)蛋白結(jié)構(gòu)和功能,設(shè)計人工合成蛋白應(yīng)更多考慮蛋白質(zhì)有活性的結(jié)構(gòu),如何使人工合成蛋白保持活性是精細(xì)合成綠色無機納米顆粒的一項重大挑戰(zhàn);③生物合成磁性納米顆粒更多地用于生物醫(yī)學(xué)領(lǐng)域,如藥物靶向運輸及釋放。因此需充分保證其良好的生物相容性,以及在合成過程中采用溫和條件制備納米顆粒,以利于藥物、酶和蛋白質(zhì)等充分保留其活性。隨著生物材料在醫(yī)療健康行業(yè)和生活中所占比重逐漸增加,生物方法制備磁性納米材料在藥物研發(fā)和醫(yī)學(xué)成像方面將承擔(dān)越來越重要的角色。并且,其應(yīng)用的范圍也將進一步拓展。

