免疫檢查點抑制劑在腦膠質(zhì)瘤中的研究進展及治療策略
林凱龍 陳劉生 張榮生 王冠梁(中國人民解放軍陸軍第75集團軍醫(yī)院,大理671000)
膠質(zhì)瘤是中樞神經(jīng)系統(tǒng)最常見的原發(fā)性腫瘤。世界衛(wèi)生組織將其按病理學歸為4級,其中第4級又稱為膠質(zhì)母細胞瘤(glioblastoma,GBM),具有極強的侵襲和血管生成能力,即使應(yīng)用傳統(tǒng)腫瘤切除手術(shù)及標準放化療治療,其5年生存率和中位生存期僅分別為9.8%和14個月左右[1-2]。近年來,抗血管內(nèi)皮生長因子(vascular endothelial growth factor,VEGF)制劑貝伐單抗(Bevacizumab)和低密度交變電場被用于復(fù)發(fā)GBM患者的臨床研究,但其在延長生存期上仍未獲得實質(zhì)性進展,因此急需新的臨床治療方式改善膠質(zhì)瘤患者的治療現(xiàn)狀和預(yù)后[3-4]。腫瘤免疫治療已經(jīng)發(fā)展了100多年,是一項十分成熟的腫瘤治療技術(shù),旨在通過提高機體內(nèi)腫瘤特異性免疫反應(yīng)抑制腫瘤的發(fā)生發(fā)展。其中針對免疫檢查點(immune checkpoints,IC)的治療越來越受到專家的重視,多個針對IC的靶向藥物已經(jīng)獲得藥物監(jiān)管機構(gòu)的通過并在部分類型(黑素瘤、非小細胞肺癌、腎癌、膀胱癌等)的腫瘤患者中取得了可觀的療效[5-8]。然而,基于中樞神經(jīng)系統(tǒng)獨有的解剖結(jié)構(gòu)和免疫環(huán)境,針對膠質(zhì)瘤患者的IC靶向治療仍處于起步階段,但是仍表現(xiàn)出了可觀的治療潛力。本文就膠質(zhì)瘤細胞的免疫逃逸機制、IC抑制劑在膠質(zhì)瘤中的研究進展及下一步的治療策略等進行綜述,旨在為其臨床治療提供有價值的借鑒。
1 膠質(zhì)瘤的免疫學特點
1.1 解剖及免疫學基礎(chǔ) 傳統(tǒng)觀點認為中樞神經(jīng)系統(tǒng)具有免疫豁免性,即中樞神經(jīng)系統(tǒng)存在血腦屏障并且缺乏抗原提呈細胞(antigen presenting cells,APCs)——樹突狀細胞、巨噬細胞、T淋巴細胞、淋巴管、淋巴結(jié)及其他重要的免疫器官,導(dǎo)致許多生物活性分子及免疫細胞難以進入其中,從而缺乏正常的免疫功能[9]。但隨著研究的進展,該觀點被逐漸打破:①在荷瘤條件下,隨著腫瘤的進展和炎癥環(huán)境的轉(zhuǎn)變,組成血腦屏障的微血管對生物大分子和免疫細胞的通透性增加[10];②有研究者發(fā)現(xiàn),硬腦膜竇內(nèi)存在具有完整功能的淋巴管[11];③中樞神經(jīng)系統(tǒng)本身存在的小膠質(zhì)細胞、星形膠質(zhì)細胞也能充當APCs,產(chǎn)生腫瘤免疫反應(yīng)[12]。以上3點原因共同支持中樞神經(jīng)系統(tǒng)的腫瘤抗原能夠經(jīng)腦脊液-血管周圍間隙-硬腦膜竇淋巴管-頸深淋巴結(jié)-外周淋巴組織通路進行抗原提呈,之后活化的腫瘤特異性淋巴細胞再經(jīng)脈絡(luò)叢進入腦脊液,被局部抗原提呈細胞進一步刺激活化,最后通過不完整的血腦屏障進入腦實質(zhì)發(fā)揮腫瘤殺傷效應(yīng)[11,13-14]。近期,研究人員發(fā)明的天然納米分子和抗腫瘤靶向藥物形成的免疫偶聯(lián)物,其可增強藥物對血腦屏障的通透性,從而提高對顱內(nèi)腫瘤的治療效果[15]。綜上所述,中樞神經(jīng)系統(tǒng)雖然存在特殊的解剖及免疫學機制,但其仍具有一定的與全身免疫系統(tǒng)相互作用、發(fā)揮免疫應(yīng)答的能力,為膠質(zhì)瘤的免疫治療奠定基礎(chǔ)。
1.2 免疫逃逸機制 膠質(zhì)瘤的腫瘤微環(huán)境是具有免疫抑制性的,多種因素參與了腫瘤細胞的免疫逃逸,共同構(gòu)成了一個復(fù)雜的免疫調(diào)控機制。
1.2.1 內(nèi)源性因素 免疫逃逸的內(nèi)源性因素可簡單概括為募集到腫瘤組織的各種炎癥細胞及生物活性分子經(jīng)過環(huán)境的適當“改造”,轉(zhuǎn)變?yōu)橹δ[瘤細胞逃避機體免疫系統(tǒng)攻擊的“幫兇”。具體機制包括:①腫瘤細胞及其他抗原提呈細胞組織相容性復(fù)合物Ⅰ類(MHCⅠ)分子的表達下調(diào),使自身免疫細胞無法識別;②可溶性免疫抑制性生物活性分子如TGF-β、IL-10、前列腺素E2、VEGF等過量募集,在局部形成免疫抑制的細胞因子網(wǎng)絡(luò);③免疫抑制性炎癥細胞如調(diào)節(jié)性T淋巴細胞(regulatory T-cells,Tregs)、M2型腫瘤相關(guān)性巨噬細胞(tumor-associated macrophages,TAMs)、骨髓來源的抑制性細胞(myeloid-derived suppressor cells,MDSCs)等大量浸潤,進一步參與免疫抑制網(wǎng)絡(luò)的調(diào)控;④細胞間膜蛋白的相互作用導(dǎo)致免疫抑制性信號通路的激活,這里包括經(jīng)典的細胞凋亡相關(guān)的Fas/FasL通路及本文重點考察的IC通路(CTLA-4/CD80/86、PD-1/PDL1、TIM-3/Galectin等)[16]。值得一提的是,以上各因素并不是獨立發(fā)揮作用,而是相互影響協(xié)同作用。例如,Tregs能通過分泌TGF-β抑制樹突狀細胞的成熟和效應(yīng)T細胞的產(chǎn)生,同時又通過高表達的CTLA-4與效應(yīng)T細胞表面的CD80/86結(jié)合,進一步抑制后者的功能[17-18]。
1.2.2 外源性因素 由于膠質(zhì)瘤患者大部分長期接受細胞毒性化療藥及其他影響機體免疫功能的藥物,如糖皮質(zhì)激素的治療,特別在年齡較大的患者人群中會因此存在外源性的獲得性免疫反應(yīng)缺失,即全身免疫系統(tǒng)處于被動抑制狀態(tài)[19]。但近期也有研究發(fā)現(xiàn),在小鼠模型中,中樞神經(jīng)系統(tǒng)的特殊環(huán)境可減輕局部腫瘤免疫治療效果受外源性糖皮質(zhì)激素的負向影響,該結(jié)論有待于人體試驗的進一步驗證[20]。
因此,根據(jù)膠質(zhì)瘤上述免疫學特點,可以針對性地設(shè)計靶點進行干預(yù)。即盡可能地逆轉(zhuǎn)有利于腫瘤發(fā)生發(fā)展的免疫抑制狀態(tài),激發(fā)及維持有利于殺傷腫瘤的免疫反應(yīng),這也是腫瘤免疫治療的基本出發(fā)點,且有望成為治療膠質(zhì)瘤的新方法。
2 主要IC抑制劑及其研究進展
人體免疫系統(tǒng)始終處于動態(tài)平衡狀態(tài),當病原體入侵時,免疫細胞會被APCs提呈的抗原信號及共刺激信號激活,但同時也會逐漸上調(diào)表達一系列共抑制受體,使其在適當時間點傳導(dǎo)共抑制信號,終止免疫反應(yīng),防止過度免疫反應(yīng)損傷自身正常組織,而這一系列主要以膜表達為主的共抑制受體及其下游信號通路即為IC[21]。腫瘤細胞正是利用這一機制,通過持續(xù)過度放大IC信號,打破正常的平衡狀態(tài),使之成為腫瘤免疫逃逸的重要手段之一,同時也為IC抑制劑治療提供有利靶點。由此可見,IC抑制劑并非直接針對腫瘤細胞,而是通過調(diào)節(jié)腫瘤微環(huán)境中免疫細胞的功能達到抗腫瘤的目的,其也日益成為腫瘤免疫治療的主要手段之一。
2.1 CTLA-4 細胞毒性T淋巴細胞相關(guān)抗原-4(cytotoxic T-lymphocyte antigen 4,CTLA-4)是第一個被發(fā)現(xiàn)的共抑制分子,主要表達在活化的T細胞和Tregs上。在腫瘤環(huán)境中,其通過與配體CD80/86結(jié)合,一方面直接傳導(dǎo)共抑制信號阻礙效應(yīng)T細胞進一步活化,另一方面又能增強Tregs的免疫抑制功能[22]。基礎(chǔ)研究表明,在小鼠膠質(zhì)瘤模型中,CTLA-4抑制劑能增強CD4+T細胞的增殖能力,同時下調(diào)Tregs和CD4+T細胞比值,而在GBM患者中,CD4+和CD8+T細胞上CTLA-4的表達量與患者的預(yù)后呈負相關(guān),下調(diào)CTLA-4表達預(yù)示著更好的預(yù)后[23-24]。進入臨床試驗的CTLA-4抑制劑包括Ipilimumab和Tremelimumab,其中Ipilimumab是第一個獲得美國藥監(jiān)局通過的IC抑制劑,用于治療黑素瘤[5]。目前關(guān)于CTLA-4抑制劑的臨床試驗已注冊的有16項,但都尚未完成,已經(jīng)發(fā)布初期結(jié)果的臨床研究只有1項(NCT02017717),是一項針對GBM患者的Ⅲ期臨床試驗,其中有一項涵蓋20位患者的子試驗考察了Ipilimumab和另一種IC抑制劑Nivolumab聯(lián)合治療對比貝伐單抗治療。發(fā)布的結(jié)果顯示,在聯(lián)合治療組,3位患者獲得部分有效,8位患者疾病12周以上未再進展,但由于后續(xù)治療失敗,該試驗被暫時中止[25-26]。由此可見,CTLA-4抑制劑治療對部分T膠質(zhì)瘤患者可能獲益,但還需要更多臨床試驗數(shù)據(jù)支持。
2.2 PD-1/PD-L1 程序性細胞死亡蛋白1(programmed cell death protein 1,PD-1)主要表達于效應(yīng)T細胞,與CTLA-4類似傳導(dǎo)共抑制信號阻止T細胞過度活化。但在腫瘤環(huán)境中,PD-1也是衰竭T細胞的標志分子,該種T細胞表現(xiàn)為表型變化和功能喪失,是腫瘤實現(xiàn)免疫逃逸的重要環(huán)節(jié)[27]。基礎(chǔ)研究發(fā)現(xiàn):一方面,PD-1在膠質(zhì)瘤病人的外周血和腫瘤浸潤T細胞上的表達較正常對照顯著上調(diào),且直接與腫瘤浸潤CD4+T細胞分泌抗腫瘤細胞因子IFN-γ的缺失相關(guān)[28-29];另一方面,Tregs在膠質(zhì)瘤也高表達PD-1,發(fā)揮促進自身成熟和免疫抑制功能維持的作用[30]。除PD-1以外,其配體PD-L1在膠質(zhì)瘤的發(fā)生發(fā)展中也扮演重要角色。PD-L1主要表達于APCs和腫瘤細胞。值得注意的是,PD-1/PD-L1的作用是雙向的,腫瘤細胞上的PD-L1同樣會傳導(dǎo)信號影響腫瘤細胞的生物學特性,如GATO-CA?AS等[31]發(fā)現(xiàn),PD-L1的胞內(nèi)信號有助于腫瘤細胞抵御IFN的細胞毒性作用,加速腫瘤進展。在膠質(zhì)瘤中,PD-L1的表達直接與腫瘤分級呈正相關(guān),且與預(yù)后標志物異檸檬酸脫氫酶(isocitrate dehydrogenase,IDH)的突變狀態(tài)相關(guān),IDH野生型腫瘤PD-L1的表達較IDH突變型顯著升高[32-33]。
目前針對PD-1的抑制劑主要有Nivolumab、Pembrolizumab及Pidilizumab等,其中Nivolumab和Pembrolizumab已被美國藥監(jiān)局通過用于治療黑素瘤、非小細胞肺癌、腎癌等多種腫瘤[6-7,34]。在膠質(zhì)瘤的臨床試驗中,目前已注冊的有61項,已經(jīng)完成的有3項(表1)。其中只有1項(NCT02337491)已在臨床試驗網(wǎng)站公布結(jié)果,但尚未發(fā)表論文,該試驗是涵蓋80位患者的Ⅱ期臨床試驗,考察Pembrolizumab和Bevacizumab聯(lián)合治療GBM對比Pembrolizumab單獨治療的效果和毒副作用。最新公布的結(jié)果顯示,聯(lián)合治療組和單藥組的mPFS和ORR分別為4.1(95%CI:2.8~5.5)vs 1.4(95%CI:1.4~2.7)以及20%(95%CI:0.11~0.32)vs 0%(95%CI:0.0~0.095),總毒副反應(yīng)發(fā)生率分別為44.00%和33.33%,提示Pembrolizumab聯(lián)合Bevacizumab對GBM可能有更好的治療效果,但毒副作用也隨之升高。值得注意的是,另一項試驗(NCT02550249)提出了針對IC抑制劑的新輔助治療(neoadjuvant)方式,即在腫瘤切除手術(shù)前應(yīng)用Nivolumab,術(shù)后再繼續(xù)行Nivolumab常規(guī)輔助治療。該試驗在新發(fā)布的論文中提及,雖然該聯(lián)合療法對提高患者mPFS[4.1(95%CI:2.8~5.5)]和mOS[7.3(95%CI:5.4~7.9)]程度相較既往治療不明顯,但其能夠顯著增強腫瘤局部的免疫應(yīng)答[35]。然而,同期發(fā)布的另一項小型臨床試驗(未注冊)發(fā)現(xiàn),針對Pembrolizumab的新輔助療法結(jié)合術(shù)后常規(guī)輔助治療相較單純術(shù)后輔助治療能顯著提高膠質(zhì)瘤患者的OS,增強抗腫瘤免疫反應(yīng),且有利于減少術(shù)前腫瘤負荷以及建立穩(wěn)定的免疫記憶,增加徹底清除腫瘤細胞的可能性[36]。二者預(yù)后結(jié)果的差異可能由臨床樣本的局限性和異質(zhì)性引起,該療法對提高IC抑制劑抗腫瘤免疫反應(yīng)療效是值得肯定的。針對PD-L1的抑制劑主要包括Avelumab、Durvalumab和Atezolizumab,其注冊的臨床試驗共有15項,已完成的有1項(表1),但尚未公布結(jié)果。
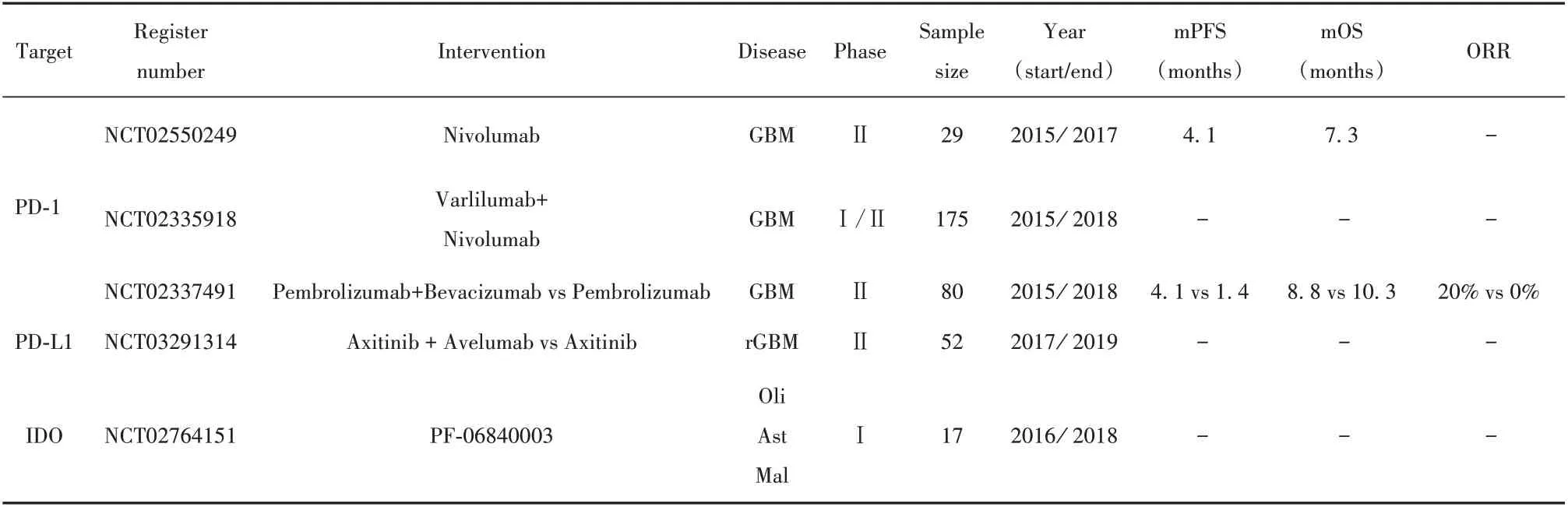
表1 已完成的免疫檢查點抑制劑在膠質(zhì)瘤中的臨床試驗Tab.1 Completed clinical trials evaluating immune checkpoint inhibitors in gliomas
2.3 其他IC分子 其他IC相關(guān)分子包括吲哚胺雙加氧酶(indoleamine 2,3-dioxygenase,IDO)、T細胞免疫球蛋白黏蛋白3(T cell immunoglobulin mucin-3,TIM-3)、淋巴細胞活化基因3(lymphocyte activation gene 3,LAG-3)等,同樣參與膠質(zhì)瘤的免疫逃逸。IDO是一種色氨酸代謝酶,負責色氨酸降解,后者是T細胞功能維持的重要營養(yǎng)物質(zhì),而IDO本身又能促進Tregs的浸潤[37-38]。因此在膠質(zhì)瘤中,IDO通過抑制效應(yīng)T細胞功能和募集Tregs促進腫瘤發(fā)生發(fā)展,且其表達高低與腫瘤惡性程度、患者不良預(yù)后均呈正相關(guān)[38-39]。TIM-3、LAG-3和PD-1類似,也是衰竭T細胞的重要的分子標志[27]。基礎(chǔ)研究發(fā)現(xiàn),腫瘤浸潤的T細胞常常共表達PD-1、TIM-3和LAG-3,并且共同抑制T細胞功能[40-41],而在GBM患者中,TIM-3的高度表達和更高的腫瘤分級以及IDH未突變狀態(tài)均相關(guān)[42]。目前IDO的抑制劑Indoximod和PF-06840003已進入臨床試驗,共3項,其中1項已完成(表1),但未公布結(jié)果。針對TIM-3和LAG-3研制的抑制劑分別為MBG453和BMS-986016,目前分別有1項和2項進入臨床試驗但尚未完成。
3 未來研究方向及治療策略
腫瘤細胞能調(diào)動自身和環(huán)境的多種機制促進自身的增殖和轉(zhuǎn)移。如前文所述,腫瘤免疫逃逸是一個涉及多因素的復(fù)雜龐大的調(diào)控網(wǎng)絡(luò),各因素協(xié)同發(fā)揮作用。因此,針對單獨靶點治療很可能達不到預(yù)想的療效,例如KURZ等[43]發(fā)現(xiàn)在復(fù)發(fā)性高分級膠質(zhì)瘤患者中,單獨應(yīng)用PD-1抑制劑Nivolumab或Pembrolizumab治療并不能顯著延長患者的無進展生存期。因此,應(yīng)用多靶點聯(lián)合治療是一個亟待探討的方式,這也有望被將來的腫瘤免疫治療普遍采納。
3.1 不同IC抑制劑的聯(lián)合治療 雖然IC分子都具有調(diào)節(jié)免疫的功能,但其介導(dǎo)的信號通路不盡相同,且往往相互影響、協(xié)同作用[44]。如前文提及的PD-1、TIM-3、LAG-3等,被發(fā)現(xiàn)在結(jié)腸癌、乳腺癌、黑素瘤等多種腫瘤中都存在共表達,且較單獨分子的表達對腫瘤浸潤T細胞增殖和炎癥細胞因子分泌功能抑制更明顯,即T細胞表現(xiàn)為一種更嚴重的衰竭狀態(tài),且在小鼠模型中聯(lián)合應(yīng)用不同IC分子的阻斷抗體較單獨治療對T細胞功能的恢復(fù)更加明顯[40-41,45-46]。此外,PD-1和IDO通過誘導(dǎo)Tregs的FoxP3表達調(diào)控其CTLA-4表達,而CTLA-4又能和CD80/86結(jié)合上調(diào)IDO表達[47-49]。在膠質(zhì)瘤的臨床試驗中也有相當一部分采用多種IC阻斷劑聯(lián)合治療,旨在從更大程度上逆轉(zhuǎn)T細胞的衰竭或失能狀態(tài),但其療效有待更多結(jié)果公布。
3.2 IC抑制劑和傳統(tǒng)治療結(jié)合 腫瘤的傳統(tǒng)治療包括手術(shù)切除、化學藥物治療及放射治療等。往往腫瘤患者接受傳統(tǒng)治療后仍出現(xiàn)腫瘤復(fù)發(fā)和轉(zhuǎn)移是因為其不能夠徹底清除機體所有的腫瘤細胞,相關(guān)機制包括腫瘤細胞產(chǎn)生對放化療的耐受能力及其大量向周圍基質(zhì)或血管浸潤等。因此,如何清除這些殘留的腫瘤細胞對患者預(yù)后至關(guān)重要。既往研究表明,PD-1抑制劑聯(lián)合放射治療有助于患者預(yù)后的進一步改善,例如在腦干膠質(zhì)瘤患者身上聯(lián)合應(yīng)用Nivolumab和重復(fù)照射相較單獨放療能在一定程度上延長患者總生存期,研究人員認為這可能與放療使腫瘤細胞釋放大量抗原刺激機體更多免疫細胞浸潤有關(guān)[50-51]。此外,在小鼠膠質(zhì)瘤模型上聯(lián)合應(yīng)用化療藥替莫唑胺和PD-1或IDO抑制劑相較二者單獨治療能更顯著延長小鼠生存期,抑制腫瘤生長[52-53]。目前傳統(tǒng)治療仍是所有膠質(zhì)瘤患者的一線治療手段,而IC抑制劑的加入有望起到協(xié)同治療作用,但其是否會同時增加前者的毒副反應(yīng)及二者治療時間點的選擇還需要進一步研究。
3.3 IC抑制劑和抗血管生成治療結(jié)合 血管正常化理論在抗腫瘤治療中扮演重要的角色,腫瘤中異常的血管生成能夠通過制造乏氧環(huán)境、分泌大量促血管生成因子,如VEGF等引起一系列級聯(lián)反應(yīng),一方面抑制抗腫瘤淋巴細胞功能,另一方面增加促腫瘤炎癥細胞富集,這也成為影響IC抑制劑療效的主要原因之一[54]。在基礎(chǔ)研究中發(fā)現(xiàn)VEGF阻斷抗體能夠選擇性下調(diào)多種IC分子表達,一些新型的抗血管生成藥物,如重組人血管內(nèi)皮抑制素也不斷被研發(fā)并在聯(lián)合PD-1抗體治療腫瘤中取得較好的療效[55-57]。近年來,考察IC抑制劑和抗血管生成藥物如Bevacizumab、Apatinib、Axitinib、Endostar等在多種腫瘤(腎癌、乳腺癌、非小細胞肺癌、肝癌等)中聯(lián)合治療的臨床試驗也明顯增多,且取得了一定進展,其在膠質(zhì)瘤患者中的療效還有待繼續(xù)探討。
3.4 針對IC的其他治療方式 隨著研究的日益進展,針對IC的治療也不斷涌現(xiàn)出新的治療方法,且不再局限于單純的阻斷抗體,而這些方法可能彌補阻斷抗體治療劑量大、時間長和隨之帶來的毒副作用發(fā)生率增高的不足。微小RNA(microRNA,miRNA)是一類在轉(zhuǎn)錄后水平廣泛調(diào)控基因表達的非編碼RNA分子。研究發(fā)現(xiàn)miR-138、miR-34a等在膠質(zhì)瘤模型中對IC分子的表達調(diào)控起重要作用,其中miR-138能抑制T細胞CTLA-4、PD-1的表達,應(yīng)用miR-138在動物實驗中能有效抑制腫瘤生長,而miR-34a則是PD-L1的負向調(diào)控因子[58-59]。此外,第10號染色體上缺失的磷酸酶-張力蛋白同系物(phosphatase and tensin homolog deleted on chromosome ten,PTEN)和細胞周期蛋白依賴激酶5(cyclindependent kinase 5,Cdk5)都是已證實的PD-L1表達的調(diào)控蛋白,前者通過阻斷PI3K-Akt通路抑制PDL1蛋白的翻譯進程,后者在IFN-γ誘導(dǎo)的PD-L1表達上調(diào)過程中發(fā)揮重要促進作用,而在膠質(zhì)瘤中,相當一部分PTEN都處于突變或表達缺失狀態(tài)[60-61]。因此,針對上述上游分子靶點設(shè)計治療藥物有希望作為一種更廣義的IC抑制劑,通過直接干預(yù)相應(yīng)IC的表達來抑制其介導(dǎo)的促腫瘤效應(yīng)。
當然,目前探討的包含IC抑制劑的聯(lián)合治療方式遠不只以上幾種,越來越多的治療如腫瘤疫苗、病毒疫苗、細胞因子靶向治療等被研究人員嘗試和IC抑制劑進行聯(lián)合應(yīng)用以期達到更好的抗腫瘤療效[62-65]。
4 結(jié)語
中樞神經(jīng)系統(tǒng)雖然具有獨特的免疫環(huán)境,但仍能產(chǎn)生有效的抗腫瘤免疫應(yīng)答,因此免疫治療在膠質(zhì)瘤的治療中具有巨大潛力。針對IC的靶向治療目前已成為進展迅速且療效可觀的腫瘤免疫治療方法,并且CTLA-4、PD-1的多種阻斷藥物已經(jīng)被藥監(jiān)機構(gòu)通過作為非小細胞肺癌、黑素瘤等疾病的臨床用藥,但IC抑制劑在膠質(zhì)瘤治療的應(yīng)用仍處于前期臨床試驗階段。此外,針對不同類型分期膠質(zhì)瘤患者對IC抑制劑治療的生物學標志的選擇以及IC抑制劑聯(lián)合其他腫瘤治療手段的方式時機的確定還需更近一步的基礎(chǔ)和臨床研究加以驗證和探討。因此,顯著實現(xiàn)IC抑制劑對更多膠質(zhì)瘤患者療效的提高及預(yù)后的改善還任重道遠。