內界膜填塞與翻轉覆蓋治療大直徑特發性黃斑裂孔的療效對比王愛芹
高自清 張銳
黃斑裂孔是指黃斑中心凹部視網膜神經上皮層從內界膜層到光感受器細胞層出現的組織缺損,是常見的玻璃體視網膜疾病,嚴重損害患者的中心視力。特發性黃斑裂孔(idiopathic macular hole,IMH)是指排除眼外傷、玻璃體視網膜病變等原發眼部病變的年齡相關性黃斑裂孔,發病率占所有黃斑裂孔的83%[1]。隨著特發性黃斑裂孔病因、發病機制研究的不斷進展,其手術治療方式也在不斷改進。目前的標準術式是經睫狀體平坦部玻璃體切割+內界膜剝除術,解除了裂孔周圍的切線牽拉作用,刺激Müller細胞增生,促進裂孔愈合[2]。但是應用于大直徑的特發性黃斑裂孔時,閉合率較低[3],且會出現視網膜結構改變、視野缺損等不良后果。改良黃斑裂孔手術中,玻璃體切除聯合內界膜翻轉覆蓋術在解除牽引力的同時為神經膠質細胞的增生提供支架,提高了裂孔閉合率[4]。玻璃體切割聯合內界膜填塞術在大直徑黃斑裂孔的治療中也取得了良好的閉合率和視覺預后[5]。本研究觀察大直徑特發性黃斑裂孔患者行內界膜填塞術或內界膜翻轉覆蓋術手術前后黃斑區形態及血流特征變化,比較分析兩種術式的臨床療效,從而促進黃斑裂孔閉合機制的進一步研究,優化術式選擇。
資料與方法
一、 一般資料
選取2019年2月至2020年2月在蚌埠醫學院第一附屬醫院眼科收治的特發性黃斑裂孔且裂孔最小直徑>600 μm的患者為研究對象,27例(27只眼),男性9例,女性18例,年齡45~80歲,平均年齡為(63.41±8.41)歲。已排除合并眼部外傷史、視網膜脫離、糖尿病性視網膜病變、年齡相關性黃斑變性、葡萄膜炎等疾病的病例;無法耐受手術的病例;高度近視者;高眼壓(≥21 mmHg)或青光眼患者;有明顯白內障未行手術治療者。

表1 患者基本情況
二、治療方法
1.術前檢查:所有患者術前均行最佳矯正視力(best corrected visual acuity,BCVA)、眼壓、裂隙燈+90D前置鏡眼底檢查、IOL-Master、眼部B型超聲、相干光層析成像術(optical coherence tomography, OCT)、相干光層析血管成像術(optical coherence tomography angiography, OCTA)檢查。其中OCTA檢查選擇視網膜血流成像掃描模式(Angio retina 3.0 mm)。
2.分組標準:將納入研究的27例患眼隨機分為A、B兩組,其中A組15例均行玻璃體切除+內界膜填塞+玻璃體腔消毒空氣填充術,B組12例均行玻璃體切除+內界膜翻轉覆蓋+玻璃體腔消毒空氣填充術。手術均由同一位經驗豐富的眼底病醫師完成。
3. 手術方法:術前準備:術前予以抗生素滴眼液點眼、淚道沖洗、結膜囊沖洗等處理。手術操作:手術均在2%利多卡因球后麻醉條件下行標準25G三通道玻璃體切割,切割中軸玻璃體后,曲安奈德染色玻璃體,完成玻璃體后脫離,切割周邊玻璃體。稀釋后吲哚青綠溶液染色內界膜,A組使用內界膜顳環形撕除裂孔周圍約2 PD大小內界膜,內界膜不完全剝離,留有一蒂與孔緣相連,玻切頭修剪內界膜瓣(內界膜瓣的大小取決于裂孔直徑)后填塞至裂孔內。B組環形撕除裂孔周圍約2 PD大小內界膜,但保持下方內界膜瓣(內界膜瓣的大小取決于裂孔直徑)與孔緣相連,將其向上反折并覆蓋在裂孔上。操作完成后,兩組均行緩慢氣液交換,防止內界膜瓣移位,玻璃體腔內注入消毒空氣,拔出套管針,整合切口,棉簽輕輕按摩,不予以縫合。檢查切口是否有滲漏,若切口有明顯滲漏,則使用8-0可吸收縫線縫合。術后處理:術后予以局部抗感染治療;嚴格俯臥位休息至玻璃體腔內氣體吸收;監測眼壓變化,如有眼壓升高,排除禁忌證后予以卡替洛爾或布林佐胺滴眼液點眼。
4.術后隨訪:患者術后分別于1個月、3個月行BCVA、裂隙燈+90D前置鏡眼底檢查、眼壓、OCT、OCTA檢查。記錄BCVA、裂孔閉合形態、外界膜(external limiting membrane,ELM)缺損直徑、中心凹無血管區(foveal avascular zone,FAZ)面積變化。
三、統計學分析
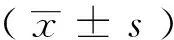
結 果
一、裂孔閉合情況
術后隨訪3個月結束時,所有患者均無視網膜脫離。內界膜填塞組14只眼裂孔閉合(93.33%),其中4只眼呈U型閉合(26.67%),1只眼未閉合。內界膜翻轉覆蓋組10只眼閉合(83.33%),其中7只眼呈U型閉合(58.33%),2只眼未閉合。見圖1。兩組裂孔閉合率差異無統計學意義(P>0.05)。
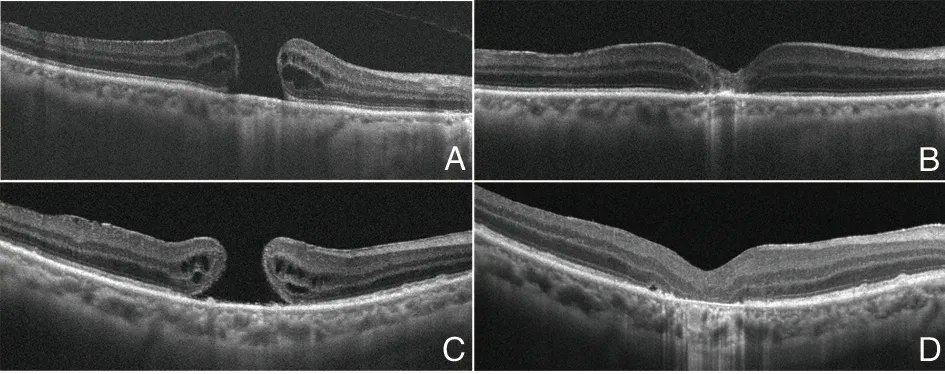
圖1 A示玻璃體切除聯合內界膜填塞術前OCT檢查結果;B示患者術后OCT檢查結果;C示玻璃體切除聯合內界膜翻轉覆蓋術前OCT檢查結果;D示患者術后OCT檢查結果
二、術后視力
術后兩組患者BCVA較術前均有明顯改善(P<0.05),且翻轉覆蓋組術后BCVA優于填塞組,術后1個月(t=2.298,P=0.030)、術后3個月(t=2.196,P=0.038)。見表2。
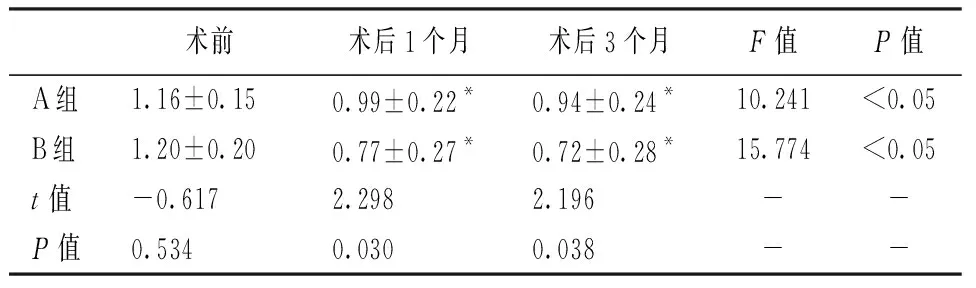
表2 兩組各隨訪時間點平均BCVA(logMAR)
三、ELM缺損直徑
術后兩組患者ELM缺損直徑均較術前減小(P<0.05),但兩組間比較差異無統計學意義,術后1個月(t=0.440,P=0.664),術后3個月(t=1.894,P=0.07)。內界膜翻轉覆蓋組中有3只眼在隨訪結束時外界膜重新連接(25%),而填塞組未見外界膜重新連接。見表3。
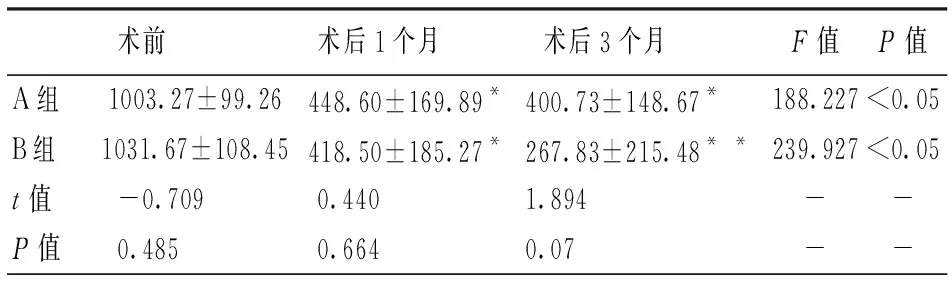
表3 兩組各隨訪時間點平均ELM缺損直徑(μm)
四、FAZ變化
術后兩組患者FAZ面積(視網膜層)均較術前減小(P<0.05),但兩組間比較差異無統計學意義,術后1個月(t=-0.543P=0.592),術后3個月(t=-0.376P=0.710)。見表4。
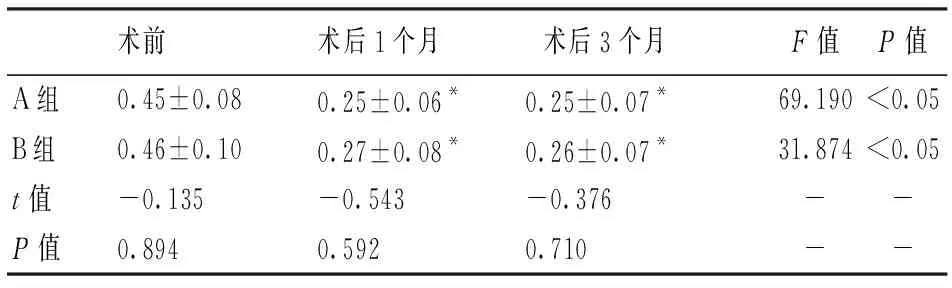
表4 兩組各隨訪時間點平均FAZ面積(mm2)
討 論
玻璃體切除聯合內界膜撕除術是治療特發性黃斑裂孔最常用的術式[6]。解除了黃斑中心凹處玻璃體后皮質產生的切線牽引力,促進裂孔閉合,但對于大直徑黃斑裂孔患者,裂孔閉合率及視力預后仍不理想。并且會產生內層視網膜結構改變、黃斑移位、視敏度下降及視野缺損等并發癥[3]。隨著研究的不斷進展,玻璃體切除聯合內界膜填塞術與玻璃體切除聯合內界膜翻轉覆蓋術都是治療大直徑特發性黃斑裂孔有效的手術方式,可以得到較高的閉合率和良好的視力改善。
Michalewska等首次將玻璃體切除聯合內界膜翻轉覆蓋術用于治療大直徑黃斑裂孔,閉孔率達到98%[7]。一方面,ILM中的IV型膠原、纖維連接蛋白和層粘連蛋白可以促進Müller細胞的增殖和遷移,誘導網膜向心運動,另一方面也避免了外層視網膜與玻璃體內物質接觸,減少水合作用,維持中心凹持續重塑,帶來良好的視力預后[8]。內界膜填塞術可以起到類似作用,但是內界膜填塞至裂孔內的操作可能會造成RPE層的機械性損傷[9],填塞至裂孔內的內界膜阻礙神經上皮層重新連接和光感受器細胞層復位,可能是造成術后視力不佳的原因。無論是內界膜翻轉覆蓋術還是內界膜填塞術,都可能會有膠質過度增生的風險[10],膠質過度增生可能會延緩鄰近光感受器細胞層缺損的修復。
自頻域相干光層析成像術(spectral-domain optical coherence tomography,SD-OCT)技術出現后[11],OCT的成像速度、分辨率有了大幅度提升,使黃斑區視網膜各層結構的觀察和分析成為可能。橢圓體帶缺損直徑是指光感受器細胞層兩斷端間的水平距離,光感受器細胞層將光信號轉化成生物電信號向中樞神經傳遞,它的重建是評價黃斑裂孔術后視力恢復的重要指標[12]。ELM作為光感受器細胞和Müller細胞連接的標志,是評價黃斑裂孔手術療效的指標,同時也是光感受器細胞層修復的重要條件[13]。本次試驗中,翻轉覆蓋組術后有25%的患者外界膜層重新連接,填塞組未見外界膜層重新連接。翻轉覆蓋組術后視網膜形態優于填塞組。填塞至裂孔內的內界膜會引起瘢痕愈合[17],可能是術后外界膜不能重新連接的原因。
黃斑裂孔術后FAZ面積減小,提示黃斑中心凹組織發生向心運動[14]。2017年,Kim等[15]應用OCTA比較分析黃斑裂孔患者黃斑區血流特點發現患者術后BCVA與FAZ面積大小顯著相關。然而Yun等[16]的試驗得出的結論卻是最終視力與視網膜血流變化無關。本研究中,內界膜填塞組與翻轉覆蓋組術后FAZ面積均較術前減小,但組間比較無統計學差異。本次試驗未對FAZ面積變化與術后視力進行相關性分析,FAZ面積變化與術后視力恢復的關系還需進一步研究考證。內界膜填塞及翻轉覆蓋均可以得到較高的裂孔閉合率,是治療大直徑特發性黃斑裂孔療效穩定的術式,但是內界膜翻轉覆蓋術術后視力及裂孔閉合形態優于內界膜填塞術。本次試驗隨訪時間短、樣本量較小,可能造成試驗結果的偏差,且未行視野等檢查,不能全面評價患者視功能變化。對于大直徑特發性黃斑裂孔手術治療的研究還需要更大樣本量的前瞻性研究,以完善個性化術式選擇。

