大黃素通過調節Nrf2/HO-1和MAPKs抑制炎癥和氧化應激機制研究①
張昊悅 趙 蓓 王業皇 章 陽(南京中醫藥大學附屬南京中醫院肛腸中心,南京210000)
炎性腸病是一系列導致多種并發癥的疾病,包括克羅恩病和潰瘍性結腸炎,其中最常見的是腸纖維化和癌癥[1]。潰瘍性結腸炎和克羅恩病患者的黏膜炎癥常表現為固有層淋巴細胞、巨噬細胞和中性粒細胞浸潤[2]。巨噬細胞在維持腸道穩態中起著至關重要的作用,并且被認為是炎性腸病的關鍵參與者。經典激活的M1型產生一氧化氮、活性氧和促炎細胞因子,活動期炎性腸病患者腸道黏膜中的一氧化氮表達驟增,可抑制超氧化物歧化酶(su?peroxide dismutase,SOD)活性、促使脂質自由基形成,導致腸黏膜通透性增加、黏膜屏障功能受損[3]。并且它在諸如傷口愈合和組織的建設過程中起維修作用[4]。因此抑制巨噬細胞M1型活化可影響炎性腸病的發生發展。氧化應激是指機體受到多種病理因素刺激后,體內ROS產生過多,抗氧化能力下降,打破了機體正常氧化還原動態平衡,造成生物大分子如蛋白質、脂質、核酸等的氧化損傷,干擾正常生命活動而形成的一種嚴重的應激狀態[5]。ROS來源增多和抗氧化能力降低是導致氧化應激水平增高的主要機制,Nrf2信號通路是細胞內氧化應激最重要的防御系統之一,當細胞發生氧化應激,Nrf2信號通路首先被激活,進而引發抗氧化物及相關酶類的大量表達,以抵御氧化應激引發的細胞損傷,減少ROS產生[6]。Nrf2可以調控具有重要的抗氧化和抗炎活性的HO-1,而HO-1在大鼠結腸炎模型有重要保護作用,HO-1的表達能抑制促炎介質的產生[7-8]。
盡管已開發出各種抗炎藥物,例如水楊酸類制劑、硫唑嘌呤等免疫抑制劑藥物和生物制劑,但由于這些藥物的肝腎損傷、過敏反應等副作用較多,目前仍需要研發具有抗炎作用同時減少副作用的中藥單體。
大黃素(Emodin,1,3,8-三羥基-6-甲基蒽醌)是一種常見的蒽醌衍生物,據報道具有多種生物學特性,例如抗炎、抗病毒、抗腫瘤和抗氧化活性[9-12]。根據文獻所知大黃素能夠通過抗氧化和抗炎活性減輕重癥急性胰腺炎,大黃素可以通過上調lncRNA TUG1抑制LPS誘導的小鼠軟骨ATDC5細胞凋亡和炎癥[13-14]。大黃素可通過抑制大鼠結腸炎NF-κB炎癥通路產生抗炎作用,但是關于大黃素對細胞氧化應激反應的作用未見相關報道[15]。但是大量文獻表明天然蒽醌類藥物能夠抑制細胞體內的ROS[16]。本研究擬探討大黃素能否通過Nrf-2/HO-1和MAPKs抑制炎癥,并減輕氧化應激反應。
1 材料與方法
1.1 材料
1.1.1 藥物和細胞 中藥單體大黃素(中國藥檢所);小鼠單核巨噬細胞系(RAW264.7)購自中國科學院上海科學研究院細胞庫。用含有10%胎牛血清高糖DMEM培養基培養于37℃、5%CO2培養箱。
1.1.2 主要試劑 CCK8試劑盒(同仁化學研究所);Griess試劑盒(上海碧云天);活性氧(ROS)檢測試劑盒(美國Solarbio公司);RNA提取試劑(美國Sigma公司);Perfect real time-PCR試劑盒(日本Ta?KaRa公司);SYBR Green RCR Kit(QuantiNova公司);PCR引物設計和合成(生工生物工程有限公司);核因子E2相關因子(nuclear factor E2 related factor 2,Nrf2)(1∶1 000)、血紅素氧化酶1(hemeoxy?genase1,HO-1)(1∶1 000)、細胞外信號調節激酶(ERK)及其磷酸化(pERK)(1∶1 000)、p38絲裂原激活的蛋白激酶(p38)及其磷酸化(pP38)(1∶1 000)和GAPDH抗體(CST)(1∶1 000),均為兔抗,兔二抗(美國Jackson ImmunoResearch Laboratories)(1∶10 000);超敏ECL化學反應發光試劑盒(新賽美生物科技有限公司)。
1.1.3 主要儀器 CO2培養箱、超凈工作臺、酶標儀(瑞士Tecan公司);Cytoflex流式細胞儀(美國貝克曼庫爾德公司)。
1.2 方法
1.2.1 CCK8法測定大黃素對RAW264.7細胞的毒性影響 將RAW264.7,接種于96孔板,每孔1×105個細胞,置于培養箱(37℃、5%CO2)中孵育12 h。加入不同濃度的大黃素繼續培養24 h,濃度為25、50、100、200、300μmol/L,設定3個平行組,24 h后,每孔加入10μl的CCK8試劑,放置培養箱孵育1.5 h,酶標儀(450 nm)測吸光度值(A)。細胞活力計算公式為:細胞活力(%)=各濃度給藥組的A值/空白組的平均A值×100%。
1.2.2 Griess法檢測大黃素對LPS誘導RAW264.7細胞炎癥介質NO的影響 RAW264.7細胞接種于96孔板培養基,每孔1×105個細胞。過夜后細胞貼壁,棄掉培養基后,分別設置對照組、LPS(LPS1μg/ml)、大黃素低劑量組(LPS1μg/ml+大黃素20μmol/L),大黃素高劑量組(LPS1μg/ml+大黃素40μmol/L)。加入各組藥物后孵育24 h后,吸取50 μl的上清液至空白的96孔板,設置標準曲線,分別加入50μl Griess試劑A和Griess試劑B,孵育10 min,用酶標儀570 nm處測定各孔OD值,根據標準曲線,計算每組的NO的含量。
1.2.3 RT-PCR法檢測LPS誘導的細胞的IL-6、iN?OS、IL-1βmRNA的含量 RAW264.7細胞培養于6孔板,分組及處理同1.2.2,每孔5×105個細胞,貼壁生長過夜。加藥處理24 h后收集各組RNA樣品。用Trizol提取方法細胞總的RNA,用Perfect Real Time試劑盒逆轉錄提取總cDNA,反應體系37℃、15 min,85℃5 s,4℃保存,后用RT-PCR進行檢測(引物如表1)。PCR反應條件:95℃2 min,95℃5 s,60℃10 s,共40個循環。重復3次,β-肌動蛋白(β-actin)作為內標基因。使用2-ΔΔCt法計算mRNA含量。
1.2.4 流式細胞術檢測大黃素對RAW264.7細胞ROS的影響 細胞培養和處理同1.2.2,作用24 h后,收集細胞,用4℃PBS沖洗2次,10μmol/L DCF-DA 37℃孵育30 min后,用PBS清洗2遍,流式上機檢測。
1.2.5 流式細胞術檢測大黃素對LPS誘導的RAW264.7細胞表面膜蛋白CD86的影響 細胞培養和分組處理同1.2.2。用預冷的PBS沖洗2遍,PBS重懸細胞,調整細胞濃度為1×107個/ml,取100μl到流式管中,加入PE抗鼠CD86抗體以及IgG2a的同型對照組,4℃避光孵育20 min;1 000 r/min離心5 min,收集細胞,棄上清,再加入200μl的PBS;用Cytoflex流式細胞儀檢測。以Flow Jo軟件分析結果。
1.2.6 檢測大黃素作用于RAW264.7細胞Nrf-2/HO-1蛋白表達 RAW264.7細胞鋪于6孔板,加入不同組別的藥物作用,24 h后,消化收集細胞,用預冷的PBS洗滌細胞,每孔加入RIRA裂解液100μl,收集細胞于1.5 ml離心管中。冰上放置30 min,然后4℃,12 000 g離心15 min,取上清液,蛋白定量試劑盒進行蛋白定量。加入蛋白上樣緩沖液,金屬浴10 min變性。使用10%SDS-PAGE電泳分離,200 mA恒流轉膜90 min,5%脫脂奶粉,室溫封閉1 h;4℃過夜孵育一抗(1∶1 000),一抗為Nrf-2和HO-1。TBTS溶液洗3次,每次10 min,室溫孵育二抗(1∶20 000)1 h;TBST溶液洗3次,每次10 min,然后使用ECL發光法檢測蛋白。使用Image J軟件對圖像進行分析。
1.2.7 檢測大黃素對LPS誘導的RAW264.7細胞MAPK信號通路的蛋白表達 細胞培養和分組處理同1.2.2。后續處理同1.2.6,一抗為pERK、ERK、pP38和P38,內參為GAPDH。
1.3 統計學方法 應用GraphPad Prism 6統計軟件分析,獨立樣本采用t檢驗分析,計量資料用±s描述,組間比較采用單因素方差分析(ANOVA),以P<0.05表示差異有統計學意義。

表1 引物序列Tab.1 Primer sequence
2 結果
2.1 大黃素對RAW264.7細胞的毒性作用 大黃素在濃度為0~40μmol/L時對正常的RAW264細胞活力無毒性作用,超過40μmol/L,細胞活力下降(見圖1)。所以本研究選用了20、40μmol/L兩個濃度進行后續的研究。
2.2 大黃素抑制LPS誘導的RAW264.7細胞中IL-6、iNOS、IL-1βmRNA表達 根據圖2可以得知,LPS組中IL-6、iNOS、IL-1β細胞因子的mRNA表達與對照組相比較差異有統計學意義(P<0.001);大黃素組與LPS組相比,炎癥因子IL-6、iNOS和IL-1β mRNA隨著藥物劑量的增加而降低,差異具有顯著的統計學意義(P<0.001)。
2.3 大黃素對RAW264.7細胞中NO含量的影響如圖3所示,與對照組相比,LPS誘導的炎癥RAW264.7細胞中NO含量明顯增加;與LPS組比較,不同濃度作用的大黃素中NO含量明顯降低(P<0.001),且具有濃度依賴性。
2.4 大黃素抑制LPS誘導的ROS的產生 圖4結果顯示,與對照組相比,LPS單獨處理組的ROS含量具有統計學意義;大黃素組與LPS組相比能夠明顯的抑制ROS生成(P<0.001),且具有濃度依賴性。
2.5 大黃素對RAW264.7膜表面蛋白CD86的影響 如圖5可知,LPS組高表達CD86膜表面蛋白分子,和對照組相比具有統計學意義(P<0.001)。給予大黃素干預極化的RAW264.7細胞,RAW264.7細胞的CD86明顯的降低,且具有濃度依賴性。

圖1 大黃素對RAW264.7細胞活性的影響Fig.1 Effect of Emodin on activity of RAW264.7 cell
2.6 大黃素能夠促進RAW264.7細胞的Nrf-2/HO-1蛋白的表達 由圖6可知,LPS組的Nrf-2和HO-1蛋白的表達明顯降低(P<0.05)。大黃素組與LPS組相比,能顯著Nrf-2和HO-1蛋白的表達(P<0.05,P<0.01),且存在濃度依賴性。
2.7 大黃素對LPS誘導的MAPK信號通路相關蛋白的影響 如圖7所示,與對照組相比,LPS刺激的RAW264.7細胞,ERK、p38磷酸化水平明顯升高(P<0.01),與LPS組相比,大黃素組的ERK、p38磷酸化水平明顯降低(P<0.05,P<0.01)。結果表明大黃素能夠抑制MAPK的信號通路。

圖2 大黃素對LPS誘導的RAW264.7細胞中IL-6、iNOS、IL-1βmRNA的影響Fig.2 Effect of Emodin on IL-6,iNOSand IL-1βmRNA in LPS-induced RAW264.7 cell
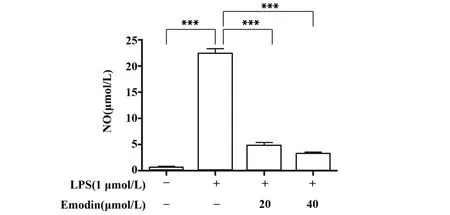
圖3 大黃素對LPS誘導的RAW264.7細胞NO產生的影響Fig.3 Effect of Emodin on NO production in LPS-in?duced RAW264.7 cell
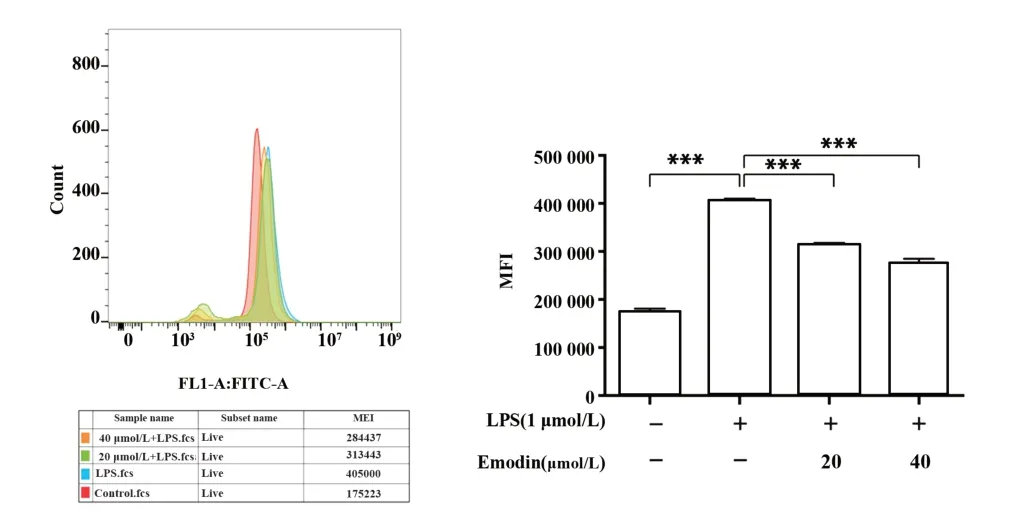
圖4 大黃素對LPS誘導的RAW264.7細胞中ROS產生的影響Fig.4 Effect of Emodin on ROS production in LPS-in?duced RAW264.7 cell
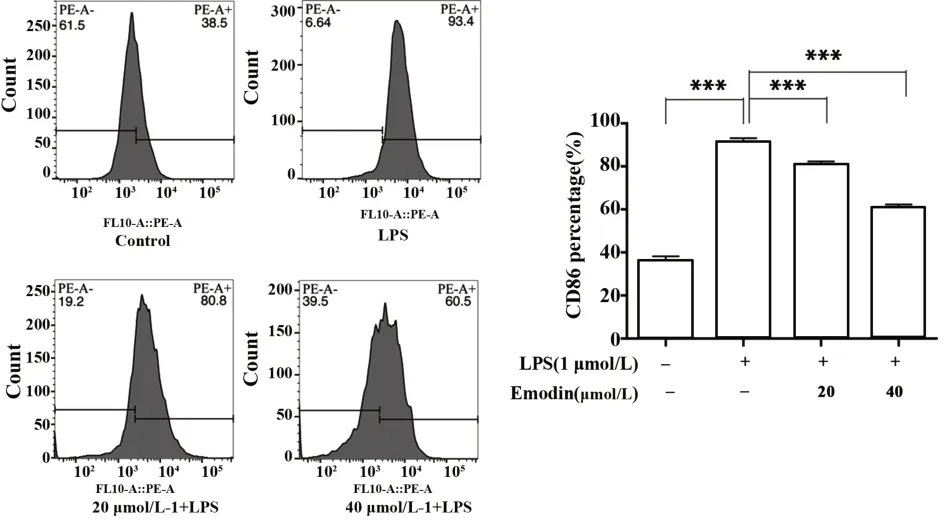
圖5 大黃素對于LPS誘導的RAW264.7細胞膜蛋白CD86的影響Fig.5 Effect of Emodin on CD86 in LPS-induced RAW-264.7 cell

圖6 大黃素對LPS誘導的RAW264.7細胞中Nrf2、HO-1蛋白表達的影響Fig.6 Effect of Emdin on expression of Nrf2,HO-1 in LPSindued RAW264.7 cell
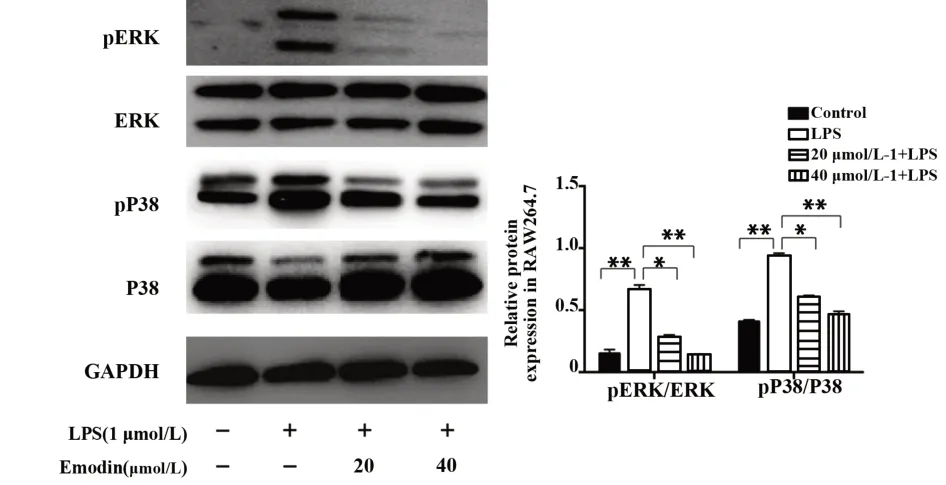
圖7 大黃素對LPS誘導的RAW264.7細胞ERK、P38磷酸化蛋白表達的影響Fig.7 Effect of Emodin on expression of p ERK,p P38 in LPS-induced RAW264.7 cell
3 討論
單核細胞和巨噬細胞是炎癥和先天免疫反應的關鍵效應和調節細胞[17]。巨噬細胞可由革蘭氏陰性菌的脂多糖LPS等有害物刺激產生多種炎癥介質,如NO,iNOS,IL-6和IL-1β等[18]。這些促進炎癥的介質大量產生導致了炎癥[19-20]。因此大量研究在尋找這些促炎介質的抑制劑和抗炎促進劑[20]。
脂多糖(LPS)誘導的RAW264.7細胞炎癥模型是經典的體外炎癥模型。LPS是被Toll樣受體4(TLR4)識別并啟動細胞內信號轉導,并能活化細胞的核因子κ輕鏈增強子(NF-κB)和絲裂原活化蛋白激酶K(MAPK);當MAPK相關蛋白如細胞外信號調節激酶(ERK)和p38絲裂原激活的蛋白激酶(p38 MAPK)信號激活,導致哺乳動物中的炎性介質如一氧化氮表達(NO)的產生,活化的巨噬細胞上的TNF-α和IL-6升高,同時能夠上調活性氧(ROS)[20-24]。ROS又稱活性氧,其產生與炎癥密切相關,炎性腸病中,活化的巨噬細胞和中性粒細胞會持續過量產生ROS,使炎癥條件和不受控制的免疫系統氧化負荷增加[25]。炎性腸病的發展過程中會出現高水平的ROS,產生氧化應激,導致體內穩態喪失,隨后出現細胞氧化應激損傷,包括脂質過氧化產物、蛋白質修飾和促炎癥細胞因子的過度生成[26]。同時局部炎癥細胞因子水平升高,特別是IL-1β、IL-6、IL-12、IL-17、IL-23、IFN-γ和TNF-α,是炎性腸病免疫系統失控的重要特征[27]。因此本研究采用了這個模型模擬了炎性腸病疾病過程中發生的炎癥反應。
研究報道,一切抗氧化酶,如血紅素加氧酶(HO-1),參與iNOS和NO的調控作用,生理狀態下HO-1低表達,可因為缺氧和ROA等刺激后可迅速增加,HO-1增加有助于細胞對刺激的反應,HO-1能夠保護RAW264.7免受ROS的攻擊,HO-1是核轉錄因子E2相關因子2(Nrf2)信號通路的下游蛋白HO-1主要受Nrf2的調控,所以Nrf2/HO-1和MAPK通路一樣,都能夠抑制炎癥和氧化應激反應[28-29]。最近,一些關于炎性腸病的研究將注意力集中在Nrf-2上,它是一種重要的轉錄因子,參與了包括腸道在內的許多器官的纖維化過程,同時已經證實Nrf-2參與了包括結直腸癌在內的多種腫瘤的發展、進展和轉移[29-31]。
大量研究證實了很多中藥及其主要活性都具有能夠抑制炎癥和氧化應激[32-34]。本研究采用了LPS刺激RAW264.7細胞制備體外炎癥模型。大黃素對于RAW264.7具有低細胞毒性,可以抑制LPS誘 導的RAW264.7細胞,降 低IL-6、iNOS、IL-1β mRNA的表達,且抑制效應呈一定的濃度依賴性。研究表明天然蒽醌類藥物能夠抑制RAW264.7中ROS的產生[16]。與此同時,我們通過實驗證實了大黃素能使細胞中ROS和NO水平顯著降低和細胞膜蛋白CD86含量的減少,表明大黃素具有抗炎作用,能夠降低由LPS引起的細胞氧化應激反應。有研究表明大黃素在體外能夠通過抑制TLR4信號通路減輕LPS誘導的急性肝損傷,可以降低體內外TLR4下游蛋白的水平,并且還能抑制細胞培養上清液和血清中TNF-α和IL-6的表達[35]。大黃素能夠大黃素通過PPARγ依賴途徑抑制脂多糖誘導的RAW264.7細胞炎癥[36]。雖然大黃素對已經證實了對RAW264.7細胞具有很強的抗炎效應,但是對抑制RAW264.7細胞的炎癥和ROS的表達沒有做深入的機制研究,所以我們對此進行了探討。為了進一步闡明大黃素在介導炎癥和氧化應激反應中的分子機制,通過Western blot實驗,檢測大黃素對LPS誘導后的RAW264.7的Nrf-2、HO-1和MAPK通路表達的影響。本研究結果顯示大黃素能夠顯著增加由LPS誘導的后細胞中Nrf-2、HO-1的蛋白表達,對細胞起到一定的保護作用。同時大黃素還能夠通過抑制MAPK通路的活化從而對LPS誘導的炎癥反應起到抑制作用。
綜上所述,大黃素能夠調節Nrf2/HO-1信號和MAPK信號通路抑制LPS誘導的RAW264.7細胞炎癥和氧化應激作用,這些信號通路與炎性腸病密切相關。本研究進一步探索了大黃素體外抗炎的活性及其機制,為大黃素治療炎性腸病提供證據,為臨床應用奠定基礎。