內鏡黏膜下剝離術診治食管早癌及癌前病變的臨床價值
胡紅娜 章禮久 宋莎莎
近年來,隨著內鏡技術的不斷進步及內鏡器械的不斷更新,食管癌的診斷方法越來越多,其早期診斷、早期治療已成為臨床關注的焦點。而內窺鏡黏膜下剝離術(endoscopic submucosal dissection,ESD)是近年來發展起來的一種胃食管腫瘤整體切除術,可一次性完整切除較大范圍的病變,不僅可以提高腫瘤的根治率,而且可以對整個病變進行精確的組織學評估。ESD作為一種新興的微創技術,相較于傳統外科手術,ESD即保留了食管正常解剖結構和生理功能,且術后遠期療效相當,目前已成為食管早癌(early esophageal cancer,EEC)及癌前病變的主要治療方式。本研究對明確診斷為EEC及癌前病變并行ESD治療患者的臨床、病理及隨訪資料進行回顧性分析,探討ESD在診治EEC及癌前病變中的臨床價值,現報道如下。
1 資料與方法
1.1 一般資料 選擇2017年3月至 2019年6月在安徽醫科大學第二附屬醫院內鏡中心接受ESD治療的EEC及癌前病變患者63例,回顧性分析所有患者的臨床、病理及隨訪資料。患者中,男性42例,女性21例,年齡48~79歲,平均(64.22±7.58)歲。63例患者臨床表現無明顯特異性,主要包括進食哽噎感、咽部/胸骨后異物感、咽部/胸骨后/上腹不適、反酸燒心及噯氣等。
所有患者術前均經常規胃鏡及術前活檢確診,并進一步行窄帶成像放大內鏡技術(narrow-band imaging with magnifying endoscopy,NBI-ME)、超聲內鏡檢查(endoscopic ultrasonography,EUS)提示病變位于黏膜層及黏膜下層淺層,固有肌層完整;所有患者術前需完善血常規、肝腎功能、凝血功能、心電圖檢查排除手術禁忌,完善胸腹部CT檢查未見局部及遠處轉移,告知手術可能獲益及存在風險,并在術前獲得所有患者進行ESD的書面知情同意書。對于長期口服抗凝藥或抗血小板藥物治療的患者,經相關科室會診評估停藥風險后,術前停用相關藥物至少1周。
1.2 ESD方法
1.2.1 儀器和設備 內鏡主機系統:Olympus Evis Lucera ELITE CLV-290SL/Olympus Evis Lucera Elite CV-290。內鏡:Olympus Q260J、Olympus H260Z。內鏡治療器械包括:Dual刀(KD-650L)、鉤刀(KD-620LR)、電凝止血鉗(FD-410LR)、Olympus 附沖水裝置、NM-4L-注射針、CO氣泵、圈套器、附加透明帽、ERBE-300D 高頻電切裝置、氬離子凝固器(argon plasma coagulation,APC)、南京微創(Micro-tech Nanjing)Accu-Clip 金剛夾和Boston M00522610止血夾、UM-2R 微探頭超聲。
1.2.2 ESD操作步驟 所有患者氣管插管麻醉后采取左側臥位,內鏡連接Olympus 附沖水裝置及CO氣泵,附加透明帽(安裝在內鏡前端,以獲得穩定的內窺鏡視野,并在結締組織上產生張力,便于進行黏膜下剝離)。①普通白光鏡下明確病變位置后,切換NBI及Lugol’s碘染色再次確定病變邊界。②病灶周圍標記:以Dual刀/APC沿病變邊緣外0.3 ~ 0.5 cm處每隔0.2 cm處標記,明確靶病變的周長。③形成黏膜下液體墊:退鏡后內鏡前端安裝透明帽,進鏡至病變標記處,黏膜下注射玻璃酸鈉+甘油果糖+靛胭脂混合液+腎上腺素混合液,多點重復注射至黏膜抬舉至理想水平。④邊緣切開:沿標記點外緣,以Dual刀/鉤刀切開環周至黏膜下層。⑤黏膜下剝離:Dual刀/鉤刀從黏膜切口的區域開始剝離黏膜下層,術中反復多次黏膜下注射,及時電熱止血鉗鉗夾/APC/金屬夾夾閉血管止血以防止出血影響手術順利進行。⑥ESD術后人工潰瘍的處理:仔細檢查創面,用電熱止血鉗對可能出血病灶進行電凝止血防止延遲出血,對于剝離較深的創面局部予以金屬夾夾閉防止術后穿孔,創面處理干凈后留置胃管。⑦術后標本的處理:以網兜完整取出標本后,用細針將薄的卷起的ESD樣本外圍其固定在下面的泡沫塑料板上,測量大小,再次碘染確認完整切除,并將標本浸入40%甲醛中送檢病理;病理醫師固定標本以0.2 cm的間隔連續切片,平行于最接近切緣的線,以便準確評估切緣和侵襲深度。將切片材料包埋在石蠟中制成組織學切片,用蘇木精-伊紅染色 (hematoxylin-eosin staining,HE )并進行顯微鏡檢查,見圖1。

圖1 ESD操作過程及術后病理
1.3 術后處理和病理診斷 術后常規禁食水、抑酸、止血、補液及合理應用抗生素。如果患者的癥狀、實驗室檢查結果無明顯異常,術后第2天進行流質飲食,第3天半流飲食,并在1周內出院,出院后常規口服質子泵抑酸劑6~8周。對于創面較大、較深者禁食時間延長,如出現并發癥,根據患者的情況調整時間表。針對病變環周比>1/2者,尤其是環周比近3/4者,術后1周加用強的松30 mg/d口服,逐漸減量治療至術后3個月停用,防治ESD術后狹窄。
EEC及癌前病變的病理學診斷標準:食管鱗狀上皮內異型增生分為輕度異型增生、中度異型增生及重度異型增生;上皮內瘤變強調的是腫瘤的演進過程,分為低級別上皮內瘤變(low grade intraepithelial neoplasia,LGIN)和高級別上皮內瘤變(high grade intraepithelial neoplasia,HGIN),LGIN相當于輕度和中度異型增生,HGIN相當于重度異型增生和原位癌。本研究將對術前活檢病理及術后最終病理結果進行比較,評估術前/術后的病理診斷一致率、低估率以及高估率。與術前病理比較,術后病理程度較術前加重(即病變嚴重程度被低估)的總占比為低估率,而術后病理程度較術前減輕(即病變嚴重程度被高估)的總占比為高估率。
1.4 療效判斷及術后隨訪 參照2015年《中國早期食管癌及癌前病變篩查與內鏡診治共識》,評估ESD治療效果主要指標包括整塊切除率、完全切除率及治愈性切除率。整塊切除是指病灶在內鏡下被整塊切除并獲得單塊標本,完全切除是在整塊切除標本的基礎上水平和垂直切緣均為陰性,治愈性切除則是整塊切除標本的水平和垂直切緣均為陰性且無淋巴結轉移風險。
術后規律隨訪,通常在ESD后3個月左右進行碘染色+NBI-ME的后續內鏡檢查,以確認術后潰瘍愈合情況,排除殘留腫瘤的存在。對于有殘留者,視具體情況建議行內鏡下治療或追加治療(外科或放療)。在ESD術后約6個月、12個月再次進行復查內鏡,無異常隨后每年進行內鏡復查,以排查局部復發和/或符合淋巴結轉移性腫瘤標準的第二原發病灶。同時復查計算機斷層CT掃描和內鏡超聲檢查評估有無遠處或淋巴結轉移的存在。
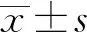
2 結果
2.1 內鏡下基本特征 本組患者ESD切除食管病灶共63處,62例為單發病灶,其中1例食管病灶合并胃食管結合部病灶。病灶部位分布:食管上段5例(7.94%),食管中上段1例(1.59%)、食管中段36例(57.14%)、食管中下段10例(15.87%)、食管下段11例(17.46%)。病灶范圍:病灶切除長徑1.0~13.0 cm,病變環周比≤1/2者58例,1/2<病變環周比≤3/4者5例。巴黎分型均為淺表型(Ⅱ型),其中0~Ⅱb型最多為43例(68.25%)。
2.2 ESD操作結果及并發癥情況 63例患者患者均成功完成ESD治療,ESD手術時間48~326 min,平均(98.76±49.13)min,其中耗時最長者為食管中下段長達13 cm病灶。所有患者均無術后出血、穿孔等相關并發癥,對可能出現ESD術后狹窄病例預防性應用激素治療3個月,2例(3.17%)患者術后出現狹窄,1例行內鏡下球囊擴張治療后緩解,1例輕度狹窄無需內鏡干預。本組患者ESD術后出現發熱37例(58.73%),其中29例患者僅為單純術后發熱,體溫高峰不超過38℃,術后3 d內很快恢復正常;另8例患者由于術后出現胸腔積液合并肺部感染伴發熱,體溫高峰超過38℃,呈現高熱,結合術后CT復查結果未見穿孔,術后1周再次行食管碘水造影未見造影劑外滲,所有發熱患者經抗生素治療后體溫均能在1周內降至正常。
2.3 治療效果及隨訪情況 所有患者均達到ESD整塊切除(切除率達到100%),見圖1G。結合術后病理結果,其中58例患者基底切緣、水平切緣均為陰性,僅5例患者單純水平切緣(均為肛側切緣,7.94%)陽性,4例切緣殘留HGIN,1例切緣殘留LGIN,余基底切緣、淋巴管、脈管內均陰性,結合CT、EUS檢查結果淋巴結陰性,完全切除率、治愈性切除率均達到92.06%。1例切緣殘留LGIN者予以隨訪,另4例切緣HGIN陽性患者因患者基礎狀況、個人及家庭綜合意愿選擇密切隨訪(高質量的胃鏡復查、CT及EUS隨訪),隨訪至截止時間均未見復發及遠處轉移。
63例患者均完成有效隨訪(隨訪截止時間為2020年6月),隨訪期間無一例發生遠處轉移及局部殘留,僅1例術后1年復查胃鏡考慮復發(復發率1.59%),NBI-ME檢測的上皮內乳頭狀毛細血管袢主要表現為Ⅳ型、Ⅴ型(JES B1),活檢病理局灶考慮HGIN,再次行ESD完整切除病灶,術后最終病理提示LGIN,水平切緣、基底切緣均陰性,術后3、6個月至1年均定期復查胃鏡,至本研究隨訪截止時間未見復發、殘留及轉移。
2.4 術前活檢病理與術后最終病理一致性的比較 ESD術后最終病理診斷HGIN 45例(71.43%)、LGIN 6例(9.52%)、EEC 12例(19.05%),以HGIN為主;術前活檢病理HGIN 46例(73.02%),LGIN 14例(22.22%),EEC 3例(4.76%)。與ESD術后最終病理診斷比較,術前術后病理診斷一致者有41例,一致率為65.08%,術前活檢及術后病理不一致者22例,低估率(其中活檢LGIN升級為HGIN 7例、LGIN升級為EEC 3例,活檢HGIN升級為早癌8例,共18例)為28.57%,高估率(術前活檢HGIN降級為術后LGIN 2例,術前活檢EEC降級為術后HGIN者2例,共4例)為6.35%,見表1。術前活檢病理與術后最終病理Kappa一致性檢驗提示差異具有統計學意義(Kappa=0.221,P
=0.010),兩者存在一致性,但一致性程度不理想。
表1 63例患者術前活檢病理與術后最終病理比較(例)
3 討論
EEC是指局限于黏膜及黏膜下層的食管癌,經內窺鏡下手術治療此類患者,將其病變黏膜或黏膜下層組織切除即可實現根治,具有創傷小、費用低、恢復快的優勢,目前已廣泛應用于臨床。常用的內窺鏡手術方法有內鏡下黏膜切除術(endoscopic mucosal resection,EMR)和ESD。但EMR僅可去除病灶<2 cm者,較大的病變可能需要分段切除,難以通過組織病理學評估標本的邊緣或確定淋巴結轉移風險,同時增加了術后局部殘留及復發的風險。而ESD無需考慮病灶大小,可一次性整塊切除病灶,局部復發率明顯降低,提高了EEC的根治性切除率。研究顯示,即使是病灶<2 cm的EEC,ESD也是最好的內鏡手術方式。本研究中,對63例EEC及癌前病變患者行ESD治療,整塊切除率達100%,完全切除率及治愈性切除率均達到92.06%,復發率僅為1.59%,與國內指南報道的整塊切除率90.0%~100.0%和完全切除率87.9%~97.4%的數據相近,同時與Takahashi等報道的整塊切除率100%和治愈性切除率97.4%、復發率0.9%較為一致,證實了ESD治療EEC及癌前病變患者的臨床實用價值。
但本組有5例患者單純水平切緣(7.94%)陽性,其中1例切緣殘留LGIN,4例切緣殘留HGIN,分析其原因可能與ESD手術邊界標記與病灶邊緣太近、剝離范圍相對保守有關。因此,ESD術前對病灶邊界、深度的準確評估是避免術后標本水平/垂直切緣殘留、保證完全切除的關鍵。筆者于術前采用NBI-ME及Lugol’s碘染內鏡準確判斷邊界,同時結合EUS判斷病灶浸潤深度,多種內鏡技術的聯合使用提高了完全切除率及治愈性切除率。值得注意的是,切除過度的食管ESD術后狹窄風險相應增加,因此食管ESD操作的技術要求更高,同時需結合操作者的經驗技術,實施規范化的ESD治療。此外,目前臨床上對EEC及癌前病變ESD術后標本切緣殘留的最佳處理方案尚無統一意見,有報道指出,對于單純水平切緣陽性的非治愈性切除可密切觀察。本組病例均嚴格隨訪,僅1例術后1年復查胃鏡考慮復發,病理提示HGIN、行二次ESD治療,術后再次隨訪亦未見殘留及復發。
在EEC及癌前病變患者的病理診斷方面,相較于術前胃鏡活檢,ESD同樣體現了良好的可靠性。雖然術前胃鏡活檢是診斷食管黏膜病變的主要途徑,但研究報道的準確率僅44.1%~66.0%,由于其取材的限制,有低估病變嚴重程度的風險。本研究中,術前活檢病理與術后病理診斷一致率為65.08%,與文獻報道一致,其Kappa一致性系數為0.221,提示術前活檢與術后最終病理結果一致性不理想。這一結果表明,臨床上不能單純依據術前活檢病理判定食管病變的良惡性,同時還需結合病灶的白光鏡下表現、NBI-ME以及Lugol’s碘染結果進行綜合判斷。本組中,術前低估率28.57%,高估率為6.35%,與研究報道一致,提示術前活檢低判的可能性相對較大。分析其原因,一方面,考慮與術前胃鏡活檢的取材部位局限、病變分布不均及取材偏位等因素有關;另一方面,由于ESD術后標本能提供完整的病理,明顯提高了診斷陽性率,尤其對于內鏡下表現為HGIN甚至早癌,但多次復查胃鏡活檢病理僅為LGIN的患者,此類病灶可進行診斷性的ESD治療,既可獲得更準確的病理診斷、減少漏診,同時對病灶進行完整切除,有助于EEC及癌前病變的早診早治。
ESD手術的常見近期并發癥包括出血、穿孔、感染,本研究中無一例發生術后遲發性出血和穿孔。分析其原因,術者認為通過充分的黏膜下注射、反復沖洗出血點暴露良好視野、灼燒止血、電熱止血鉗、金屬夾夾閉以及術畢創面裸露血管的仔細處理等多種途徑,完全可以有效止血、防止術后遲發性出血,這與陸芬英等的觀點一致。也有研究指出,ESD術中使用二氧化碳氣泵、保持手術視野清晰、剝離過程盡量避免肌層暴露、仔細處理ESD術后創面等措施,均可在一定程度上減少穿孔的發生。本組患者術后發熱較為常見(58.73%),考慮與ESD創面大、黏膜完整性破壞、局部創面感染相關;而吸入性肺炎發生率達到12.70%,明顯高于Park等報道的2.3%,分析與術中持續深度麻醉、手術時間長及ESD過程中反復沖洗相關。
狹窄為食管ESD術后的遠期并發癥,發生率為6.21%~18.0%。鞠輝等的研究中,ESD術后狹窄發生率在病變環周比<1/2者、病變環周比1/2~3/4者、病變環周比>3/4者分別為0.7%、27.6%、93.3%,并進一步分析顯示,狹窄程度與病變環周范圍和組織浸潤深度存在關聯。由此可見,病變環周比低于1/2時,ESD術后食管狹窄率極低,故術后可不予食管狹窄相關預防治療;若病變環周比>1/2時,尤其>3/4者,可考慮預防性口服激素或球囊擴張以減少ESD術后狹窄發生。Yamaguchi等的研究也證實,口服激素可有效預防食管ESD術后狹窄,且簡便易行、花費及副作用小,易被患者接受。本研究對病變環周比>1/2的患者預防性應用口服激素治療3個月,僅2例出現術后狹窄,狹窄發生率為3.17%,其中1例行內鏡下球囊擴張治療后緩解,另1例輕度狹窄胃鏡加壓通過、無需內鏡干預。
綜上所述,ESD不僅是治療EEC及癌前病變的重要治療方法,還可提高病理診斷陽性率,具有重要的診斷價值。但食管ESD對手術者操作技術要求較高,臨床醫師需嚴格把握適應證,同時應加強ESD術前、術中及術后質量控制,以期最大程度上減少并發癥發生率,優化、細化ESD治療方案。

