口腔白斑病中黏著斑激酶對細胞增殖的影響
律 娜 肖 宇 孫 明
口腔白斑病(oral leukoplakia, OLK)屬于癌前病變,能癌變成惡性腫瘤。目前,關于OLK癌變的分子過程尚未清楚,因此,探尋其癌變成口腔鱗狀細胞癌(oral squamous cell carcinoma,OSCC)的相關分子標記物,阻斷其癌變進程是當前研究的重點。研究發現,細胞增殖與OLK的預后與轉歸有一定的聯系。黏著斑激酶(focal adhension kinase, FAK)是一類多功能的非受體型酪氨酸激酶,通過酪氨酸激酶受體等數條信號傳輸通路介入細胞的多種生物學進程。FAK與腫瘤干細胞的存活、遷移、入侵以及增殖等生物學行為有關,由于腫瘤干細胞被認為是癌癥的來源,因此,FAK具備潛在的癌基因特點,與某些惡性腫瘤的發展和預后息息相關。增殖細胞核抗原(proliferating cell nuclear antigen, PCNA)是一種核蛋白,是評估細胞增殖活性的優良標志。在許多腫瘤中,PCNA與腫瘤的預后和生存息息相關,如結腸癌、乳腺癌。為此,本研究對41例進行OLK手術切除患者的臨床資料進行回顧性分析,應用免疫組織化學同逆轉錄-聚合酶鏈反應(reverse transcription-polymerase chain reaction, RT-PCR)技術檢測FAK與PCNA在OLK及健康口腔黏膜的表達水平,探討FAK對細胞增殖的影響。
1 資料與方法
1.1 一般資料 選擇2017年1月至2019年12月在安徽醫科大學第一附屬醫院進行OLK手術切除的41例患者。41例患者的OLK標本作為試驗組,其中,男性24例,女性17例;年齡18~65歲,中位年齡為47.60(41.50,57.25)歲;采取雙盲法按照組織病理學診斷的準則,將試驗組41例OLK標本分為OLK上皮單純增生組(n
=10)、OLK上皮輕度異常增生組(n
=11)、OLK上皮中度異常增生組(n
=13)和OLK上皮重度異常增生組(n
=7)。另同期選取10例進行囊腫切除術以及智齒拔除術患者的正常口腔黏膜組織作為對照組(n
=10)。其中,男性6例,女性4例;年齡18~65歲,中位年齡為53.39(51.00,60.00)歲。試驗組與對照組的性別、年齡差異均無統計學意義(P
>0.05)。見表1。所有接受本次試驗的患者及家屬均知情同意,并簽署知情同意書,本研究獲得安徽醫科大學第一附屬醫院倫理委員審核,批準后實施。
表1 兩組患者一般資料比較
1.2 納入與排除標準 納入標準:①臨床資料完整者;②病理診斷,實驗室相關檢查確診為OLK者;③未檢查出其他類型的口腔黏膜疾病者;④就診前2個月內未使用藥物治療者。排除標準:①既往接受過放化療治療者;②使用過激素類藥物者;③有系統性疾病以及感染性疾病者;④臨床資料不完整者。
1.3 實驗試劑 小鼠抗人FAK單克隆抗體(美國Santa Cruz公司);小鼠抗人PCNA單克隆抗體(美國Santa Cruz公司);鏈霉素抗生物素蛋白-過氧化物酶免疫組化染色超敏試劑盒(福州邁新生物技術開發公司);ReverTra Ace CDNA合成試劑盒[東洋紡(上海)生物科技有限公司]; SYBR Safe TM DNA gel stain(美國Invitrogen公司)。
1.4 實驗方法
1.4.1 標本的處理 根據標本的大小,一些置于10%福爾馬林固定,常規病理檢查。其余部分立刻浸入RNA later溶劑,在4℃冷藏箱中放置過夜,而后再移入到-80℃冷藏箱中。41份OLK標本由2名病理科醫師確診。
1.4.2 超敏S-P法染色 石蠟切片脫蠟水化,檸檬酸組織抗原修復液微波修復抗原,滅活內源性過氧化物酶,滴加山羊血清37℃孵育10 min,分別增添一抗FAK(1∶100)與PCNA(1∶100)4℃培養過夜,增添生物素標記二抗,37℃培養10 min,滴加鏈霉素抗生物素蛋白-過氧化酶溶液孵育后,3,3-二氨基聯苯胺鹽酸鹽顯色,鏡下控制反應時間3~5 min,蘇木素復染,脫水,透明,封片。用磷酸緩沖鹽溶液代替一抗作為陰性對照,已知陽性片作為陽性對照。
1.4.3 RT-PCR實驗方法 TRIZOL法提取總RNA,引物由上海生物工程有限公司合成。FAK擴增產物長度為210 bp,上游引物:5’-ATGTTCTGGTGTCCTCAAATG-3’,下游引物:5’-GAGGTAAAACGTCGAAAATTG-3’。內參引物β-actin擴增產物長度為465 bp,上游引物:5’-CGAGCGGGAAATCGTGCGTGACATTAAGGAGA-3’,下游引物:5’-CGTCATACTCCTGCTTGCTGATCCACATCTGC-3’。反應條件:94℃預變性2 min進入循環,94℃變性40 s,退火1 min(各目的基因的退火溫度分別為:FAK 59.2℃、β-actin 56.1℃),72℃延伸1.5 min,經32個循環擴增后72℃延伸10 min。
1.5 結果判定和圖像分析 FAK陽性細胞胞漿呈淡黃至棕黃色。隨機選取5個高倍視野(×400),使用Axio Vision成像系統拍照,ImagePro-Plus 6.0軟件(美國Media Cybernetics公司)進行圖像分析。按照程序使用書,首先,將圖像實施光密度修改(灰度域0~230),之后采取3個參數對結果解析:①陽性染色百分比(percentage of immunostained area,ImA)= 胞漿陽性細胞染色面積/(胞漿陽性染色面積+胞漿陰性染色面積)×100%;②陽性染色平均光密度值(mean intensity of immunostained area,ImIn)=積分光密度值(integrated optical density,IOD)/胞漿陽性染色面積;③免疫組化指數(inedx of total immunopositivity,ImT)=ImA×ImIn=IOD/(胞漿陽性染色面積+胞漿陰性染色面積)。
細胞增殖指數(proliferative index,PI)分析:PCNA陽性反應定位于細胞核,高倍鏡下陽性著色顆粒感明顯。PI的計算:每張切片在病變典型處連續計數5個高倍視野(×400),計數1 000個細胞中增殖細胞所占的百分比。
電泳及半定量研究:標本依次實現目的基因及對照基因的擴增后,各個加樣孔內都增加同一標本的FAK產物8 μL及β-actin產物4 μL,2%瓊脂糖凝膠、70 V恒壓電泳60 min,采用AlphaImageTM 2200數字凝膠成像系統進行拍照后,采取Axio Vision成像系統進行圖像分析,得到目的條帶的IOD。雙蒸水代替引物當作空白對照,不加模板或引物或Taq酶分別做陰性對照。各標本的RT-PCR半定量比值(ratio, R)=目的條帶的IOD /相應內參的IOD。
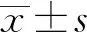
2 結果
2.1 免疫組化染色結果 FAK免疫組化的陽性染色為淺黃至棕黃色,表達于胞質。正常黏膜上皮基底細胞層的胞質呈淺黃色弱陽性表達,固有細胞層也有為數不多弱陽性表達;由于上皮異常增生程度加劇,FAK陽性表達遍及基底細胞層與棘細胞層,同時固有細胞層其表達逐漸呈強陽性,FAK陽性染色強度由淡黃色至棕黃色。見圖1。

圖1 FAK在口腔黏膜組織中的表達(SP×400)
PCNA陽性染色為棕黃色,表達于細胞核。正常黏膜內陽性表達分布于上皮基底層,數目不多。但是由于黏膜上皮異常增生的水平加劇,其表達數量顯著增長,自基底細胞層至棘細胞層及表層均有表達。見圖2。

圖2 PCNA在口腔黏膜組織中的表達 (SP×400)
2.2 5組FAK蛋白表達量比較 5組FAK蛋白表達量進行比較,差異有統計學意義(P
<0.05),對照組與OLK上皮單純增生組相比,差異無統計學意義(P
>0.05);OLK上皮輕度異常增生組的FAK蛋白表達量高于OLK上皮單純增生組和對照組,差異有統計學意義(P
<0.05);OLK上皮中度異常增生組的FAK蛋白表達量高于OLK上皮輕度異常增生組,差異有統計學意義(P
<0.05);OLK上皮重度異常增生組的FAK蛋白表達量高于OLK上皮中度異常增生組,差異有統計學意義(P
<0.05)。見表2。2.3 5組PI指數比較 5組PI指數進行比較,差異有統計學意義(P
<0.05),對照組與OLK上皮單純增生組相比,差異無統計學意義(P
>0.05);OLK上皮輕度異常增生組的PI指數高于OLK上皮單純增生組和對照組,差異有統計學意義(P
<0.05);OLK上皮中度異常增生組的PI指數高于OLK上皮輕度異常增生組,差異有統計學意義(P
<0.05);OLK上皮重度異常增生組的PI指數高于OLK上皮中度異常增生組,差異有統計學意義(P
<0.05)。見表2。
表2 5組FAK蛋白、FAK mRNA和PI表達量比較
2.4 FAK半定量比值比較 所有標本均擴增出210 bp FAK產物及465 bp β-actin產物,見圖3。5組FAKmRNA相對表達量的差異無統計學意義(F
=0.331,P
=0.856)。見表2。
圖3 FAK mRNA 在OLK組織中的RT-PCR擴增結果
2.5 FAK表達與細胞增殖的相關性分析 隨著OLK上皮異常增生水平程度的加劇,FAK表達水平與PI指數呈線性正相關(r
=0.964,P
<0.001)。見圖4。
圖4 FAK免疫組化指數與PI的相關性
3 討論
目前,研究表明在許多上皮來源或間充質的惡性腫瘤中FAK蛋白的表達水平上調,例如在乳腺癌、胃癌、卵巢癌等。FAK的表達水平改變可能是惡性腫瘤發展過程中特征之一。同時研究還發現,細胞中PCNA的高表達與OSCC的組織學分級呈正相關,PCNA表達水平越高提示腫瘤分化程度越低。研究表明,OLK的癌變率為0.13%~17.5%。其病理表現為上皮單純增生或不典型增生,即輕度、中度和重度異常增生,并且最終可能發展為OSCC。本研究結果發現,在癌前病變OLK中FAK和PCNA的表達水平同正常黏膜組織之間存在差異,FAK和PCNA在OLK上皮異常增生患者中維持高水平表達,可能與OLK癌變進展過程相關,促進OLK向OSCC發展,這對研究如何阻斷OLK癌變過程實現早期防治具有重要意義。
本研究結果顯示,與對照組相比,在OLK上皮單純增生的患者中,FAK和PCNA的表達水平差異無統計學意義(P
>0.05),而在OLK上皮異常增生的患者中,FAK和PCNA的表達水平差異有統計學意義(P
<0.05)。并且在不同程度的OLK上皮異常增生患者之間,FAK和PCNA的表達差異有統計學意義(P
<0.05)。提示在OLK向OSCC發展的過程中,FAK和PCNA的過表達出現于OLK早期癌變中,且隨著黏膜上皮異常增生水平的加劇,FAK和PCNA的表達水平與OLK上皮異常增生水平密切相關,可能與OLK癌變進展過程相關。并且PCNA的表達在正常黏膜組織與OLK上皮異常增生組織之間存在差異,與Poosarla 等研究結果相一致。同時Kurio等研究表明FAK過表達于OSCC中,并且能夠影響OSCC的進展,但本研究結果發現,在OLK癌變早期,FAK的表達水平就顯著上調,猜測在OLK癌變的早期FAK已經維持高水平的表達,這一現象對OLK向OSCC的進展具有積極作用。此外,本研究還采用RT-PCR方法檢測OLK組織中FAK mRNA水平,結果顯示各病理分組中均有FAK mRNA表達,但統計分析發現各分組當中FAK mRNA表達無明顯差異(P
>0.05)。表明FAK在轉錄水平上未發生明顯改變,而在蛋白水平卻具有差異,可能存在FAK轉錄后的調控機制。本研究還發現FAK的表達和PCNA二者之間具有一定關系。由健康的黏膜向OLK輕度異常增生至重度異常增生轉變的過程中,FAK與PCNA表達之間存在正相關關系(r
=0.964,P
<0.05),推測是這二者之間的協同作用最終導致了OSCC的發生。綜上所述,通過對OLK患者中FAK和PCNA表達水平的檢測,發現FAK與PCNA在OLK上皮異常增生的患者中表達上調,二者的表達水平與OLK的癌變過程有關,可能作為評價OLK癌變過程的潛在標記物,這對研究OLK癌變過程中的相關分子標記物以及如何阻斷OLK向OSCC發展等方面具有一定價值。在今后的研究中,將進一步探討FAK轉錄后的調控機制,為阻斷OLK癌變的過程提供一些新的研究思路或方向。

