一步法快速從脫脂豆粉中三相分離脂肪氧合酶
蔡燕,田丹,嚴鑫,李百裕,李宇杰,于麗娟,吳錦明*
1(南通大學 化學化工學院,江蘇 南通,226019)2(南通大學 生命科學學院,江蘇 南通,226019)3(南通職業大學 藥品與環境工程學院,江蘇 南通,226007)
脂肪氧合酶(lipoxygenases,LOXs)屬于結構相關的非血紅素鐵雙加氧酶家族,廣泛分布于動植物界。它能催化含一個或多個(1Z,4Z)-戊二烯結構的多不飽和脂肪酸(polyunsaturated fatty acid,PUFA),如亞油酸、花生四烯酸的氫發生過氧化反應,PUFA的氧化作用是形成具有多種生物功能的活性脂類的過程[1]。LOXs底物特異性廣泛,可利用性高,已在食品、紡織、造紙等眾多生物技術領域被商業化開發應用[2-6]。近年來,利用硫酸銨沉淀法、柱層析法、制備電泳法等傳統方法對不同來源的LOXs進行純化和表征的研究報道較多,然而這些分離技術大多成本高并且耗時長,很難規模化應用[4,7-9]。商品化的 LOXs主要通過大豆粉浸提后結合柱層析法獲得,價格較為昂貴。
三相分離技術(three phase partitioning,TPP)是近年發展起來的一種簡單、高效的非色譜技術,主要用于從粗原料或發酵液中分離和濃縮蛋白質。TPP法是指在粗提物中加入硫酸銨(鹽)和叔丁醇(有機溶劑),以使目的蛋白在界面相沉淀,而雜質主要分配在叔丁醇(頂相)和水相(底相)中[10]。這種技術因易于操作、可規模化和成本低而頗受關注。已有報道稱,TPP法是過氧化物酶[11-14]、蛋白酶[15-16]、黃瓜素[17]、多酚氧化酶[18-19]、血清肽酶[20]、漆酶[21]、過氧化氫酶[22]等多種酶的有效提取和純化技術,但尚未見應用TPP法一步純化大豆粉中LOXs的相關報道。
本文利用TPP技術建立了一種有效的純化LOXs的方法。所有的TPP實驗都是用脫脂豆粉中提取的粗LOXs酶液進行的,目的是利用TPP法從脫脂大豆粉中分離、濃縮LOXs并達到最大的純度和提取率。實驗中考察了硫酸銨飽和度、粗酶液與叔丁醇的比例、溫度和pH值等工藝參數對提取效率的影響。用十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分析法對得到的LOXs酶的純度進行了評價。
1 材料與方法
1.1 材料與試劑
大豆, 2019年產于黑龍江;亞油酸、十二烷基硫酸鈉(sodium dodecyl sulfate,SDS)、考馬斯亮藍G-250,Sigma公司;(NH4)2SO4、叔丁醇、吐溫-20、甲醇等,德國默克公司。
1.2 儀器與設備
LD4-2型離心機,北京醫用離心機廠;TU-1901型雙光束紫外-可見分光光度計,北京普析通用儀器有限公司;CG001機械干磨機,廣東德爾有限公司;PHS-3B精密PH計,上海雷磁儀器廠;Hitachi S-4800掃描電子顯微鏡,德國蔡司公司;XH-D快速混勻器,無錫市萊浦儀器設備有限公司。
1.3 實驗方法
1.3.1 脂氧酶粗提物的制備
用蒸餾水清洗大豆,于干凈的托盤中干燥。稱取約10 g大豆,物理去皮后,用石油醚脫脂直到溶劑不變色。然后將脫脂大豆粉碎成小塊,過50目篩網進行篩分。
用100 mL 0.1 mol/L磷酸鹽緩沖液(pH 7)將脫脂豆粉攪拌浸泡混合1 h后,4 000 r/min離心20 min,收集所得上清液用于進一步的TPP純化研究。
1.3.2 脂氧酶的三相分離
在設定的溫度下,渦流條件下用適量的(NH4)2SO4將LOXs粗提液飽和,注意盡量避免起泡。待(NH4)2SO4完全溶解后,逐滴加入適量的叔丁醇。然后將混合物徹底渦流混合,并靜置60 min。在4 000 r/min條件下低速離心10 min,實現3種不同相(上部有機相、中間界面沉淀相和底層水相)的完全相分離。收集含LOXs的中間界面蛋白沉淀,并溶解在2 mL 2 mol/L磷酸鹽緩沖溶液(pH 9.0)中,進一步分析蛋白質含量和酶活性,計算純化倍數和活性回收率。
以初加粗提液的活性為100%,分析了包括(NH4)2SO4飽和度(20%~70%)、LOXs粗提液樣品與叔丁醇的體積比(1∶1~1∶4)、溫度(0~40 ℃)和pH (5~10)在內的各工藝參數對LOXs分離效果的影響。
1.3.3 脂氧酶活性的測定
LOXs的活性測定是通過234 nm處吸光度的增加來監測的[23]。在恒溫25 ℃下,量取0.2 mL脂氧酶酶液加入至1.5 mL的底物亞油酸溶液中,靜置3 min后,加入5 mL無水乙醇使反應結束,然后加入5 mL的蒸餾水,充分搖勻后,在234 nm處測定反應液的吸光度。空白實驗是在酶液中先加5 mL無水乙醇滅活,再加1.5 mL底物溶液靜置3 min,最后加入5 mL的蒸餾水。脂氧合酶的一個單位被定義為在總體積為3 mL的情況下,1 min內在234 nm處產生0.001光密度的活性。
1.3.4 蛋白質的濃度測定
用Bradford法測定蛋白濃度[24],標準蛋白為牛血清白蛋白。
1.3.5 數據分析處理
所有實驗分2次進行,數據用平均值±標準差表示。比酶活力、純化倍數和活力回收率分別按公式(1)、(2)、(3)進行計算:

(1)

(2)

(3)
1.3.6 掃描電鏡
將粗酶液、三相分離法得到的中間沉淀相進行透析處理,真空冷凍干燥24 h,采用高分辨場發射掃描電鏡對蛋白沉淀的形貌和微觀結構進行觀測及分析。
1.3.7 SDS-PAGE凝膠電泳分析
對蛋白質樣品進行SDS-PAGE分析,按稍作修改的Laemmli方法進行[25]。電泳凝膠由5%的堆積凝膠和12%的分離凝膠組成,其電壓分別為160和200 V。電泳后,用考馬斯亮藍G-250在體積分數為45.4%甲醇和體積分數為9.2%乙酸的混合溶液中將樣品凝膠染色1 h,然后用體積分數為7.5%乙酸和體積分數為5%甲醇的混合溶液脫色3 h。所用分子質量為BioRad低分子質量標記 (低范圍SDS-PAGE標準)。
2 結果與分析
2.1 有機溶劑類型對脂氧酶分配的影響
有機溶劑不僅影響體系的極性和介電常數,而且影響三相的形成和分離。本文測定了正丁醇、異丙醇、叔丁醇、正戊醇和乙醇這5種有機溶劑對脂氧酶分配過程的影響。其他條件設定為:鹽飽和度(60%)、粗提液與有機溶劑的體積比(1∶2)、pH 7,20 ℃下靜置60 min。結果如圖1所示,與其他溶劑相比,叔丁醇更為有效,脂氧酶的純化倍數和活力回收率分別為7.2倍和68.8%,可能是因為叔丁醇可以通過與沉淀蛋白結合來增加浮力,從而使其漂浮在密度更高的水鹽層之上。
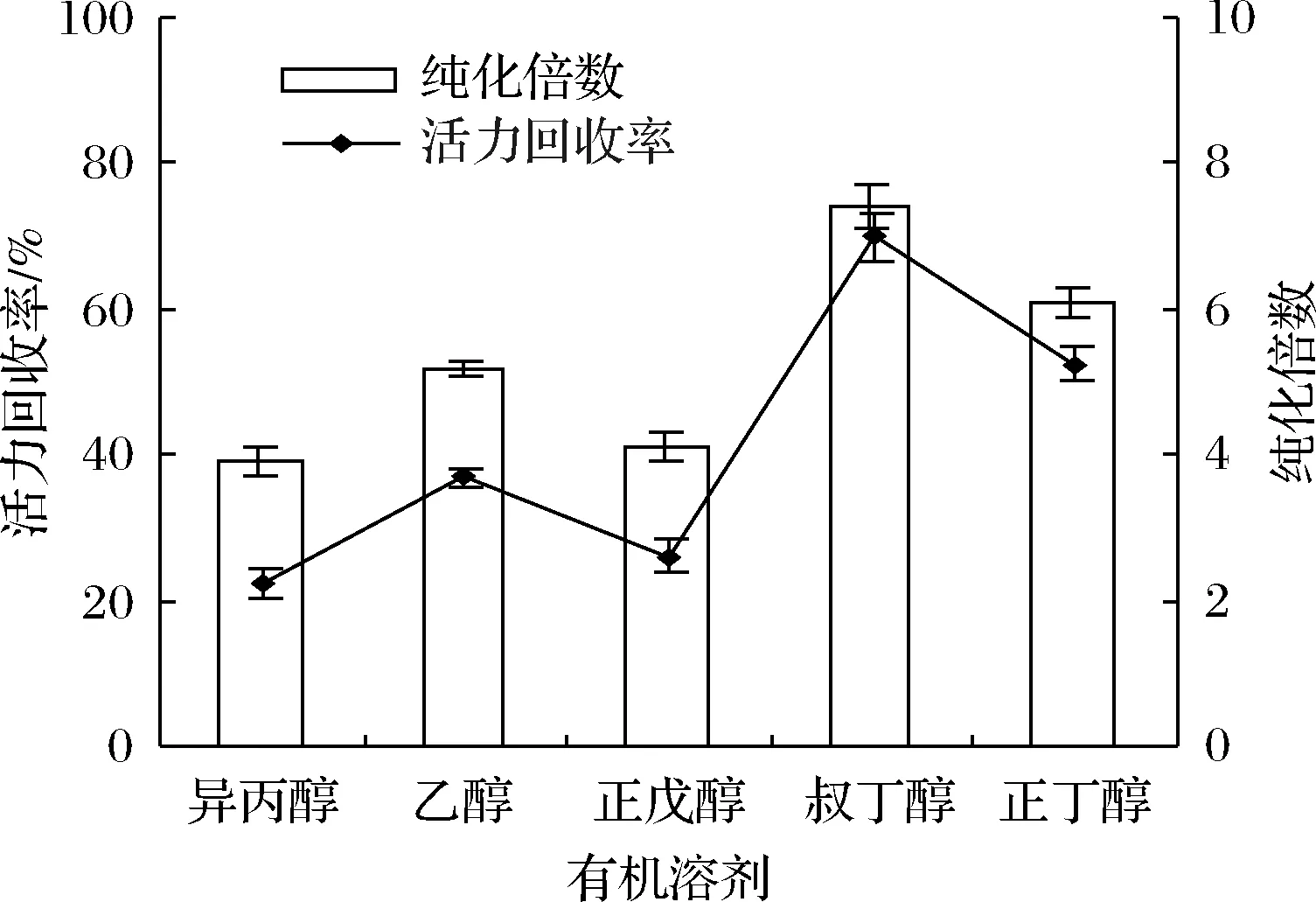
圖1 有機溶劑類型對脂氧酶純化倍數和活力回收率的影響Fig.1 Effect of organic solvent types on purification and activity recovery of LOXs
此外,由于其較高的分子質量,不能滲透到折疊的蛋白質三維結構中,因此不會引起分離酶的變性。在20~30 ℃下,還表現出明顯的滲透和擁擠效應,提高了LOX的分配效率。
2.2 (NH4)2SO4飽和度對脂氧酶分配的影響
(NH4)2SO4通過改變TPP過程中溶液的離子強度而起著重要作用。鹽分飽和度通過鹽析作用影響蛋白質的溶解度,是蛋白質沉淀的主要原因。將(NH4)2SO4加入到粗提液中,獲得20%~70%的最終飽和度,并在20 ℃、pH 7、粗提液與叔丁醇的體積比為1∶2的條件下優化60 min,以獲得界面沉淀中所需酶的最大量。如圖2所示,增加(NH4)2SO4飽和度可提高LOXs的回收率,在 (NH4)2SO4飽和度為60%時可獲得最大純度(7.13)和回收率(67.89%)。進一步增加(NH4)2SO4飽和度將減少LOXs選擇性分配到中間相中,這可能是由于LOXs酶的不可逆變性。根據這些結果,選擇60% (NH4)2SO4飽和度作為后續實驗的最佳條件。
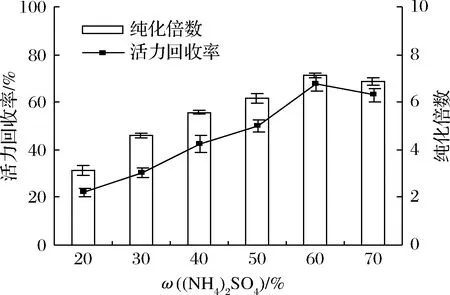
圖2 硫酸銨飽和度對脂氧酶純化倍數和活力回收率的影響Fig.2 Effect of (NH4)2SO4 saturation on purification fold and activity recovery of LOXs
2.3 粗酶液與叔丁醇比例對脂氧酶分配的影響
研究了粗酶液與叔丁醇的體積比在1∶1~1∶4范圍內對脂氧酶分配的影響,結果如圖3所示。在粗提液與叔丁醇的體積比為1∶2.5時,其他實驗參數設置為:(NH4)2SO4達60%飽和,pH 7、20 ℃下靜置60 min,LOXs的最大純化倍數和回收率分別達到7.95%和75.2%。當叔丁醇用量在1∶1~1∶2范圍時,其用量越少,則與(NH4)2SO4的協同作用越弱,萃取效率相應越低。相反,如果叔丁醇含量高于1∶2.5,LOXs蛋白的變性更頻繁,LOXs酶的純度和活力回收率降低。因此,選擇粗提物與叔丁醇的比例為1∶2.5,進一步考察其他因素對脂氧酶分配的影響。
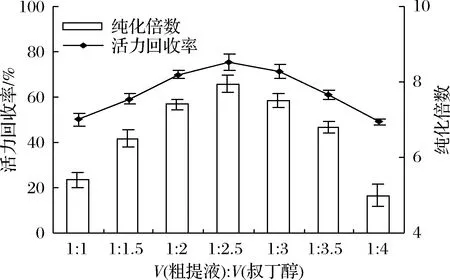
圖3 叔丁醇用量對脂氧酶純化倍數和活力回收率的影響Fig.3 Effect of broth to t-butanol ratios on purification fold and activity recovery of LOXs
2.4 溫度對脂氧酶分配的影響
溫度是TPP過程中的一個重要參數,影響著酶的結構和整體穩定性。在保持(NH4)2SO4飽和度60%、pH 7、粗提液與叔丁醇比例為1∶2.5、萃取時間為60 min等參數不變的情況下,通過在0~40 ℃范圍內改變水浴溫度來研究溫度對脂氧酶分配的影響。由圖4可知,在20 ℃下,酶的純度隨著溫度的升高而增加,這是因為溫度的升高降低了溶劑的粘度和密度,從而導致傳質強化,提高了提取率。在溫度高于20 ℃時萃取效率的降低可能是由于LOXs酶的熱失活。因此,為保持天然酶結構,后續的優化實驗在室溫20 ℃下進行。
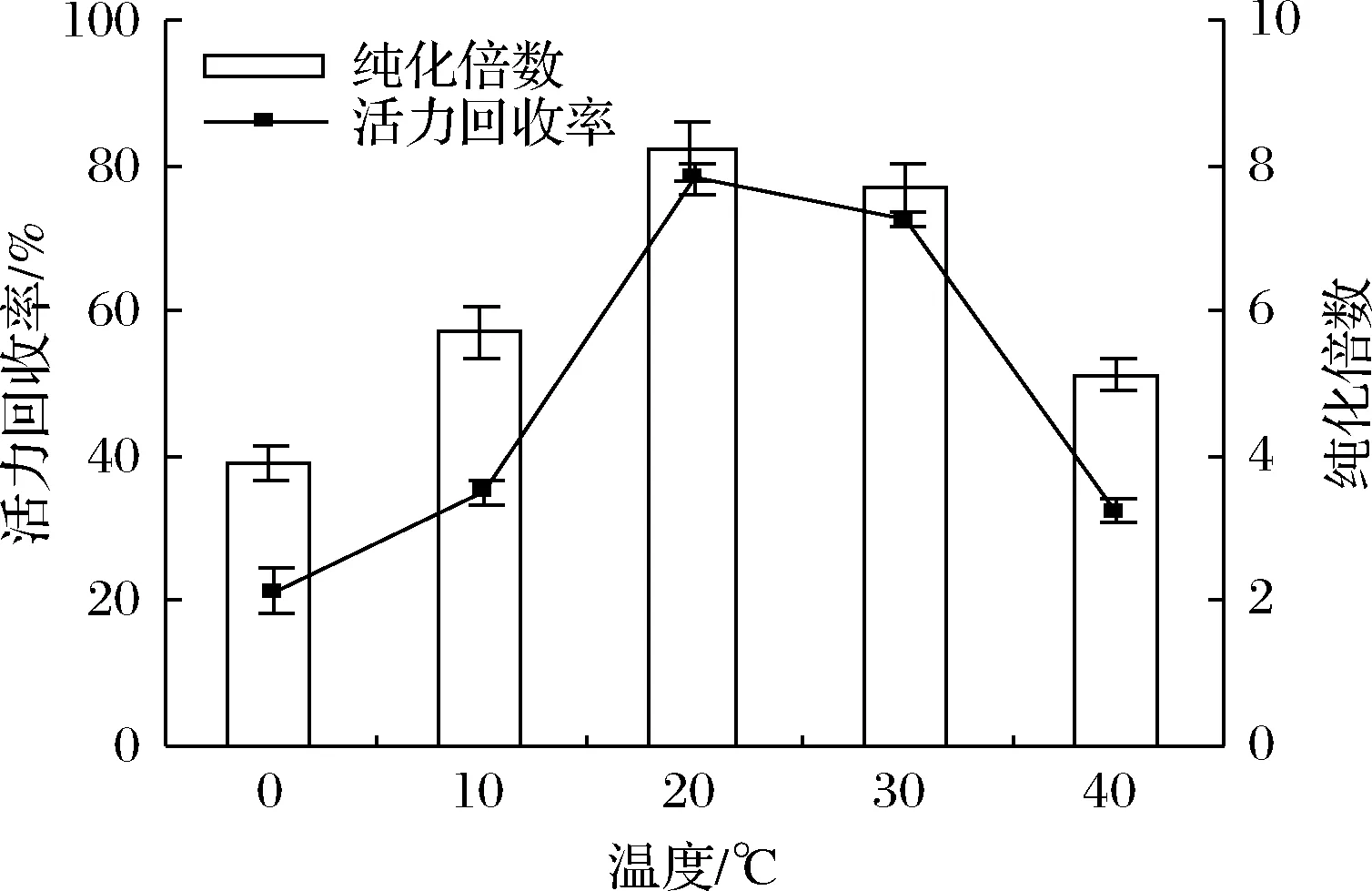
圖4 溫度對脂氧酶純化倍數和活力回收率的影響Fig.4 Effect of temperature on purification fold and activity recovery of LOXs
2.5 pH值對脂氧酶分配的影響
TPP過程中的另一個重要的影響因素是pH值,它能改變氨基酸的電離狀態。通過調節pH值,蛋白質的凈電荷會改變,體系中酶的分配效率也會受影響。在整個實驗過程中保持其他實驗條件不變:60%的(NH4)2SO4飽和度,粗酶液與叔丁醇的比例1∶2.5,在25 ℃下保持60 min,考察pH在5~10之間時LOX分配效率的變化,結果如圖5所示。隨著pH值從5增加到8,LOXs的純化倍數和活力回收率增加,這可解釋為LOXs在pH 8時對叔丁醇具有較好的構象穩定性。在酸性pH下LOXs的回收率較中性范圍低,這可能是因為酸性pH提供了更多的H+來競爭LOXs和叔丁醇之間的相互作用。TPP提純LOXs在pH 8條件下得到了最大純度(8.2)和活力回收率(78.2%)。
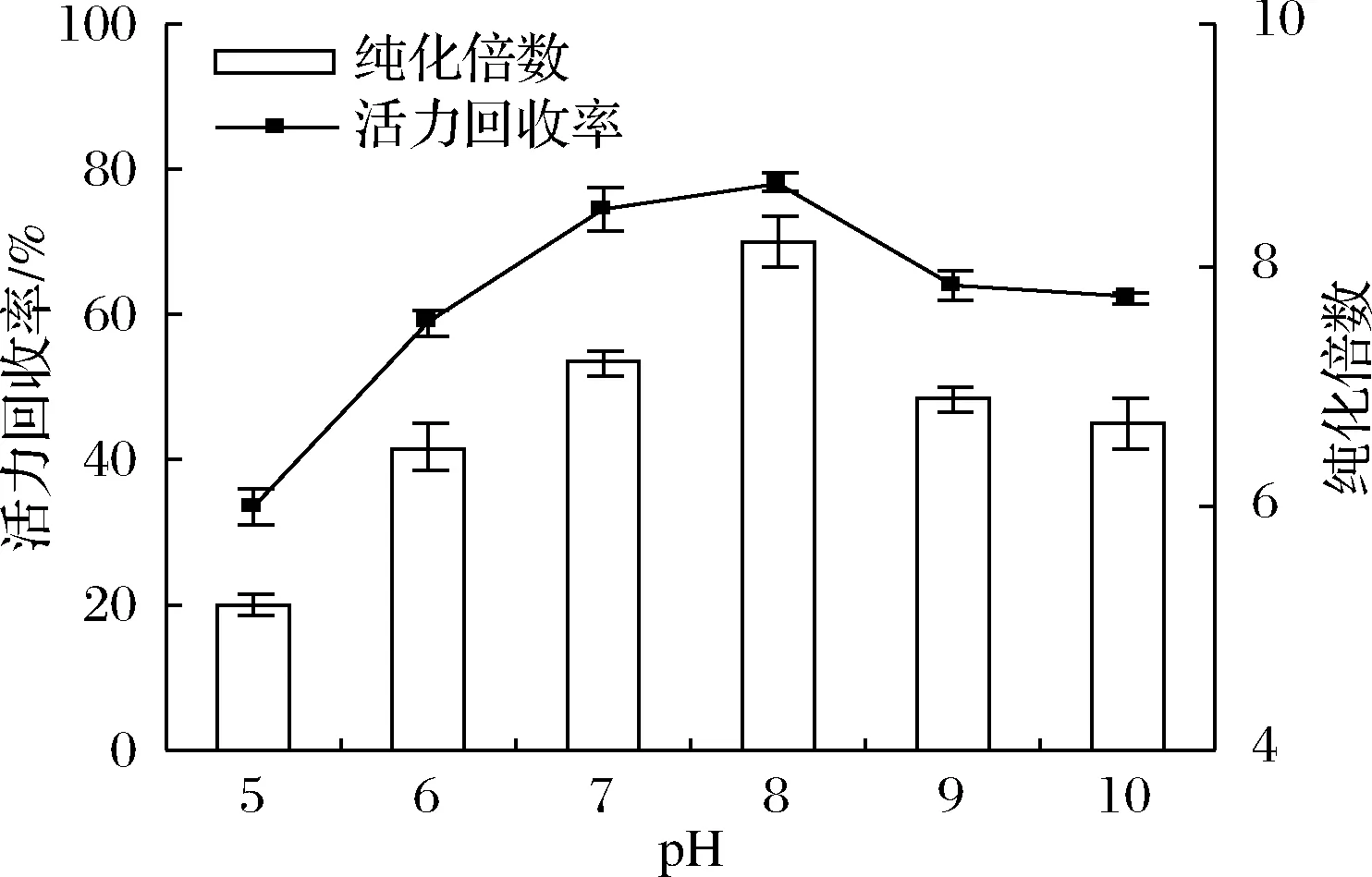
圖5 pH對脂氧酶純化倍數和活力回收率的影響Fig.5 Effect of pH on purification fold and activity recovery of LOXs
2.6 掃描電鏡
分別用水提取法和TPP法獲得的LOXs酶蛋白的SEM圖像如圖6所示。由圖6可知,2種方法得到的脂氧酶形貌完全不同。LOXs酶蛋白在粗提物中的微觀結構表現為聚集在一起的絮狀沉淀。TPP法制備的LOXs酶可能是由于(NH4)2SO4和叔丁醇的共同作用,受各種力的影響,形成較為明顯的光滑片狀結構,呈結晶狀沉淀。

a.粗提的脂氧酶;b.三相純化的脂氧酶圖6 粗提法和三相法所得脂氧酶的SEM圖Fig.6 SEM images of the interfacial precipitate and crude LOXs
2.7 SDS-PAGE分析
分別對粗提和TPP純化的LOXs酶進行SDS-PAGE分析,以估計該酶的分子質量,檢查其分離純度,結果如圖7所示。值得注意的是,TPP法得到的LOXs純度有較大提高。泳道2的酶帶較少,比泳道1清晰很多,表明LOXs酶得到了部分純化,分子質量約為97 kDa,與文獻報道的結果相當[7-8]。

1-粗提酶;2-三相純化的脂氧酶;3-商品脂氧酶;4-標準蛋白圖7 脂氧酶的SDS-PAGE電泳圖譜Fig.7 SDS-PAGE analysis of recovered and purified LOXs from soy flours
3 結論
在pH 8和25 ℃條件下,采用60%(NH4)2SO4飽和度、粗酶液與叔丁醇比例為1∶2.5的TPP體系從大豆粉中提取LOXs,活性回收率為78.2%,純化倍數為8.2倍,首次證明了TPP用于脫脂大豆粉部分純化LOXs的可行性。這種TPP技術在降低操作成本、簡化操作步驟等方面對獲得LOXs蛋白有一定的幫助。

