不同劑量阿曲庫銨對腦腫瘤切除術患者MEP、SEP 水平及不良反應的影響研究
杜治昆
(河南省南陽市中心醫院急診創傷外科 南陽473009)
臨床上神經外科手術較多,尤其是腦部腫瘤手術,該手術存在難度較大、操作復雜等問題,過度依賴操作者臨床經驗和醫療技術,若術中處置不得當,可發生醫源性損傷[1]。 神經電生理監測系統可為臨床操作者提供患者腦、神經實時狀況,定位腦功能區域,能有效避開患者重要神經結構,降低對神經功能損害,在神經外科治療中應用較廣泛。該系統監測指標包括運動誘發電位(Motor Evoked Potentials,MEP)、 體 感 誘 發 電 位(Somatosensory Evoked Potentials, SEP)。 有研究指出,給予患者肌松藥有助于術中神經電生理系統監測。 阿曲庫銨為臨床常用肌松藥,在外科手術中發揮著重要作用[2]。 有研究報道,肌松藥對SEP 減損作用較小,但可影響MEP 監測質量[3],而不同劑量肌松藥對腦腫瘤術患者MEP與SEP 影響不同。有研究顯示為減少手術過程中患者體動次數而加強麻醉深度,而加強麻醉深度并不影響患者術中體動發生次數,卻導致患者血流動力學發生改變,出現較多不良反應[4]。 因此尋找可維持適當肌松程度及麻醉深度, 減少對MEP 干擾和不良反應的藥物是目前臨床研究的重點。 本研究探討不同劑量阿曲庫銨對腦腫瘤切除術患者MEP、SEP及不良反應的影響。 現報道如下:
1 資料與方法
1.1 一般資料 選取我院2016 年6 月~2019 年6月收治的行腦腫瘤切除術患者125 例為研究對象,根據阿曲庫銨使用劑量不同分為小劑量組40 例、中劑量組43 例和大劑量組42 例。其中小劑量組男22例,女18 例;年齡20~64 歲,平均(42.65±22.45)歲;體質量指數(BMI)平均為(22.54±1.45)kg/m2;疾病類型:聽神經瘤20 例,顱動脈瘤6 例,腦干瘤4例,枕葉瘤4 例,額葉瘤2 例,頂葉瘤4 例。 中劑量組男22 例,女21 例;年齡19~65 歲,平均(42.54±23.51)歲;BMI 平均為(22.45±1.21)kg/m2;疾病類型:聽神經瘤21 例,顱動脈瘤8 例,腦干瘤6 例,枕葉瘤4 例,額葉瘤3 例,頂葉瘤1 例。大劑量組男22例,女20 例;年齡21~64 歲,平均(42.59±21.46)歲;BMI 平均為(22.51±1.45)kg/m2;疾病類型:聽神經瘤22 例,顱動脈瘤6 例,腦干瘤8 例,枕葉瘤2例,額葉瘤2 例,頂葉瘤2 例。 三組性別、BMI、年齡等一般資料無顯著性差異(P>0.05),具有可比性。本研究經醫院醫學倫理委員會批準。 納入標準:首次行腦腫瘤切除術者;本研究所用藥物過敏史者;美國麻醉醫師協會分級(ASA)≤Ⅲ級;無手術禁忌證者。 排除標準:存在先天運動、語言功能障礙者;伴重要臟器嚴重疾病者;近1 周內服用抗焦慮、抑郁、鎮靜藥物者;依從性較差者。
1.2 麻醉方法 囑咐全部患者手術前10 h 內禁飲禁食,手術前0.5 h 肌內注射硫酸阿托品注射液(國藥準字H46020463)0.5 mg。 進入手術室后,在麻醉作用下建立靜脈通道,三組患者均使用同種麻醉藥物完成誘導,且在誘導5 s 內由靜脈推入相應藥物。靜脈注射2 mg/kg 丙泊酚乳狀注射液(國藥準字H20010368),0.1 mg/kg 咪達唑侖注射液(國藥準字H20153019),4 μg/kg 枸櫞酸芬太尼注射液(國藥準字H20123298),等待患者安靜入眠后,采用JM2000型腦電雙頻監護儀(上海聚慕醫療器械有限公司)、DS-7100 型多參數監護儀(上海聚慕醫療器械有限公司) 監測呼吸(RR)、 心率(HR)、 血氧飽和度(SpO2)、腦電頻指數(BIS)、平均動脈壓(MAP)。 在麻醉下實施橈動脈穿刺術,并置管監測血壓,并將中心動脈開放。給予三組患者靜脈注射阿曲庫銨,劑量分別為小劑量組0.15 mg/kg, 中劑量組0.2 mg/kg,大劑量組0.25 mg/kg。 麻醉完成3 min 后行氣管插管,連接B5 型麻醉機(江蘇藍韻凱泰醫療設備有限公司),控制模式:潮氣10 ml/kg,35 mm Hg<呼吸末CO2分壓≤40 mm Hg。 三組麻醉維持:丙泊酚注射液5 mg/(kg·h)、注射用鹽酸瑞芬太尼(國藥準字H20123422)0.1 μg/(kg·min)靜脈持續泵入,間斷性30 min 內于靜脈輸注誘導劑量的25%阿曲庫銨。
1.3 監測方法 神經電生理監測方法:全部患者使用MEB-9400C 型神經電生理監護儀(上海光電醫用電子儀器有限公司) 于術中進行MEP 與SEP 監測。 MEP 監測,根據國際10/20 系統放置頭皮腦電圖電極,電極采用皮下針式電極,在手、足部腦皮質投射區放置陽性電極(刺激電極),即為10/20 系統C4、C3 位置;在腦部同側任意區放置陰性電極。 采用雙方波脈沖刺激方式,參數:濾波20~1 000 Hz,刺激間隔0.002 s,刺激持續0.001 s,最大電流16 mA,電壓強度100~400 V,引出MEP 為準,并記錄。若為單次刺激方式則無疊加記錄。SEP 監測,待腦顱與腦膜打開后,使用神經電生理監護儀,按照國際腦電學會10/20 系統,記錄、參考電極、地線均為皮下針形電極。在上、下肢刺激代表區C3'/C4'、Cz 區放置記錄電極;在前額Fpz 區放置參考電極;將地線置于任意肩部一側。表面電極為刺激電極,上肢刺激正中神經,下肢刺激脛神經,刺激強度20~50 mA,刺激頻率3 Hz, 濾波10~500 Hz。 麻醉后繼續動態性監測,波形疊加≥201 次前行二輪疊加,至術后停止。
1.4 觀察指標 記錄患者入室即刻(T0)、氣管插管時(T1)、肌松藥停用時(T2)、停肌松藥后0.5(T3)時HR、MAP、BIS、SpO2、RR 水平。 記錄所有患者術中使用丙泊酚劑量、血藥濃度(于給藥后4 min 抽靜脈血,使用高效液相熒光法測定,試劑盒購于北京奧維亞生物技術有限公司)。 記錄所有患者首次引發MEP 電流強度與使用肌松藥后首次引發MEP 等候時間,及停肌松藥即刻N20-P25 波幅、N20 潛伏期。記錄所有患者術中出現不良反應例數,包括呼吸抑制、心動過緩、心動過速、皮膚潮紅、低血壓。 不良反應發生率(%)=(呼吸抑制+心動過緩+心動過速+皮膚潮紅+低血壓)例數/總例數×100%。
1.5 統計學方法 本研究所有數據采用SPSS21.0統計學軟件分析。 多組間計量資料采用單因素方差分析;兩者間對比采用Snk-q 檢驗;組內多時間點的計量資料對比采用重復測量方差分析;計數資料對比采用卡方檢驗。以P<0.05 為差異有統計學意義。
2 結果
2.1 三組不同時間段生命體征比較 三組患者T0時HR、MAP、BIS、SpO2、RR 比較, 無顯著性差異(P>0.05)。 小劑量組T1~T3時刻BIS、RR 值較本組T0時刻顯著降低(P<0.05);但HR、MAP 無顯著性差異(P>0.05)。 中劑量組T1~T3時刻MAP、HR 較本組T0時刻顯著升高, 且均顯著高于小劑量組;T1~T3時刻BIS、RR 較本組T0時刻顯著降低, 且T2時刻BIS、RR 顯著高于小劑量組(P<0.05)。 大劑量組T1~T3時刻MAP、HR 較本組T0時刻顯著升高,且均顯著高于小劑量組,但低于中劑量組;T1~T3時刻BIS、RR 較本組T0時刻顯著降低, 且T2時刻BIS、RR 顯著低于小、中劑量組(P<0.05)。三組患者各時刻SPO2比較,差異無統計學意義(P>0.05)。見表1。
表1 三組不同時間段生命體征比較(±s)
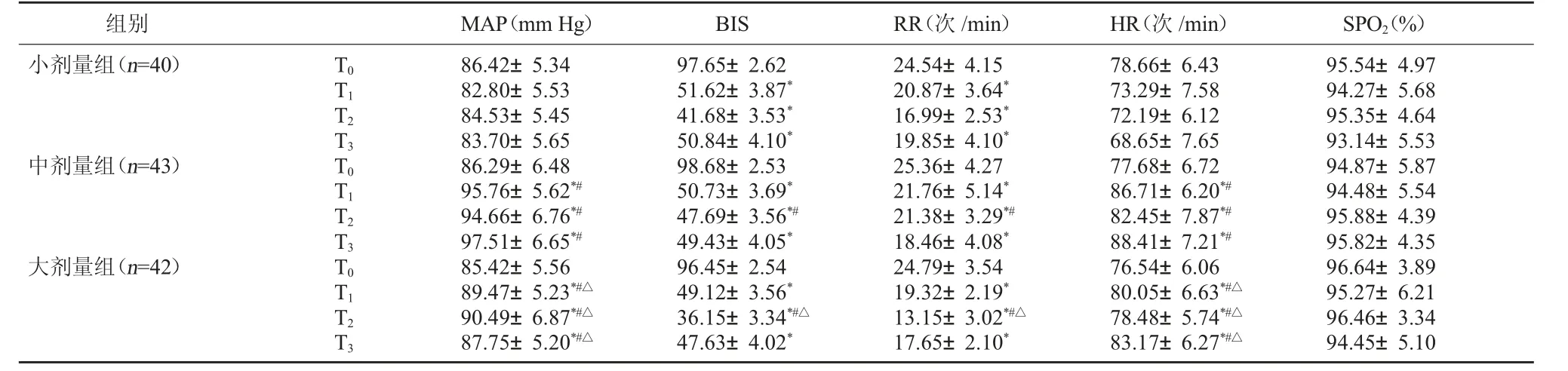
表1 三組不同時間段生命體征比較(±s)
注:與同組T0 時比較,*P<0.05;與小劑量組比較,#P<0.05;與中劑量組比較,△P<0.05。
組別 MAP(mm Hg) BIS RR(次/min) HR(次/min) SPO2(%)小劑量組(n=40)T0 T1 T2 T3中劑量組(n=43)T0 T1 T2 T3大劑量組(n=42)T0 T1 T2 T3 86.42±5.34 82.80±5.53 84.53±5.45 83.70±5.65 86.29±6.48 95.76±5.62*#94.66±6.76*#97.51±6.65*#85.42±5.56 89.47±5.23*#△90.49±6.87*#△87.75±5.20*#△97.65±2.62 51.62±3.87*41.68±3.53*50.84±4.10*98.68±2.53 50.73±3.69*47.69±3.56*#49.43±4.05*96.45±2.54 49.12±3.56*36.15±3.34*#△47.63±4.02*24.54±4.15 20.87±3.64*16.99±2.53*19.85±4.10*25.36±4.27 21.76±5.14*21.38±3.29*#18.46±4.08*24.79±3.54 19.32±2.19*13.15±3.02*#△17.65±2.10*78.66±6.43 73.29±7.58 72.19±6.12 68.65±7.65 77.68±6.72 86.71±6.20*#82.45±7.87*#88.41±7.21*#76.54±6.06 80.05±6.63*#△78.48±5.74*#△83.17±6.27*#△95.54±4.97 94.27±5.68 95.35±4.64 93.14±5.53 94.87±5.87 94.48±5.54 95.88±4.39 95.82±4.35 96.64±3.89 95.27±6.21 96.46±3.34 94.45±5.10
2.2 三組丙泊酚使用劑量與血藥濃度比較 大劑量組丙泊酚使用劑量、血清血藥濃度均高于中、小劑量組(P<0.05)。 見表2。
表2 三組丙泊酚使用劑量與血藥濃度比較(±s)
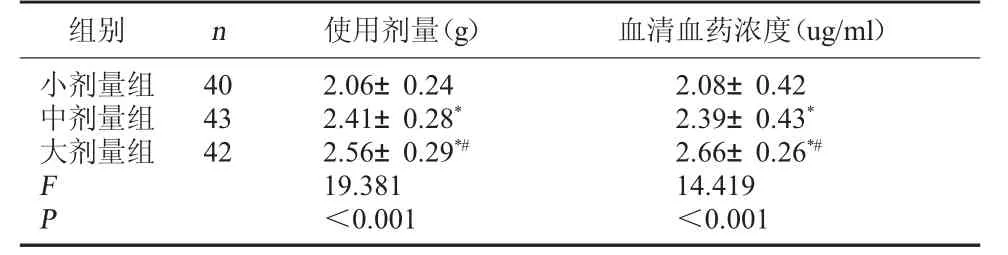
表2 三組丙泊酚使用劑量與血藥濃度比較(±s)
注:與小劑量組比較,*P<0.05;與中劑量組比較,#P<0.05。
組別 n 使用劑量(g) 血清血藥濃度(ug/ml)小劑量組中劑量組大劑量組F P 40 43 42 2.06±0.24 2.08±0.42 2.41±0.28*2.39±0.43*2.56±0.29*#2.66±0.26*#19.381 14.419<0.001<0.001
2.3 三組電生理指標比較 三組T3時N20-P25 波幅、N20 潛伏期比較,無顯著差異(P>0.05);大劑量組引起MEP 留滯時間、引起MEP 電流強度均高于中、小劑量組(P<0.05)。 見表3。
表3 三組電生理指標比較(±s)
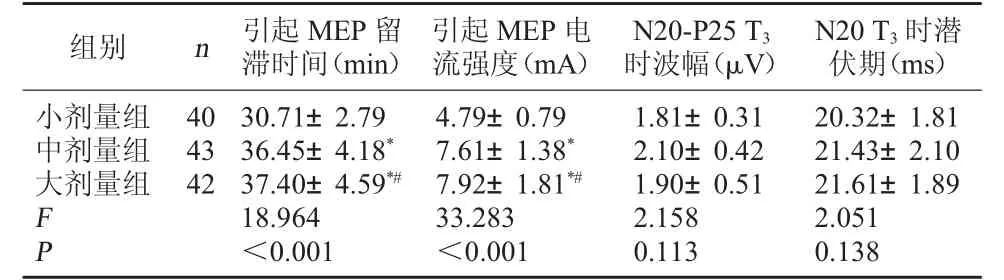
表3 三組電生理指標比較(±s)
注:與小劑量組比較,*P<0.05;與中劑量組比較,#P<0.05。
組別 n 引起MEP 留滯時間(min)引起MEP 電流強度(mA)N20-P25 T3時波幅(μV)N20 T3 時潛伏期(ms)小劑量組中劑量組大劑量組40 43 42 F P 30.71±2.79 36.45±4.18*37.40±4.59*#18.964<0.001 4.79±0.79 7.61±1.38*7.92±1.81*#33.283<0.001 1.81±0.31 2.10±0.42 1.90±0.51 2.158 0.113 20.32±1.81 21.43±2.10 21.61±1.89 2.051 0.138
2.4 三組術中不良反應發生情況比較 小劑量組不良反應發生率顯著低于中、大劑量組(P<0.05)。見表4。

表4 三組術中不良反應發生情況比較[例(%)]
3 討論
腦腫瘤切除術難度較高,且術中易引發顱內病灶神經損害,致患者術后機體功能出現障礙。 因此,對術中操作區周圍組織進行監測尤為重要。 隨著醫療技術的發展, 神經電生理監測逐漸在神經外科治療中得到應用,可起到避開重要神經作用,防止神經損傷[5]。神經系統可通過電生理活動傳遞信息。有研究指出, 術中給予患者肌松藥有助于進行神經電生理監測[6]。 有文獻報道,不同劑量阿曲庫銨對術中患者神經電生理監測結果影響不同。 神經電生理監測包括SEP、MEP[7]。其中SEP 是通過刺激肢體末端處的粗感覺纖維,于機體感覺上行通路記錄不同部位電位。 MEP 是指通過刺激運動皮質對側靶肌,獲得肌肉運動復合電位。 本研究通過對腦腫瘤切除患者術中給予不同劑量阿曲庫銨麻醉誘導行MEP 與SEP 監測,分析不同劑量阿曲庫銨對患者術中MEP與SEP 監測結果的影響, 探尋行MEP 與SEP 監測的最佳劑量。
SEP 檢查可反映周圍神經、腦干、相關神經核、丘腦等區域的功能,可早期提示神經根、脊柱損傷。有研究指出,行神經生理監測時,過程中受生物、物理與電學等多因素影響,可能致使結果為假性。 有學者認為,假性結果發生主要受麻醉藥物的影響[8]。其原因為術中麻醉藥物藥理作用導致SEP 波下降,潛伏時間延長,同時導致神經傳導傳遞力出現下降。有研究指出,肌松藥物可除去干擾顱肌電的信號,使其信噪比明顯增加,有助于SEP 監測完成。 MEP 可檢查機體所有運動神經的信號傳遞、傳導整體性與完整性。 有研究指出,MEP 監測穩定性、清晰性、重復性明顯高于SEP,且可記錄單次、雙向刺激,為真實實時監測[9]。 當充分麻醉時,使其電反應抑制,導致單脈刺激MEP 波形消失。有文獻指出,MEP 與肌松藥呈相關性,MEP 波形依賴肌松藥劑量, 若肌松藥充分時引起MEP 誘導失敗, 若術中不使用肌松藥可增加術中體動風險[10]。為此,兩者聯合監測時應選擇適宜劑量肌松藥,防止應用強力麻醉藥物,提高手術療效。 術中氣管插管可引發機體應激反應出現心率加快、血壓上升等。 有學者認為,小劑量阿曲庫銨應用于氣管插管時可有效、快速發揮藥物作用[11]。而逐漸增加阿曲庫銨使用劑量,可縮短神經阻滯起效時間,使不良反應發生率升高[12]。 本研究結果顯示,小劑量阿曲庫銨誘導可有效減少手術應激反應,提示用0.15 mg/kg 阿曲庫銨能減少術中應激反應發生率,維持患者術中血流動力穩定[13]。小劑量組患者術中應用丙泊酚劑量、血藥濃度,引起MEP 留滯時間、 引起MEP 電流強度均低于中、 大劑量組患者。 說明小劑量阿曲庫銨可減少丙泊酚使用量,改善MEP 與SEP 監測相關指標,肌松藥劑量增加,顯著抑制MEP 監測[14]。本研究為進一步探討不同劑量阿曲庫銨對患者術中的安全性,分別記錄所有患者術中發生不良反應情況,結果小劑量組患者術中發生不良反應率低于中、大劑量組,提示小劑量阿曲庫銨不良反應發生率低,具有較高安全性[15]。
綜上所述, 小劑量阿曲庫銨可減少對腦腫瘤切除術患者MEP、SEP 的影響與丙泊酚使用劑量,減少術中不良反應發生情況。

