老年營養風險評估預測急性失代償性心力衰竭患者全因死亡
尹巧香,張偉,張藍寧,靳英,段景琪,曹艷杰
[空軍特色醫學中心(原空軍總醫院)老年醫學科,北京 100142]
營養不良在老年心力衰竭患者中很常見,與心力衰竭不良預后密切相關[1-2]。20%~42%的心力衰竭患者存在營養不良[2-3]。心力衰竭患者由于腸道水腫和腸壁通透性增加,食物吸收障礙而導致營養不良;另一方面,很多心力衰竭患者伴有厭食、能量消耗增加和合成代謝障礙等進一步加重了營養不良。而營養不良又會導致肌肉減少癥、衰弱[4],形成身體功能下降的惡性循環[4-5]。因此,營養不良的評估是心力衰竭治療的重要組成部分。臨床實踐中要求營養評估應該是實用的,無創的,不需要使用設備的,適用于床邊,容易執行的。老年營養風險指數(GNRI)是簡單和完善的營養評估工具,適用于老年心力衰竭患者。最近的研究表明,GNRI能預測射血分數保留的心力衰竭全因死亡和再住院率[4-5]。然而,GNRI 對老年急性失代償性心力衰竭(ADHF)患者的預測價值尚不清楚。本研究的目的是探索一個臨床可行的結合營養狀況的簡易綜合指標老年營養風險指數預測老年ADHF患者的長期預后。
1 對象與方法
1.1 研究對象 回顧性對照研究2013年6月至2018年6月在我院連續入院的年齡在65歲以上老年ADHF住院患者的病歷資料。根據歐洲心臟病協會和中國指南,急性失代償性心力衰竭被定義為充血和(或)周圍灌注不足的臨床癥狀/體征迅速發作或惡化[6-7]。排除急性冠脈綜合征、晚期惡性腫瘤、肝硬化患者;排除了無法計算老年營養風險指數或醫療記錄數據不全的患者。
1.2 研究方法 根據病歷對患者心房顫動、高血壓等共病進行評估。在入院時進行標準實驗室檢查,出院時檢查超聲心動圖,獲取左室射血分數。使用日本腎臟病學會提出的公式計算腎小球濾過率(eGFR)如下:eGFR(mL·min·1.73m-2)=194×尿肌酐(Cr)-1.094×年齡-0.287×0.73(如果是女性)。腎功能不全(CKD)3-5期定義為eGFR小于60 mL·min·1.73 m-2。觀察時間2年。觀察終點為出院后2年內全因死亡率和因心力衰竭再住院率。
在入院和出院時評估老年ADHF患者的營養狀況。通過計算老年營養風險指數GNRI評估。GNRI計算公式為:14.89×血清白蛋白(g/dL)+41.7[體質量(kg)/身高(m)2]/22;或者14.89×血清白蛋白(g/dL)+41.7體質指數(BMI)/22。GNRI≥98分為正常,92分≤GNRI<98分為輕度營養不良,82分≤GNRI<92分為中度營養不良,GNRI<82分為重度營養不良[2,8]。本研究中,分為GNRI<92組(營養不良組)和GNRI≥92組(對照組)。
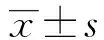
2 結果
2.1 一般臨床資料 共納入193例患者,年齡(81±9)歲。入院時GNRI平均值為(89±10)分,92例(47.67%)的患者GNRI評分小于92分,意味著將近一半的老年ADHF患者入院時營養不良。其中,29例(15%)GNRI評分小于82分,評估為重度營養不良,屬于心臟惡病質狀態。與GNRI≥92分組比較,GNRI<92分組BMI顯著降低(P<0.01);兩組共患疾病心房顫動、高血壓、糖尿病、腎功能不全、陳舊性心肌梗死差異無統計學意義(P>0.05);實驗室檢驗結果,與GNRII≥92分組比較,GNRI<92組B型鈉尿肽(BNP)顯著降低(P<0.01);血紅蛋白顯著降低(P<0.01);C反應蛋白、血白蛋白降低(P<0.05)。兩組血肌酐、腎小球濾過率(eGFR)差異無統計學意義。左室射血分數、藥物治療方面均差異無統計學意義。見表1。

表1 193例老年急性心力衰竭患者一般臨床特征
2.2 老年營養風險指數(GNRI) 與全因死亡的Kaplan-Meier生存分析 納入的193例患者,22例在住院期間死亡。隨后平均隨訪2.2年(中位隨訪時間1.2~3.6年),隨訪期間47例死亡,共有69例全因死亡,死亡率35.75%。因心血管病死亡42例(60.87%),其中心力衰竭28例(40.58%)、心肌梗死7例(10.15%)、猝死6例(8.70%)、主動脈夾層破裂1例(1.45%);非心血管病死亡27例(39.13%),其中,肺部感染14例(20.29%),惡性腫瘤10例(14.49%),消化道大出血及腦出血3例(4.35%);發生心力衰竭再住院108例(55.96%),意味著多半數的老年心力衰竭患者需要反復再住院。Kaplan-Meier生存分析顯示(圖1),GNRI<92組患者全因死亡率顯著高于GNRI≥92組(HR=2.667,95%CI:1.527~4.651,P<0.001);心血管疾病全因死亡率顯著增高(HR=2.469;95%CI:1.248~4.902,P<0.001)。

注:GNRI為老年營養風險指數
2.3 全因死亡率的單因素和多因素Cox比例風險回歸分析 單因素分析顯示,年齡、既往因心力衰竭住院病史、冠狀動脈疾病、GNRI、BNP、C反應蛋白、血紅蛋白、血鈉、血肌酐、eGFR等因素均差異有統計意義(P<0.01);以逐步回歸與正向選擇的方式,將這些所有與死亡率相關的單變量(P<0.10)納入模型; 年齡和性別被強制納入模型,以調整年齡和性別的影響。排除用于GNRI計算的BMI和血清白蛋白水平。多因素分析顯示,低GNRI(HR=0.947,95%CI:0.920~0.975,P<0.001)、年齡(HR=1.064,95%CI:1.026~1.012,P<0.001)是全因死亡的強獨立預測因子;既往因心力衰竭住院病史、BNP、C反應蛋白、血肌酐也是全因死亡率的獨立預測因子(P<0.05)。見表2。

表2 全因死亡率的Cox多因素風險回歸分析
3 討論
本項研究結果表明:老年急性失代償性心力衰竭(ADHF)患者經常出現營養不良;低GNRI與ADHF患者死亡率增加顯著相關。這些結果表明,GNRI對預測ADHF住院患者的分層發病率和死亡率是一個有用的指標。本研究證實了用GNRI對ADHF患者進行營養風險評估的臨床意義。
營養不良被認為是心力衰竭患者預后不佳的最關鍵的決定因素之一。有研究表明,在入院時使用GNRI評估的營養不良是急性心力衰竭患者長期死亡的獨立預測因素[9]。這一發現支持了本研究的結論,即低GNRI是ADHF住院患者全因死亡發生的重要預測因子。本項研究中,將近一半的ADHF患者入院時合并營養不良,其中15%的患者重度營養不良,基本等同于心臟惡病質狀態。這個比例與早期的研究報告相似[10]。營養與飲食學會、美國腸外營養學會和歐洲臨床營養與代謝學會建議,營養不良的診斷不應僅僅基于生化數據,因為炎癥被認為是血清白蛋白減少的主要原因[10-11]。研究認為,實驗室檢測急性期白蛋白水平作為營養不良指標有其局限性,需要建立一個綜合的能全面反映老年營養不良狀況的評估工具。GNRI代表了這種趨勢,臨床容易獲得而且簡單易行。對于老年急性失代償性心力衰竭患者,較低的GNRI得分可能不僅僅代表營養不良。事實上,在本項研究中,C反應蛋白在GNRI<92組中更高。心力衰竭時營養不良往往意味著心臟惡病質。心臟惡病質的機制是多因素的,包括神經激素紊亂,促炎細胞因子的過度表達,氧化應激反應增加,以及合成代謝和分解代謝狀態之間的失衡。心臟惡病質診斷標準包括C反應蛋白升高和血紅蛋白的下降[11]。本項研究中,在GNRI評分<92分組中發現了炎癥和貧血普遍存在。心臟惡病質表現為肌肉萎縮、炎癥、胰島素抵抗,厭食等等,很顯然,營養干預可以改善臨床結果減少再住院和醫療成本,特別是針對老年ADHF患者。一些小型研究表明,營養補充對心臟代謝有好處,從而改善心臟功能和運動能力。然而,常規的營養支持無法完全扭轉持續的肌肉萎縮,因此,可能有必要采用綜合干預,包括營養補充、肌肉合成代謝治療、抗炎或抗氧化的藥物以及適當的體育鍛煉。
本研究發現,老年急性失代償性心力衰竭患者營養不良,還與心力衰竭再住院相關。這與另一項研究的發現相似[12]。有幾個因素可以解釋這些發現。例如,本研究中營養不良的患者被勸導多進食而可能沒有遵守限制鹽和水的規定。另外,貧血和低蛋白血癥常常導致水鈉潴留,這些是慢性心力衰竭患者再次住院的常見原因。
GNRI評分指標臨床容易獲得,簡單易行,因此,老年營養風險評估(GNRI評分)對心力衰竭的風險分層和臨床管理具有實際指導意義。其臨床意義在于,住院的心力衰竭患者入院時經過老年營養風險評估(GNRI評分),如果GNRI評分較低,表明全因死亡率和再住院風險增加,可能需要更密切的隨訪和更積極的營養干預。
本項研究有局限性。首先,這是一個單中心研究,樣本量有限。第二,本組的研究人群僅包括有心力衰竭的老年患者。因此,需要進一步的研究來確定結果是否可以推廣到更年輕的人群。第三,該項研究男性比例接近80%,本研究沒有檢查性別差異,這可能對預后有影響。第四,本研究為回顧性觀察性研究,偏倚不可避免。

