竹節參的化學成分、藥理作用及質量標志物(Q-Marker)預測分析
周 靜,付先蕓,蔡三金,袁 丁,梅志剛,馮知濤*
竹節參的化學成分、藥理作用及質量標志物(Q-Marker)預測分析
周 靜1,付先蕓1,蔡三金1,袁 丁1,梅志剛2*,馮知濤1*
1. 三峽大學醫學院,國家中醫藥管理局中藥藥理科研三級實驗室,湖北 宜昌 443002 2. 湖南中醫藥大學 中西醫結合心腦疾病防治湖南省重點實驗室,湖南 長沙 410208
竹節參為五加科人參屬植物,在我國主要分布于湖北、云南、貴州及四川等地,以湖北恩施分布最為豐富。因其既具有人參的補益作用又具三七的活血作用,常被作為民族藥用于治療跌打損傷、關節炎以及虛勞等氣虛血瘀證。竹節參主要化學成分為皂苷類、糖類、氨基酸類、揮發油類、核苷類及無機鹽類。研究顯示,竹節參具有抗疲勞、保肝、鎮靜、保護心腦血管、免疫調節、抗腫瘤、抗衰老及抗炎等藥理作用。對國內外關于竹節參的化學成分、藥理作用的研究進展進行綜述,并對其質量標志物(quality marker,Q-Marker)進行預測分析,越南參皂苷R1、越南參皂苷R2、竹節參皂苷Ⅳa和竹節參皂苷Ⅴ等化合物可作為竹節參的主要Q-Marker,為竹節參質量評價體系的建立提供依據和相關新藥研發提供參考。
竹節參;質量標志物;越南參皂苷R1;越南參皂苷R2;竹節參皂苷Ⅳa;竹節參皂苷Ⅴ;竹節參多糖;竹節參總皂苷;心腦血管系統調節;免疫調節;抗炎
竹節參C. A. Mey.是五加科人參屬多年生草本植物,其藥用部位為干燥根莖,其味甘、微苦,性溫,具有散瘀止血、消腫止痛、祛痰止咳、補虛強壯之功,兼具人參益氣補虛與三七的散瘀止血之功,臨床常用于治療氣虛血瘀之跌打損傷、風濕性關節炎、咳嗽痰多、病后虛勞等[1]。研究表明,竹節參主要化學成分為皂苷類、糖類、氨基酸類、揮發油類、核苷類及無機鹽類等,具有抗潰瘍、保肝、促進胃腸蠕動、鎮靜、抗驚厥、抗疲勞、調血脂、改善神經網絡功能、保護心腦血管、免疫調節、鎮痛、抗炎、抗腫瘤、抗衰老等作用。眾所周知,中藥的品種產地、采收貯藏及炮制加工等因素均會影響竹節參的化學成分構成以及藥理藥效的發揮,故建立一套完整的竹節參質量標志物(quality marker,Q-Marker)體系,有助于提升竹節參中藥及產品質量,增強臨床療效,促進竹節參產業健康穩定發展。本文對竹節參的化學成分及其藥理作用進行綜述,并根據Q-Marker概念,從親緣學及化學成分特有性、傳統藥效、傳統藥性、化學成分可預測性、不同加工方法的影響等諸方面對竹節參的Q-Marker進行預測分析,為竹節參的質量評價和相關產品研發提供科學依據。
1 化學成分
竹節參的用藥部位主要為根莖,目前研究表明竹節參的化學成分主要分為6大類,包含皂苷類、糖類、氨基酸類、揮發油類、核苷類及無機鹽類等[2-4]。
1.1 皂苷類
竹節參中含有豐富的皂苷類化合物。竹節參皂苷包含三萜皂苷和甾醇型皂苷,其中的三萜皂苷很大程度上決定了竹節參的藥理活性。三萜皂苷分為齊墩果烷型、達瑪烷型和奧寇梯隆型,迄今已有111個三萜皂苷類成分從竹節參中提取分離[5]。
1.1.1 齊墩果烷型三萜皂苷 齊墩果烷型是竹節參皂苷中含量最多的成分,質量分數約為90.5%,是竹節參的主要有效成分之一,皆屬于五環三萜類皂苷[4]。其中竹節參皂苷Ⅳa、Ⅴ的含量最高[6-7]。部分齊墩果烷型三萜皂苷的化學結構見圖1。
1.1.2 達瑪烷型三萜皂苷 竹節參中所含四環三萜型皂苷以達瑪烷型皂苷研究較多,且較深入[2,5]。達瑪烷型皂苷根據C-6位基團的不同可分為原人參二醇型和原人參三醇型。20()-原人參二醇型包含竹節參皂苷Ⅰa、Ⅲ、Ⅵ、Ⅶ、FK6,人參皂苷Rb1、Rb3、Rc、Rd,三七皂苷Fe和七葉膽皂苷ⅩⅦ;20()-原人參三醇型包含人參皂苷Re、Rg1、Rg2、Rh1,三七皂苷R1、R2。部分達瑪烷型三萜皂苷的化學結構見圖2。
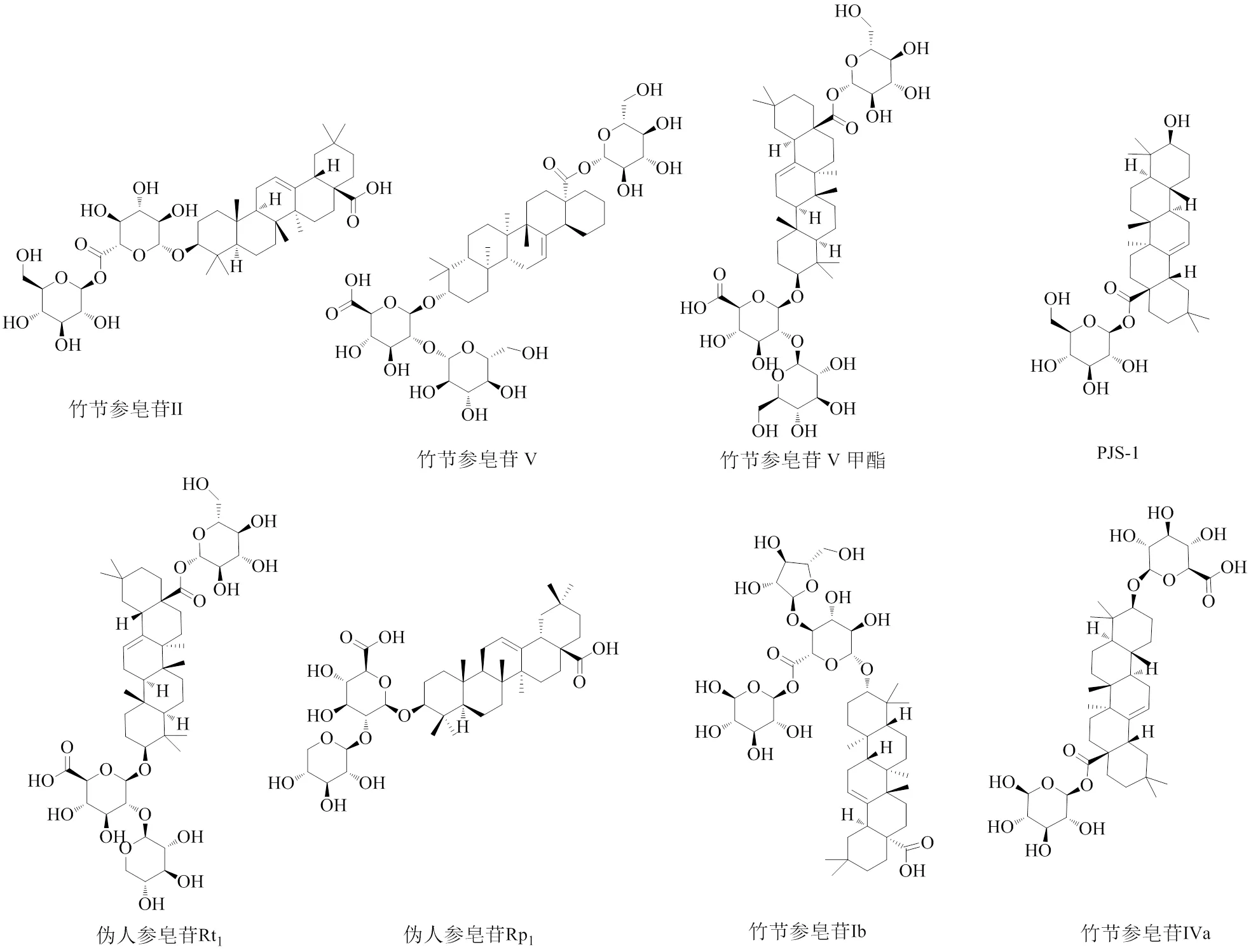
圖1 竹節參中齊墩果烷型三萜皂苷的化學結構
1.1.3 奧寇梯隆型三萜皂苷 竹節參中奧寇梯隆型三萜皂苷質量分數為1.8%[8],偽人參皂苷F11是此型皂苷中最具有代表性的皂苷成分。部分奧寇梯隆型三萜皂苷的化學結構見圖3。

圖3 竹節參中奧寇梯隆型三萜皂苷的化學結構
1.2 糖類
竹節參總糖量約為41.51%,包含了多糖(18.33%)、低聚糖(19.98%)及還原糖(3.2%)[9]。通過蒽酮硫酸法和苯酚硫酸法來測定湖北恩施產竹節參中的竹節參多糖(polysaccharides of,PSPJ)的質量分數分別為14.18%、10.89%[10]。
1.3 氨基酸類
研究表明,竹節參含有16種氨基酸[11],質量分數為13.704%。這16種氨基酸均在人參屬的4種植物中均能檢測到,相比人參、三七和西洋參,竹節參中含量是最高的。在這些氨基酸中,竹節參的人體必需氨基酸質量分數為4.777%,也在這4種人參屬中藥中含量最高,為總氨基酸的34.89%。此外,竹節參所含的酸性及中性氨基酸也較其他3種藥物高。
1.4 揮發油類
竹節參中揮發油質量分數約為0.016%[2]。通過對貴州竹節參與湖北竹節參精油的共同成分進行鑒定與檢測,質量分數最高的是湖北竹節參中的正己酸(13.92%),而不同成分中,質量分數最高的為黔竹節參中的3-甲基丁酸(9.56%)。
1.5 核苷類
竹節參中尿嘧啶、胸嘧啶、尿苷、鳥苷、胸苷、腺苷、肌苷和胞苷8種核苷類物質已被分離出來。伍紅年等[12]使用HPLC法對竹節參中的核苷成分進行了測定,發現7種核苷(脫氧尿苷、肌苷、鳥苷、尿苷、次黃嘌呤、腺苷和胸腺嘧啶核苷)成分,且在各自測定的濃度范圍內線性關系良好,其對評價竹節參的質量具有參考意義。
1.6 無機鹽類
竹節參中檢測到15種無機元素,其中含有6種人體必須微量元素(鋅、銅、鐵、錳、釩、鎳),其質量分數為0.309 74 mg/g;3種人體必須宏量元素(鈣、鎂、磷),其質量分數為16.185 7 mg/g[13]。
2 藥理作用
2.1 抗疲勞作用
竹節參中起抗疲勞作用的化學物質主要為PSPJ與竹節參總皂苷(total saponins of,TSPJ)。TSPJ與PSPJ均能顯著延長小鼠游泳時間,其機制可能為TSPJ與PSPJ能減少運動后血清中的血乳酸及尿素氮含量,提高小鼠體內的肝糖元含量[14-15]。
2.2 對消化系統的作用
2.2.1 修復潰瘍及胃黏膜保護作用 TSPJ對葡聚糖硫酸鈉誘導的潰瘍性結腸炎起到修復與保護的作用,其機制可能與提高過氧化物酶增殖物激活受體-γ的表達,降低促炎因子白細胞介素(interleukin,IL)- 1β、IL-17、γ干擾素(interferon-γ,IFN-γ)的釋放,提升IL-10水平有關[16]。TSPJ中已明確的能夠修復小鼠潰瘍、保護胃黏膜的物質為竹節參皂苷Ⅲ、齊墩果酸寡糖苷[17]。
2.2.2 保肝作用 腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)、IL-1β、IL-6等炎癥介質的產生促進了酒精性肝損傷的發展,竹節參能降低小鼠血清IL-1β、IL-6水平從而抑制酒精性肝損傷的進展[18]。TSPJ可能通過微小核糖核酸miR-199-5p/肝細胞生長因子及其受體細胞間質上皮轉換因子(hepatocyte growth factor-cellular-mesenchymal epithelial transition factor,HGF-c-Met)信號通路和微小核糖核酸miR-34a/沉默信息調節因子1(miR-34a/silent information regulator 1,SIRT1)途徑有效改善肝細胞脂肪變性[19-20]。TSPJ能對氯化鎘、異煙肼、利福平及乙酰氨基酚等誘導的肝損傷發揮顯著的保護作用,藥效物質可能主要為竹節參皂苷Ⅳa,作用機制可能與降低丙烯醇毒性,進而抑制肝損傷有關。TSPJ中的齊墩果烷型皂苷相對于達瑪烷型三萜皂苷保肝作用更強[21]。
2.2.3 促胃腸動力作用 TSPJ中的齊墩果酸低聚糖苷衍生物能加快食物通過胃腸道的速度,還能減緩小鼠胃排空速度。此外,TSPJ還能抑制胰脂肪酶的活性,調節自主神經系統以延遲食物中的脂肪在腸內吸收的時間,加快食物通過胃腸道的速度,從而使體質量下降[22-23]。當藥效成分中有3--單糖鏈配糖體或28-羧基基團時,其抑制作用加強[24]。因此,TSPJ有望成為肥胖的治療藥物。
2.3 對中樞神經系統的作用
2.3.1 鎮靜作用 ip給予小鼠TSPJ(100 mg/kg)85~95 min以及TSPJ(200 mg/kg)25~35 min均能起到較為顯著的鎮靜作用,TSPJ能夠協同戊巴比妥和硫賁妥鈉使小鼠催眠時間有效延長[25]。
2.3.2 抗驚厥作用 TSPJ能有效對抗戊四氮引起的驚厥,其引起驚厥涉及的腦部結構為腦干和大腦[26],但不能對抗士的寧和印防己引起的小鼠驚厥,可能是由于這2種化學物質作用的部位不在腦干和大腦[25]。
2.3.3 改善神經功能作用 竹節參中的達瑪烷型三萜皂苷(主要為人參皂苷Rb1、Rg1[4])能促進神經突觸生長和增強膽堿功能,從而起到改善學習記憶功能的作用。此外,人參皂苷Rg1、Rg3、Re均能明顯降低動物腦內的淀粉狀β-蛋白沉積含量,從而改善記憶缺陷[27]。
2.4 對心腦血管系統的作用
2.4.1 調血脂 竹節參中起調血脂作用的化學物質主要為TSPJ和PSPJ,并存在一定的量效關系[28-29]。將竹節參皂苷Ⅴ、偽人參皂苷RT1、竹節參皂苷Ⅳ、竹節參皂苷Ⅳa及這4種皂苷組合物作用于急性高脂血癥小鼠模型,觀察調血脂作用療效,發現4種皂苷成分組合物的調脂活性優于各竹節參皂苷單體化合物和TSPJ,竹節參皂苷Ⅴ、偽人參皂苷RT1、竹節參皂苷Ⅳ、竹節參皂苷Ⅳa,按2∶1∶1∶1比例組合物的調脂作用最為顯著,按照此配比組合的竹節參皂苷組合物作用于急性高脂血癥小鼠,其效果優于TSPJ[30]。
2.4.2 保護缺血損傷 TSPJ對心肌梗死大鼠具有良好的心臟保護作用,其機制可能是TSPJ能顯著增強心肌Ca2+-ATPase與Na+, K+-ATPase的活力,抑制核因子-κB(nuclear factor kappa B,NF-κB)、細胞外調節蛋白激酶1/2和p38絲裂原活化蛋白激酶通路的激活,促進腺苷酸活化蛋白激酶/雷帕霉素靶蛋白/Unc-51樣激酶1通路表達[31],增加SIRT1的表達,進而減輕心肌損傷和心肌細胞死亡[32]。TSPJ中去葡萄糖基竹節參皂苷Ⅳa為保護急性心肌缺血的主要化學物質[33]。
TSPJ可能通過抑制自噬的過度激活,從而減輕腦缺血再灌注損傷的發生[34]。抑制一氧化氮合酶和誘導型一氧化氮合酶的過度表達改善局灶性腦缺血再灌注損傷大鼠的腦損傷,抗氧化應激,改善毛細血管通透性,減輕腦缺血再灌注損傷[35-36]。
2.4.3 抗血栓 研究顯示,PSPJ能顯著抑制人源和血瘀證大鼠血小板的聚集,升高組織型纖維溶酶激活劑、6-酮前列腺素F1α的含量,降低大鼠體內血栓素B2、纖溶酶原激活物抑制因子的含量,發揮較強的抗血栓活性作用[37]。對6種人參屬藥材進行體外抗凝血活性差異進行分析研究,發現人參皂苷Rb2能有效延長凝血酶原時間,其藥效與含量呈正相關[38]。通過研究竹節參根與莖葉,發現這些部位所含的TSPJ均有極顯著的抗血栓作用[39]。從竹節參根莖中獲取到的70%甲醇提取物,主要化學成分為竹節參皂苷Ⅲ、Ⅳ、Ⅴ,對纖溶系統的激活具有良好的促進作用,能夠促進纖維蛋白的溶解,從而發揮抗血栓的作用[40]。
2.4.4 止血 《中國藥典》中明確記載竹節參具有其同屬藥材類似的止血功效[1],多用于治療吐血、倒經及功能性子宮出血,但目前尚缺乏對竹節參止血功效活性成分相關的基礎研究。
2.5 鎮痛作用
PSPJ與TSPJ均能夠提高小鼠痛閾值和扭體反應次數,鎮痛作用接近于非甾體抗炎藥,是竹節參發揮鎮痛作用的主要活性成分[41-42]。
2.6 免疫調節作用
在免疫功能亢進時竹節參可抑制免疫系統,減少功能亢進對自身造成的損傷,在免疫功能低下時能提高免疫系統的功能,故其具有雙向調節作用[43]。目前已證實PSPJ、TSPJ對免疫作用的調節。PSPJ能調節淋巴細胞、吞噬細胞功能及IL、抗體水平功能,升高血清中IL-2和IFN-γ在機體中的含量[44]。以TSPJ為主要成分的復方竹節參片,能顯著增強T細胞增殖效應、淋巴細胞轉化率,提高脾指數與胸腺指數[45]。TSPJ和PSPJ的聯合使用作用于免疫低下的小鼠,其對小鼠免疫系統的改善效果優于2種物質單獨使用[46]。
2.7 抗腫瘤作用
現已證實竹節參中發揮抗腫瘤作用的活性物質為TSPJ、PSPJ以及人參皂苷Rg3[47]。TSPJ能抑制移植性S180小鼠肉瘤的生長發育,從而增加模型動物的生存時間[48-49]。TSPJ可增加順鉑耐藥肺癌細胞的敏感性,其作用機制可能與抑制耐藥相關蛋白多藥耐藥基因、P-糖蛋白和絲氨酸/蘇氨酸激酶活性相關[50]。TSPJ能增加CD3+和CD4+免疫細胞數量,減少CD8+數量,降低血清中炎癥因子水平從而有效抑制腫瘤生長,其作用機制可能與抑制toll樣受體4(toll-like receptor 4,TRL4)/NF-κB信號通路表達有關[51]。
2.8 抗衰老作用
目前已知,衰老與炎癥反應關系密切,后者與氧化應激、自噬及小膠質細胞活化密不可分。研究顯示,TSPJ可能通過抑制絲裂原活化蛋白激酶、NF-κB信號通路、內質網應激、促進自噬恢復使衰老大腦中促炎細胞因子(如IL-1β和TNF-α)和炎癥介質(如環氧化物酶-2和誘導型一氧化氮合成酶)的產生減少和顯著抑制小膠質細胞的激活從而起抗衰老作用[52-54]。TSPJ能改善神經元損傷,減少氧化應激反應和抑制凋亡,最終改善腦衰老的認知功能,還可能與核因子E2相關因子2和SIRT1介導的抗氧化信號通路有關[55]。
2.9 抗炎作用
竹節參中目前已知的抗炎物質主要為TSPJ。劉玉萍等[56]將小鼠分為對照組、模型組、雷公藤多苷組、TSPJ高、中、低劑量組,結果顯示高、中、低TSPJ不僅能有效抑制大鼠的原發性炎癥,也明顯地抑制佐劑關節炎大鼠的繼發性炎癥,中、高劑量的治療效果優于雷公藤多苷,其機制可能與TSPJ減少炎性細胞浸潤有關。進一步研究顯示,TSPJ抗炎作用主要表現為抑制毛細血管通透性增強、抑制炎性腫脹,調控一氧化氮釋放,降低誘導型一氧化氮合成酶、TNF-α和IL-1β的表達;還可能與減少炎癥部位自由基產生、減少脂質過氧化反應有關[57-58]。
2.10 降糖作用
竹節參所含齊墩果烷型三萜皂苷有較強的降血糖作用[1],起作用的物質可能是竹節參皂苷V、竹節參皂苷Ⅳ、竹節參皂苷Ⅳa、偽人參皂苷RT1。
3 竹節參Q-Marker預測分析
中藥的有效成分受品種、栽培種植及產地生態條件、采收加工、炮制加工、運輸貯藏條件、提取純化、藥物傳輸途徑、復方及各成分之間交互作用等多種因素的影響,為提升中藥及其相關產品的質量標準,劉昌孝院士[59]提出了中藥Q-Marker概念,即存在于中藥材和中藥產品(如中藥飲片、中藥煎劑、中藥提取物、中成藥制劑)中固有的或加工制備過程中形成的、與中藥的功能屬性密切相關的化學物質。筆者依據Q-Marker的基本條件,對竹節參的Q-Marker進行初步預測。
3.1 竹節參與親緣性及化學成分特有性相關的Q-Marker預測
竹節參是人參屬植物,與人參、假人參和三七同屬,是同屬植物中分布最廣泛的植物,主要分布于北美、中亞和東亞。人參屬植物有6種3變種,在我國有4種。我國人參屬植物的分布情況為人參主要分布在中國東北地區;假人參主要分布于喜馬拉雅山與西藏地區;竹節參主要分布江西省及中國北側陜西秦嶺、湖北鄂西地區;三七主要分布于云南和四川地區[60]。竹節參中含有多種化學成分,包含皂苷類、糖類、氨基酸類、揮發油類、核苷類及無機鹽類,其中皂苷類成分主要是三萜類皂苷,被認為是竹節參的主要有效成分及主要次生代謝產物,同時也是目前研究最多的化學成分。目前已經分離出111個三萜類皂苷,其是人參屬植物的重要化學標志物。采用HPLC測定湖北五峰、湖北恩施及四川峨眉山3個產地的三萜苷元齊墩果酸含量,發現各產地含量差異較大[7]。三萜類化合物的合成途徑可能為甲羥戊酸形成異戊烯焦磷酸和二甲基丙烯基二磷酸鹽,再通過異戊烯焦磷酸與二甲基丙烯基二磷酸鹽結合形成異戊二烯,最后異戊二烯通過成環形成三萜類化合物。竹節參中含有的四環三萜皂苷與五環三萜皂苷都屬于三萜類皂苷合成途徑的下游成分,具有較強的特異性。人參屬植物具有系統分類價值的三萜皂苷類成分有達瑪烷型、齊墩果烷型、奧寇梯隆型。其中達瑪烷型三萜皂苷是人參屬植物典型的三萜皂苷類化合物。根據三萜皂苷不同結構類型的化合物在竹節參的不同種群中的分布差異性,種群之間的親緣關系及進化狀況可以被大致推測出。三七、人參和引進的西洋參主要含四環三萜皂苷,是人參屬植物中最古老類群,而竹節參主要含有五環三萜皂苷,是比較進化的類群[61]。因此,初步篩選五環三萜皂苷類成分可作為竹節參的Q-Marker之一。
3.2 竹節參與傳統功效相關的Q-Marker預測
中藥功效是中醫臨床組方遣藥的重要憑據,故其也是中藥Q-Marker分析的重要依歸。竹節參的傳統功效主治為散瘀止血、消腫止痛、祛痰止咳、補虛強壯等[1]。現代藥理研究表明,TSPJ具有抗潰瘍、保肝(藥效成分主要為竹節參皂苷Ⅳa)、調控胃腸蠕動力、鎮靜、鎮痛、抗驚厥、改善學習記憶功能(藥效成分主要為人參皂苷Rb、Rg1)、抗疲勞、保護缺血再灌注損傷(藥效成分主要為去糖基竹節參皂苷Ⅳ)、促纖維蛋白溶解(藥效成分主要為竹節參皂苷Ⅱ、Ⅳ、Ⅴ)、抗炎、調節免疫系統、延緩衰老(藥效成分主要為竹節參皂苷Ⅳa)及抗腫瘤的功效。
研究表明,竹節參“活血散瘀”功效主要表現為能促進纖維蛋白溶解[40],進而發揮抗血栓的作用[41]。起促纖維蛋白溶解作用的物質主要是竹節參皂苷Ⅲ、Ⅳ、Ⅴ[40]。而竹節參“止痛”作用的化學物質基礎則主要為PSPJ和TSPJ[14,41]。另外,竹節參的“消腫”作用與“抗炎”作用密切相關,物質基礎除PSPJ外,還有TSPJ[63-64]。TSPJ中起鎮痛作用的化合物主要為齊墩果烷型皂苷,其機制可能為TSPJ能降低炎癥小鼠血清中IL-1和TNF-α水平[65]。綜上所述,竹節參總皂苷中的竹節參皂苷Ⅲ、Ⅳ、Ⅴ、TSPJ、PSPJ與傳統功效相符合,是竹節參傳統功效的物質基礎,可作為竹節參Q-Marker分析的重要參考依據。
3.3 竹節參與藥性相關的Q-Marker預測
中藥的性味歸經是傳統中醫藥的基本屬性之一,是中藥的特有屬性,反映了中藥的本質特征,也是臨證治法及遣藥組方的重要依據。竹節參味甘、微苦,性溫,歸肝、脾、肺經[1]。甘味藥主要歸肝、脾、肺、胃,苦味藥主要歸肝、肺、胃,這與竹節參的歸經是相符的。甘味藥的化學成分以糖類、蛋白質、氨基酸為主,其次為苷類[66]。因此,竹節參中甘味的物質基礎主要為PSPJ、TSPJ和氨基酸。構成苦味的化學物質大致歸為生物堿、苷類、揮發油及苦味質[67-68]。此外,苦味藥大多具有抗炎、抗腫瘤、鎮痛的現代藥理作用[69],與竹節參的現代藥理作用是相符的。故竹節參中的皂苷、核苷及揮發油類物質為竹節參表現出微苦性能的物質基礎。
根據以上分析可知竹節參中多糖、皂苷、氨基酸類化學成分應為味甘的物質基礎;皂苷、核苷和揮發油類化學成分為味苦的物質基礎。故可將TSPJ、PSPJ、核苷、多糖、揮發油和氨基酸作為竹節參Q-Marker分析的重要參考依據。
3.4 竹節參與化學成分可測性相關的Q-Marker預測

皂苷類物質是竹節參的主要藥效基礎,故偽人參皂苷RT1、人參皂苷Rc、人參皂苷Rb2、竹節參皂苷Ⅳ、竹節參皂苷Ⅳa、竹節參皂苷Ⅴ、人參皂苷Re、人參皂苷Ro、人參皂苷Rb1及人參皂苷Rg1均可能作為竹節參Q-Marker的重要參考依據。
3.5 竹節參與入血化學成分相關的Q-Marker預測
中藥藥效作用的發揮與其入血化學成分密切相關。通過研究竹節參及竹節參復方在體內的代謝過程,基于化合物-靶點-通路分析竹節參復方顯效方式,已初步篩選出竹節參的多種入血藥效成分[78]。
通過對小鼠ig藤珠胃康顆粒,從小鼠的眼眶靜脈叢采血,發現人參皂苷Re、Ro、Rb1和竹節參皂苷Ⅳa 4種成分均能在大鼠體內實現一次吸收及二次吸收[79]。此外,使用超高效液相色譜-質譜分析竹節參同屬植物西洋參提取物中入血的化合物,鑒定出8個原型化合物,這8個化合物都存在于竹節參中,分別為人參皂苷Rb1、Rc、Rd、Rb3及七葉膽苷ⅩⅦ、偽人參皂苷F11[80]。同時,筆者還利用網絡藥理學技術進行了化合物-靶點-通路圖研究,發現越南參皂苷R1、R2和竹節參皂苷Ⅳa 3種入血成分與類風濕關節炎靶點具有較高相關性。因此可以將人參皂苷Rb1、Rc、Rd、Rb3及七葉膽苷ⅩⅦ、偽人參皂苷F11、越南參皂苷R1、越南參皂苷R2及竹節參皂苷Ⅳa作為竹節參Q-Marker的選擇。
目前已知,皂苷類化合物是竹節參最關鍵的藥效物質基礎。目前尚無直接對竹節參進行入血成分測定的全面研究,后續研究應深入探究竹節參的入血成分,并探明不同產地竹節參入血成分的差異,提高竹節參Q-maker分析體系的準確性和科學性。
3.6 竹節參與復方配伍相關的Q-Marker預測
中藥復方配伍可起到協同增效的目的。竹節參具有散瘀止血、消腫止痛、祛痰止咳、補虛強壯之功,常配伍其他中藥用于治療跌打損傷、關節炎以及虛勞等氣虛血瘀證[1]。竹節參片是臨床用于治療類風濕關節炎的復方制劑,其中竹節參與當歸、淫羊藿、白芍、青風藤、地蜂子、穿山龍等進行配伍,共同發揮消腫止痛作用,其機制可能類似于腎上腺皮質激素[81]。竹節參中起抗炎鎮痛作用的物質主要為PSPJ與TSPJ,因此可以將竹節參消腫止痛的成分(皂苷與多糖)作為方劑配伍的Q-Marker的重要參考依據。臨床應用竹節參配伍治療風濕關節炎疾病時,建議將起抗炎鎮痛作用的PSPJ與TSPJ作為方劑配伍的Q-Marker之一。
竹節參兼具補虛之功,常多與黨參、當歸等配伍用于治療虛勞,也可單獨竹節參煎水當茶飲。其發揮藥理作用可能與免疫系統調節有關[82],竹節參調節免疫系統的物質基礎為PSPJ與TSPJ,故應將其作為免疫調節方劑配伍的Q-Marker的參考之一。
此外,竹節參兼具止血之功。竹節參配伍麥冬、絲茅根煎水服用治療吐血;竹節參研粉水煎服用以治療倒經、功能性子宮出血。竹節參中止血的化學成分亟待明確,并將其作為竹節參的Q-Marker的參考之一。
3.7 基于不同加工方法的竹節參Q-maker預測
不同加工炮制方法會影響中藥有效成分的含量,選擇合適的加工方法對保證中藥藥效至關重要,因此,加工方法對竹節參Q-Marker的預測亦具有重要意義。通過使用超高效液相色譜-四級桿-飛行時間串聯質譜法對竹節參中的皂苷(三七皂苷R1、三七皂苷R2、人參皂苷Rg1、人參皂苷Rg2、人參皂苷Rd、人參皂苷Re、人參皂苷Rb1、人參皂苷Rb2、人參皂苷Rc、偽人參皂苷F11、偽人參皂苷RT1、竹節參皂苷V、竹節參皂苷Ⅳ、竹節參皂苷Ⅳa)、氨基酸(-組氨酸、-精氨酸、-絲氨酸、-丙氨酸、-天冬氨酸、-蘇氨酸、-脯氨酸、-組氨酸、-精氨酸、-絲氨酸、-丙氨酸、-天冬氨酸、-蘇氨酸、-脯氨酸、-異亮氨酸、-亮氨酸、-苯丙氨酸)及核苷(2′-脫氧胞苷、胞苷、腺苷、鳥苷、肌苷、尿苷、胸苷)含量進行測定,檢測不同加工方法對竹節參藥材中這些成分的影響,發現這些物質在一定濃度范圍內均呈現良好的線性關系,發現皂苷中穩定性最好的為偽人參皂苷RT1、竹節參皂苷Ⅳ、竹節參皂苷Ⅳa、人參皂苷Rb1、人參皂苷Rb2[83];氨基酸中穩定性最好的為-組氨酸、-精氨酸、-天冬氨酸、-脯氨酸、-蛋氨酸、-異亮氨酸;核苷中穩定性最好的物質為腺苷和鳥苷。因此,可將上述物質作為不同加工條件下的竹節參Q-Maker預測分析的標準[84]。
3.8 基于新的藥效用途的竹節參Q-maker分析
研究表明,TSPJ與PSPJ是竹節參調血脂作用的主要有效成分[28-29],目前已有專利將其運用于預防治療多發性硬化疾病。TSPJ中調血脂有效成分為竹節參皂苷Ⅴ與人參皂苷[85]。TSPJ及PSPJ能降低小鼠血清中總膽固醇、三酰甘油及低密度脂蛋白膽固醇含量[86],可能通過白細胞分化抗原36-核苷酸結合寡聚化區域樣受體家族3信號通路[87]和miR-34a/ SIRT1通路調血脂[19]。因此,可將TSPJ和PSPJ作為竹節參新的藥效用途Q-Marker分析的重要參考。
4 結語與展望
竹節參又名竹節人參、白三七、竹節三七等,兼具北藥人參和南藥三七的功效,是土家族珍貴的草藥,被民間譽為“草藥之王”[88]。目前已從竹節參中分離出的化學成分主要為竹節參皂苷、多糖、氨基酸、無機鹽、揮發油與核苷等。研究表明其藥理作用在消化系統中主要起抗潰瘍、保護肝損傷以及調節胃腸蠕動力作用,對中樞神經系統可以鎮靜、鎮驚以及改善神經網絡功能,還對心血管系統具有調血脂、保護缺血再灌注損傷、凝血和止血的作用。此外,竹節參還能抗疲勞、鎮痛、抗炎、抗腫瘤及延緩衰老。其中TSPJ與多糖為其藥理作用的主要物質基礎。由于竹節參對生長環境要求嚴格,野生資源遠遠難以滿足市場需求。近年來,隨著人工栽培技術的突破,竹節參市場需求日趨擴大,在云南、四川和湖北等產區已出現人工種植竹節參,并形成一定的產業規模。但苗種選育、栽培、加工等因素導致其質量參差不齊,故亟需建立科學、合理的質量控制和評價方法,有利于對竹節參的質量進行全面地控制與評價。本文依據中藥Q-maker概念,從竹節參的化學成分特有性、傳統藥效、傳統藥性、化學成分可測性等諸方面分析,發現竹節參最可能的質量控制標志物為TSPJ和PSPJ,在TSPJ中,進行網絡藥理學分析,已確定的Q-Marker有越南參皂苷R1、R2和竹節參皂苷Ⅳa;在《中國藥典》2020年版中[1],竹節參皂苷Ⅴ(人參皂苷Ro)和竹節參皂苷Ⅳa作為竹節參的檢測標準。綜上所述,可確定為竹節參Q-Maker的具體化合物是越南參皂苷R1、越南參皂苷R2、竹節參皂苷Ⅳa和竹節參皂苷Ⅴ。該質量控制與評價方法對竹節參的資源利用與生藥栽培,以及提高竹節參的利用效率,促進竹節參產業的良性發展具有重要意義。
利益沖突 所有作者均聲明不存在利益沖突
[1] 中國藥典 [S]. 一部. 2020: 144.
[2] 歐陽麗娜, 向大位, 吳雪, 等. 竹節參化學成分及藥理活性研究進展 [J]. 中草藥, 2010, 41(6): 1023-1027.
[3] 武秋爽, 陳平, 張慶文. 竹節參化學成分、藥理活性及分析方法研究進展 [J]. 亞太傳統醫藥, 2016, 12(6): 46-54.
[4] 頓耀艷, 袁丁. 竹節參化學成分的研究進展 [J]. 時珍國醫國藥, 2006, 17(10): 1909-1911.
[5] 何毓敏, 艾可, 何春喜, 等. 竹節參中的三萜皂苷類成分及其13C-NMR譜特征 [J]. 中國中藥雜志, 2019, 44(2): 249-260.
[6] 胡遠浪, 袁丁, 何毓敏, 等. 竹節參HPLC-ELSD指紋圖譜和化學成分分析 [J]. 中國中藥雜志, 2010, 35(8): 1009-1013.
[7] 袁丁, 何毓敏, 魯科明, 等. 竹節參中總皂苷和三萜苷元齊墩果酸的測定 [J]. 華西藥學雜志, 2008, 23(6): 692-694.
[8] 蔡平, 邱曉星, 肖倬殷. 川產竹節參皂甙元的薄層光密度掃描測定 [J]. 四川醫學院學報, 1984, 15(3): 237-242.
[9] 吳錦忠, 林如輝, 葉國維, 等. 人參屬四種植物中糖類含量比較 [J]. 貴陽醫學院學報, 1991, 16(2): 184-186.
[10] 張杰, 李春艷, 李勁平, 等. 蒽酮硫酸法與苯酚硫酸法測定竹節參多糖含量的比較研究 [J]. 中南藥學, 2012, 10(6): 421-424.
[11] 陳永波, 饒斌, 沈艷芬, 等. 竹節人參中氨基酸和皂甙特征組分的分析鑒別 [J]. 色譜, 2003, 21(3): 248-250.
[12] 伍紅年, 譚詩涵, 王元清, 等. 竹節參HPLC指紋圖譜的建立及7種成分測定 [J]. 中成藥, 2019, 41(5): 1074-1080.
[13] 吳錦忠, 易駿, 林曉峰, 等. 人參屬四種植物中氨基酸和無機元素的比較研究 [J]. 貴陽醫學院學報, 1992, 17(3): 230-232.
[14] 錢麗娜, 陳平, 李小莉, 等. 竹節參總皂苷成分的抗疲勞活性 [J]. 中國醫院藥學雜志, 2008, 28(15): 1238-1240.
[15] 劉桂林, 陳平, 張俊紅, 等. 鄂產竹節參多糖成分抗疲勞作用的研究 [J]. 中國醫院藥學雜志, 2006, 26(12): 1459-1461.
[16] 唐倩, 楊治國, 劉娟, 等. 竹節參總皂苷對DSS誘導潰瘍性結腸炎小鼠PPAR-γ信號通路及炎癥因子的影響 [J]. 中藥材, 2018, 41(3): 711-715.
[17] Borrelli F, Izzo A A. The plant kingdom as a source of anti-ulcer remedies [J]., 2000, 14(8): 581-591.
[18] 何志剛, 汪洋鵬, 劉磊, 等. 竹節參提取物對慢性酒精性肝損傷模型小鼠血清生化指標及炎癥因子水平的影響 [J]. 浙江中西醫結合雜志, 2018, 28(1): 21-24.
[19] 段麗, 劉朝奇, 吳利春, 等. 竹節參降脂復方對小鼠非酒精性脂肪性肝病的作用及機制研究 [J]. 解放軍醫學雜志, 2017, 42(9): 764-768.
[20] 熊海容, 李聰, 何春喜, 等. 竹節參總皂苷通過調節miR-199-5p改善小鼠脂肪性肝病的實驗研究 [J]. 中國中藥雜志, 2018, 43(17): 3525-3529.
[21] Liu J, Liu Y, Klaassen C D. The effect of Chinese hepatoprotective medicines on experimental liver injury in mice [J]., 1994, 42(3): 183-191.
[22] Shane-Mcwhorter L. Biological complementary therapies: A focus on botanical products in diabetes [J]., 2001, 14(4): 199-208.
[23] Li Y, Matsuda H, Yoshikawa M. Effects of oleanolic acid glycosides on gastrointestinal transit and ileus in mice [J]., 1999, 7(6): 1201-1205.
[24] Matsuda H, Li Y, Murakami T,. Structure-related inhibitory activity of oleanolic acid glycosides on gastric emptying in mice [J]., 1999, 7(2): 323-327.
[25] 陳淑清, 余立江, 江帆, 等. 竹節參總皂甙的鎮痛、鎮靜、抗驚及解痙作用和毒性試驗 [J]. 華西藥學雜志, 1987, 2(2): 85-89.
[26] 賀海波, 石孟瓊, 羅濤, 等. 珠子參總皂苷減弱炎癥應答和對H2O2誘導新生大鼠心肌細胞損傷的保護作用 [J]. 中藥藥理與臨床, 2012, 28(2): 51-55.
[27] Chen F, Eckman E A, Eckman C B. Reductions in levels of the Alzheimer’s amyloid beta peptide after oral administration of ginsenosides [J]., 2006, 20(8): 1269-1271.
[28] 楊小林, 陳平. 竹節參總皂苷對高血脂模型小鼠的影響作用 [J]. 中醫藥學報, 2010, 38(6): 22-24.
[29] 楊小林, 陳平, 王如鋒, 等. 竹節參多糖對高血脂模型小鼠的影響作用 [J]. 中國醫院藥學雜志, 2011, 31(6): 433-435.
[30] 楊小林, 張春鳳, 陳平, 等. 竹節參皂苷及其組合物的降脂活性比較研究 [J]. 上海中醫藥大學學報, 2020, 34(3): 57-61.
[31] Wang L P, Yuan D, Zheng J,. Chikusetsu saponin IVa attenuates isoprenaline-induced myocardial fibrosis in mice through activation autophagy mediated by AMPK/ mTOR/ULK1 signaling [J]., 2019, 58: 152764.
[32] Wei N, Zhang C C, He H B,. Protective effect of saponins extract fromon myocardial infarction: Involvement of NF-κB, Sirt1 and mitogen-activated protein kinase signalling pathways and inhibition of inflammation [J]., 2014, 66(11): 1641-1651.
[33] 孫桂波, 徐惠波, 溫富春, 等. 去葡萄糖竹節參皂苷Ⅳa對缺氧復氧心肌細胞損傷的保護作用[J]. 中國藥理學與毒理學雜志, 2005, 19(6): 424-427.
[34] 黃亞光, 歐炳金, 馮家騰, 等. 竹節參總皂苷調節大鼠海馬區自噬減輕腦缺血再灌注損傷 [J]. 中成藥, 2020, 42(7): 1721-1726.
[35] 賈占紅, 趙暉. 竹節參總皂苷對腦缺血大鼠神經細胞凋亡和即早基因表達的影響 [J]. 中國實驗方劑學雜志, 2011, 17(21): 168-172.
[36] 文德鑒, 張松, 張翠蘭, 等. 竹節人參總皂苷對I/R損傷大鼠抗氧化作用的觀察 [J]. 中國應用生理學雜志, 2008, 24(2): 195-196.
[37] 陳玲, 黃徐英. 竹節參多糖抗血栓活性的研究 [J]. 中華實驗外科雜志, 2017, 34(8): 1380-1383.
[38] 舒盼盼, 朱鵬飛, 楊鑫龍, 等. 6種人參屬藥材體外抗凝血活性與皂苷含量的相關性研究 [J]. 中草藥, 2019, 50(4): 918-924.
[39] 沈金陽, 楊中林. 竹節參根和莖葉中總皂苷抗血栓活性研究 [J]. 海峽藥學, 2014, 26(3): 149-151.
[40] Matsuda H, Samukawa K, Fukuda S,. Studies offibrinolysis [J]., 1989, 55(1): 18-21.
[41] 王如鋒, 陳平, 賈放, 等. 鄂產竹節參多糖的抗炎、鎮痛活性 [J]. 中國醫院藥學雜志, 2012, 32(7): 491-494.
[42] 文德鑒, 張翠蘭, 陳國棟, 等. 竹節參總皂苷鎮痛作用的實驗研究 [J]. 時珍國醫國藥, 2008, 19(8): 1983-1984.
[43] 郭哲, 馮知濤, 張浩然, 等. 竹節參及其制劑治療類風濕關節炎研究進展 [J]. 中藥材, 2019, 42(4): 941-944.
[44] 崔倩倩, 孫志偉, 張長城, 等. 竹節參多糖的免疫佐劑活性研究 [J]. 中國中醫藥信息雜志, 2014, 21(12): 88-91.
[45] 陳龍全, 劉杰書, 黃瓊. 竹節參的主要藥效與作用機制 [J]. 中華中醫藥雜志, 2009, 24(2): 197-198.
[46] 王洪武, 姜美杰, 趙海霞, 等. 竹節參皂苷與多糖組合物對免疫低下小鼠免疫功能的影響 [J]. 廣東醫學, 2010, 31(20): 2620-2622.
[47] 王洪羽, 金宏, 劉威, 等. 人參皂苷Rg3抗腫瘤作用的研究進展 [J]. 世界最新醫學信息文摘, 2018, 18(68): 50-51.
[48] 鄧旭坤, 米雪, 蔡儉, 等. 竹節參總皂苷的抗腫瘤作用和毒性研究 [J]. 中南民族大學學報: 自然科學版, 2013, 32(1): 47-49.
[49] 袁丁, 左銳, 張長城. 竹節參總皂苷抑制小鼠腫瘤生長的實驗研究 [J]. 時珍國醫國藥, 2007, 18(2): 277-278.
[50] 高貴洲, 張宏瑞, 張濤, 等. 竹節參皂苷對順鉑耐藥肺癌細胞敏感性的影響及機制研究 [J]. 中國現代應用藥學, 2020, 37(22): 2715-2719.
[51] 高貴洲, 張宏瑞, 梁曉華, 等. 竹節參皂苷通過Toll樣受體4/核因子-κB信號通路調控免疫功能對肺癌大鼠模型的影響 [J]. 陜西醫學雜志, 2020, 49(12): 1539-1542.
[52] Deng L L, Yuan D, Zhou Z Y,. Saponins fromattenuate age-related neuroinflammation via regulation of the mitogen-activated protein kinase and nuclear factor kappa B signaling pathways [J]., 2017, 12(11): 1877-1884.
[53] 焦夢婷, 劉小慧, 劉朝奇, 等. 竹節參總皂苷對衰老大鼠肝臟內質網應激及自噬介導的炎癥反應影響 [J]. 中國新藥雜志, 2020, 29(16): 1886-1893.
[54] 王瑞, 王佳文, 王婷, 等. 竹節參總皂苷減輕衰老大鼠的神經細胞凋亡 [J]. 現代食品科技, 2020, 36(1): 8-15.
[55] Wang T, Di G J, Yang L,. Saponins fromattenuate-galactose-induced cognitive impairment through its anti-oxidative and anti-apoptotic effects in rats [J]., 2015, 67(9): 1284-1296.
[56] 劉玉萍, 王金萍, 郭志剛. 竹節參培養細胞提取的竹節參總皂苷對大鼠佐劑性關節炎的抑制作用 [J]. 天然產物研究與開發, 2013, 25(6): 762-766.
[57] 代艷文, 楊莉, 萬靜枝, 等. 竹節參醇提物對LPS誘導RAW264.7細胞炎癥的保護作用 [J]. 中國實驗方劑學雜志, 2014, 20(2): 163-166.
[58] 代艷文, 袁丁, 萬靜枝, 等. 竹節參總皂苷通過NF-κB通路對LPS致RAW264.7細胞炎癥的保護作用研究 [J]. 中國中藥雜志, 2014, 39(11): 2076-2080.
[59] 劉昌孝, 陳士林, 肖小河, 等. 中藥質量標志物(Q-Marker): 中藥產品質量控制的新概念[J]. 中草藥, 2016, 47(9): 1443-1457.
[60] 魯歧, 富力, 李向高. 人參屬植物分類學的研究進展 [J]. 吉林農業大學學報, 1992, 14(4): 107-111,120.
[61] 楊世海, 方陣. 我國人參屬植物分類研究概況 [J]. 人參研究, 1991, 3(4): 4-7.
[62] 杭傳珍. 活血化瘀治則的藥理學基礎 [J]. 中醫臨床研究, 2019, 11(1): 34-35.
[63] 袁琴, 袁丁, 周志勇, 等. 竹節參齊墩果烷皂苷對RAW264.7巨噬細胞SIRT1活性影響及抗炎作用研究 [J]. 中國藥理學通報, 2016, 32(3): 349-354.
[64] 吳孟華, 張偉, 鄧建華, 等. 竹節參抗炎作用的研究進展 [J]. 中藥材, 2015, 38(5): 1096-1098.
[65] 敖明章. 竹節參皂苷抗炎抗風濕作用及機理研究 [D]. 武漢: 華中科技大學, 2012.
[66] 嚴永清, 吳建新. 藥物的甘味與歸經、作用及化學成分的關系 [J]. 中藥通報, 1988, 13(5): 52-55.
[67] 嚴永清, 吳建新. 藥物的苦味與歸經、作用及化學成分的關系 [J]. 現代應用藥學, 1987, 4(5): 12-15.
[68] 吳安芝, 張引拖. 論述苦味藥的藥性特征及其配伍作用 [J]. 內蒙古中醫藥, 2011, 30(7): 85-86.
[69] 胡菊花. 研究中藥臨床藥理的藥性理論 [J]. 世界最新醫學信息文摘, 2017, 17(94): 35-36.
[70] 陳佳麗, 談夢霞, 鄒立思, 等. 超快速液相色譜-三重四級桿/線性離子阱質譜法同時測定不同產地竹節參藥材中多元成分 [J]. 中國藥學雜志, 2019, 54(3): 226-233.
[71] 譚詩涵, 伍紅年, 雷雅婷, 等. 一測多評法測定竹節參中7種皂苷類成分的含量 [J]. 中草藥, 2019, 50(17): 4164-4169.
[72] 梁小飛, 白瑋, 李玉澤, 等. 太白楤木指紋圖譜及含量測定研究 [J]. 中藥新藥與臨床藥理, 2019, 30(12): 1528-1533.
[73] 鄒海艷, 周丹, 趙暉, 等. HPLC同時測定竹節參中竹節參皂苷Ⅴ和Ⅳa含量 [J]. 遼寧中醫藥大學學報, 2015, 17(1): 52-54.
[74] 姜薇薇, 陳庚, 沈雁南, 等. HPLC法同時測定狹葉竹節參中4種皂苷成分的含量 [J]. 中國藥師, 2020, 23(3): 585-587.
[75] 袁丁, 何毓敏, 魯科明, 等. RP-HPLC法測定竹節參藥材中齊墩果酸的含量 [J]. 中國藥房, 2009, 20(15): 1151-1153.
[76] 林奇泗, 李京華, 王慧, 等. 分析比較竹節參兩種不同提取方法所得揮發性成分 [J]. 沈陽藥科大學學報, 2013, 30(10): 772-775.
[77] 張元杰, 錢正明, 陳肖家, 等. HPLC法同時測定補益中藥中尿苷、腺嘌呤、鳥苷和腺苷的含量 [J]. 藥物分析雜志, 2010, 30(1): 33-36.
[78] Ji W H, Zhang M M, Yan H J,. Selective extraction and determination of chlorogenic acids as combined quality markers in herbal medicines using molecularly imprinted polymers based on a mimic template [J]., 2017, 409(30): 7087-7096.
[79] 胡錦蘋, 黎丹, 王小平, 等. 藤珠胃康顆粒中4種皂苷成分的大鼠體內藥代動力學研究 [J]. 中南藥學, 2017, 15(6): 790-793.
[80] 胡曬平, 嚴建業, 伍紅年, 等. 基于UPLC-Q-TOF-MS的西洋參提取物及入血成分分析 [J]. 中南藥學, 2019, 17(6): 825-830.
[81] 陳龍全, 袁德培, 孟衛星, 等. 復方竹節參片鎮痛、抗炎作用的實驗研究 [J]. 江蘇中醫, 1998, 30(9): 47-48.
[82] 高梅, 杜冠華. 中醫扶正補益對現代藥理學研究的啟示[A] // 中國藥理學會補益藥藥理專業委員會成立大會暨人參及補益藥學術研討會會議論文集[C]. 昆明:中國藥理學會, 2011: 2.
[83] 陳佳麗, 談夢霞, 鄒立思, 等. 不同加工竹節參中多元活性成分同時測定及灰色關聯度分析 [J]. 中國中藥雜志, 2018, 43(21): 4274-4282.
[84] 張文麗, 吳浩, 梅宇晨, 等. 基于穩定同位素技術的竹節參產地識別研究 [J]. 中草藥, 2020, 51(23): 6070-6076.
[85] 周丹菲, 宋文鋒, 譚新睿, 等. 人參皂苷和氯米帕明對慢性應激小鼠糖代謝和脂代謝的影響 [J]. 西北藥學雜志, 2010, 25(5): 361-363.
[86] 賈銀芝, 楊中林. 竹節參總皂苷對Triton WR-1339誘發的高脂血癥小鼠降血脂作用研究 [J]. 亞太傳統醫藥, 2015, 11(12): 9-11.
[87] 熊海容. 基于CD36-NLRP3信號通路研究竹節參皂苷Ⅳa改善脂肪性肝病的實驗研究 [D]. 宜昌: 三峽大學, 2019.
[88] 涂星, 徐新華, 張燕, 等. 恩施地區瀕危野生竹節參生態環境及伴生植物群落特征研究 [J]. 中國中藥雜志, 2016, 41(9): 1596-1601.
Research progress on chemical constituents and pharmacological effects ofand predictive analysis on quality markers
ZHOU Jing1, FU Xian-yun1, CAI San-jin1, YUAN Ding1, MEI Zhi-gang2, FENG Zhi-tao1
1. Third-Grade Pharmacological Laboratory on Chinese Medicine Approved by State Administration Chinese Medicine, College of Medicine, China Three Gorges University, Yichang 443002, China 2. Hunan Key Laboratory of Integrated Traditional Chinese and Western Medicine on Prevention and Treatment of Cardio-Cerebral Diseases, Hunan University of Chinese Medicine, Changsha 410208, China
Zhujieshen () belongs to thegenus of Acanthaceae,which is mainly distributed in Hubei, Yunnan, Guizhou, Sichuan and other places in China, with Enshi in Hubei being the most abundant. Because of its tonic effect asetand the activating effect aset, it is often used as an ethnic medicine to treat the syndrome ofdeficiency and blood stasis, such as traumatic injury, arthritis, and deficiency of fatigue. The main chemical constituents ofare saponins, sugars, amino acids, essential oils, nucleosides, and inorganic salts. Studies showed thathad anti-fatigue, liver protection, sedation, cardio-cerebrovascular protection, immune regulation, anti-tumor, anti-aging, and anti-inflammatory pharmacological effects. This paper reviewed the research progress on chemical constituents and pharmacological effects ofat home and abroad, and analyzed its quality markers (Q-marker). Vina-ginsenoside R1, vina-ginsenoside R2, chikusetsusaponin Ⅳa and chikusetsusaponin Ⅴ can be used as the main Q-markers of, which provide a basis for the establishment of quality evaluation system ofand a reference for the research and development of related new drugs.
C. A. Mey.; quality marker; vina-ginsenoside R1; vina-ginsenoside R2; chikusetsusaponin Ⅳa; chikusetsusaponin Ⅴ; polysaccharides of; total saponins of; cardio-cerebrovascular system regulation; immune regulation; anti-inflammation
R282.71
A
0253 - 2670(2021)09 - 2819 - 12
10.7501/j.issn.0253-2670.2021.09.029
2020-12-08
湖北省醫學青年拔尖第一層次人才項目(EWT2019-48)
周 靜(1998—),女,四川資陽人,本科在讀,主要從事中藥藥理研究。Tel: (0717)6396558 E-mail: 44486482@qq.com
馮知濤,副教授,碩士生導師。Tel: (0717)6396558 E-mail: fengzhitao2008@126.com
梅志剛,教授,碩士生導師,Tel: (0731)88458285 E-mail: zhigangmei@139.com
[責任編輯 崔艷麗]

