決明子的化學成分、藥理作用及質量標志物預測分析
董玉潔,蔣沅岐,劉 毅,陳金鵬,蓋曉紅,田成旺*,陳常青*
? Q-Marker預測分析 ?
決明子的化學成分、藥理作用及質量標志物預測分析
董玉潔1,蔣沅岐1,劉 毅2, 3, 4,陳金鵬2, 3, 4,蓋曉紅2, 3, 4,田成旺2, 3, 4*,陳常青2, 3, 4*
1. 天津中醫藥大學,天津 300193 2. 天津藥物研究院,天津 300301 3. 天津市中藥質量標志物重點實驗室,天津 300301 4. 釋藥技術與藥代動力學國家重點實驗室,天津 300301
決明子是我國傳統中藥材,具有食用和藥用雙重價值,主要分布于長江以南地區,主產于安徽、廣西、四川等地。近年來,隨著決明子在藥品及保健用品中應用越來越廣泛,其多種類型化學成分及藥理作用研究逐步深入。在對決明子化學成分、藥理作用進行綜述的基礎上,結合中藥質量標志物(quality marker,Q-Marker)概念,從植物親緣性、化學成分特有性、有效性、可測性及炮制對化學成分影響等不同方面對決明子Q-Marker進行預測分析,大黃素、大黃酸、大黃酚、蘆薈大黃素、大黃素甲醚、橙黃決明素、決明子苷、決明子苷C、紅鐮霉素龍膽二糖苷、決明子苷B2為主要篩選對象,決明子質量控制研究提供科學依據。
決明子;蒽醌類;萘并吡喃酮類;調血脂;質量標志物;大黃素;大黃酸;大黃酚;蘆薈大黃素;大黃素甲醚;橙黃決明素;決明子苷;決明子苷C;紅鐮霉素龍膽二糖苷;決明子苷B2
決明子為豆科植物決明L.或小決明L.的干燥成熟種子,以其有明目之功而名之,別名有草決明、馬蹄決明、假綠豆等。決 明子始載于《神農本草經》,列為上品藥,現已被國家衛生部列為藥食同源的中藥產品之一[1],具有很高的藥用價值,廣泛應用于醫療保健領域。決明子性微寒,味甘、苦、咸,善入肝、腎、大腸經,具有潤腸通便、調脂明目的功效,臨床上常用生品和炮制品,炮制方法一般為清炒。國內外學者對決明子的化學成分進行眾多研究,發現其含有多種化學成分并表現出多種藥理活性,如降壓、調脂、保肝明目、抑菌、抗氧化等,主要用于治療眼部疾病、便秘、高血脂、高血壓及糖尿病。隨著決明子的應用范圍越來越廣,對其質量的要求也越來越高。《中國藥典》[2]對決明子的質量評價指標只有大黃酚和橙黃決明素2種,指標成分過于單一,僅考慮蒽醌類成分用于決明子的質量控制不夠全面。中藥質量是中醫臨床用藥的安全保障,其優劣將直接影響臨床應用的安全性和有效性,并且受產地、品種、炮制等因素影響,決明子有效成分及其含量存在差異[3],從而可能導致藥效不同,影響臨床使用,因此尋找一種更加全面、整體的評價和控制決明子質量的方法十分必要。近年來,劉昌孝院士[4]提出的中藥質量標志物(quality marker,Q-Marker)的概念為中藥質量標準的建立提供了新思路。本文對決明子化學成分、藥理作用進行總結,并基于Q-Marker概念,從植物親緣性、化學成分特有性、有效性、可測性及炮制對化學成分影響等不同方面對決明子Q-Marker進行預測分析,為決明子質量控制研究提供借鑒。
1 化學成分
決明和小決明所含化學成分種類基本一致,而僅在個別成分的含量上有所差別[5],決明子含有多種化學成分,主要包括蒽醌類、萘并吡喃酮類、苷類、脂肪酸類、多糖等成分,還有非皂化物質、氨基酸類及無機元素等化合物。
1.1 蒽醌類
蒽醌類成分為決明子的主要活性成分,分為游離型和結合型2種形式,母核結構主要為大黃素型,結構較穩定,蒽醌母核上常有羥基、羥甲基、甲基、甲氧基及羧基取代,同時可以游離形式與糖結合成苷的形式存在于植物體內,糖的個數一般在1~4個,決明蒽醌所結合糖的類型主要為葡萄糖和龍膽二糖。目前已從決明子中分離出40余種蒽醌類成分,結構骨架見圖1,化合物名稱見表1。
1.2 萘并吡喃酮類及苷類
萘并吡喃酮類成分是決明屬中一類特異性成分,也是決明子中另一類功效性成分,與決明子藥理活性緊密相關,以保肝、抗肝毒作用為主。萘并吡喃酮類成分多以苷的形式存在,糖類型以吡喃葡萄糖和龍膽二糖為主,代表成分有決明子苷、決明子苷C、紅鐮霉素龍膽二糖苷等,化合物名稱見表2,具體成分結構見圖2。
1.3 脂肪酸類
決明子中含豐富的脂肪酸類成分,其組成以亞油酸、()-9-十八碳烯酸(油酸)、十六酸(棕櫚酸)為主,其他組成成分主要包括亞麻酸[24]、9-十六碳烯酸甲酯[25]、十八碳二烯酸、9,12-十八碳二烯酸甲酯[26]、9-十八碳烯酸甲酯[26]、十八酸、二十酸、二十二酸、二十四酸[27]、十六烷酸甲酯(軟脂酸)、十七烷酸甲酯[26]、亞油酸甲酯、棕櫚酸甲酯[25]、油酸甲酯、十八烷酸甲酯(硬脂酸)、油酸乙酯、二十烷酸甲酯(花生酸)、二十一烷酸甲酯[26]、二十二烷酸甲酯(山萮酸)、二十四烷酸甲酯[26]。決明子炮制品中還含有二十碳烯酸甲酯成分[25]。
1.4 多糖類
決明子中含有大量多糖成分,是除蒽醌類化合物外另一活性成分[28]。目前,國內外學者研究分離得到的大多數為半乳甘露聚糖[29],例如決明膠,主要由甘露糖、葡萄糖、半乳糖構成;部分為葡萄糖醛酸木聚糖[6]和果膠多糖,其余還有半纖維素、阿拉伯葡聚糖、多分支葡萄糖醛酸木聚糖等。
1.5 其他類
除上述主要成分外,有研究者發現3種色酮碳苷[16],分別為obtusichromoneside A、obtusichromone- side B、obtusichromoneside C。決明子中的非皂化物質主要包括十六烷~三十一烷、豆甾醇、β-谷甾醇、膽甾醇、1,3-二羥基-3-甲基蒽醌、錦癸酸、蘋婆酸及菜子甾醇;決明子中8種必需氨基酸量達到3.36%[30],主要為異亮氨酸、亮氨酸、纈氨酸、蛋氨酸、苯丙氨酸、賴氨酸、蘇氨酸及色氨酸,其余還有眾多非必需氨基酸,例如谷氨酸、天門冬氨酸、絲氨酸、胱氨酸、γ-羥基精氨酸等[31];無機元素主要包括Mo、Ni、Ca、K、P、Mg、Zn、Mn、Sr、Cr、V、Fe、Na等[32]。
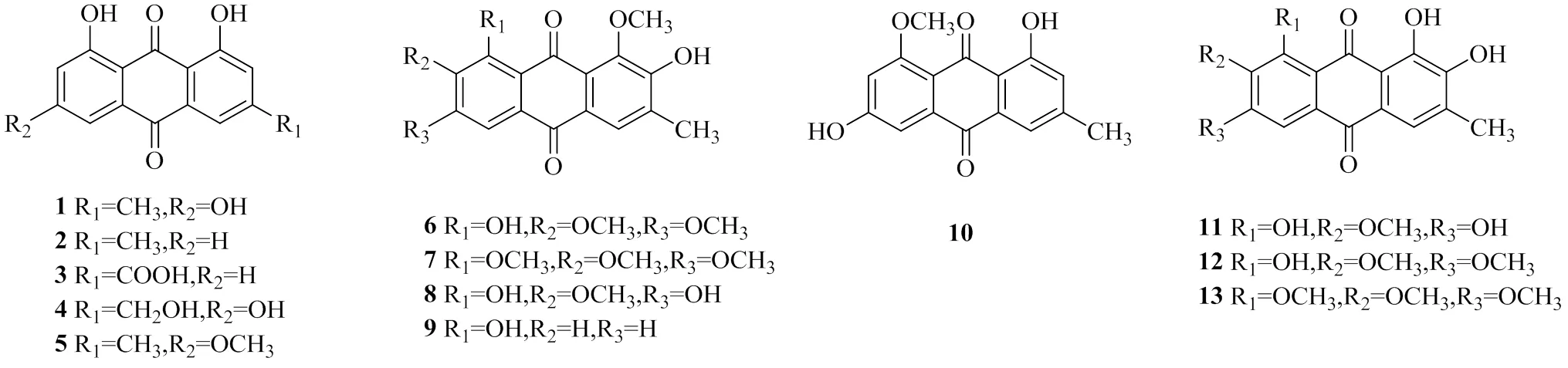
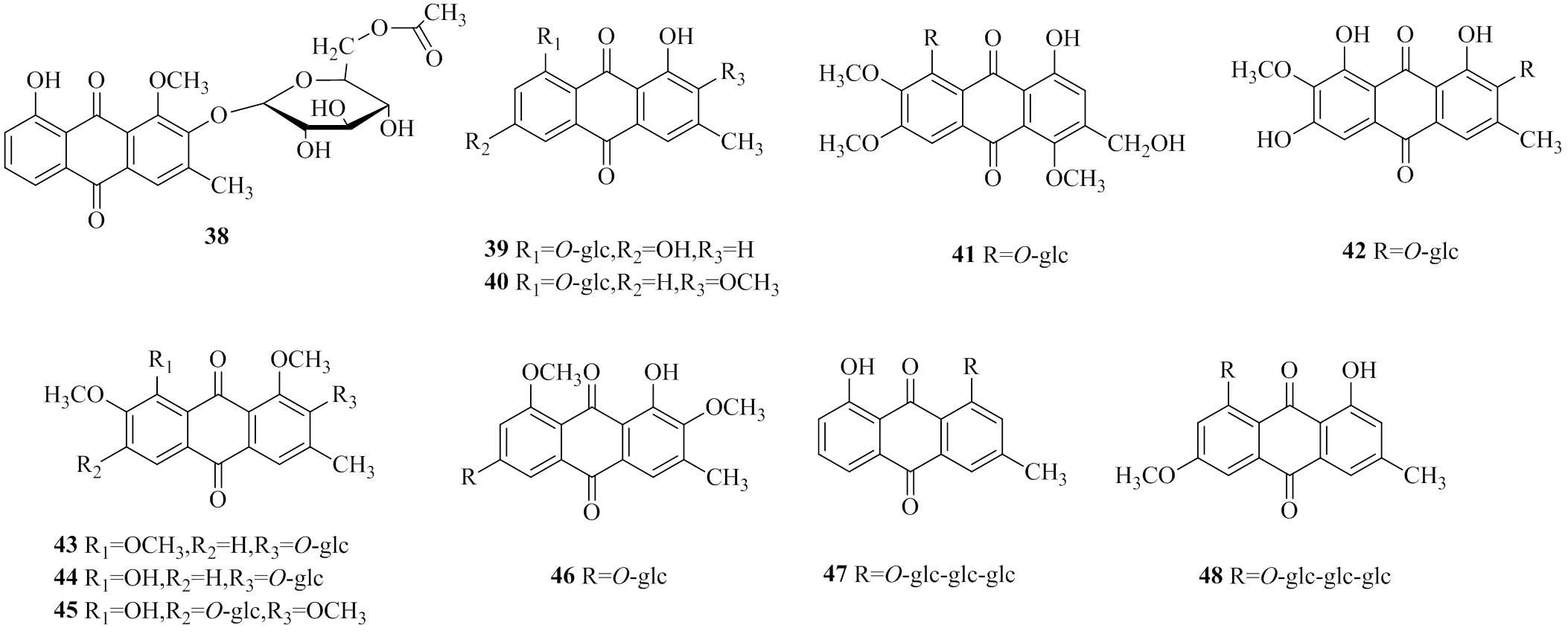
圖1 決明子中蒽醌類成分的結構

表1 決明子中蒽醌類成分

續表1

表2 決明子中萘并吡喃酮類成分
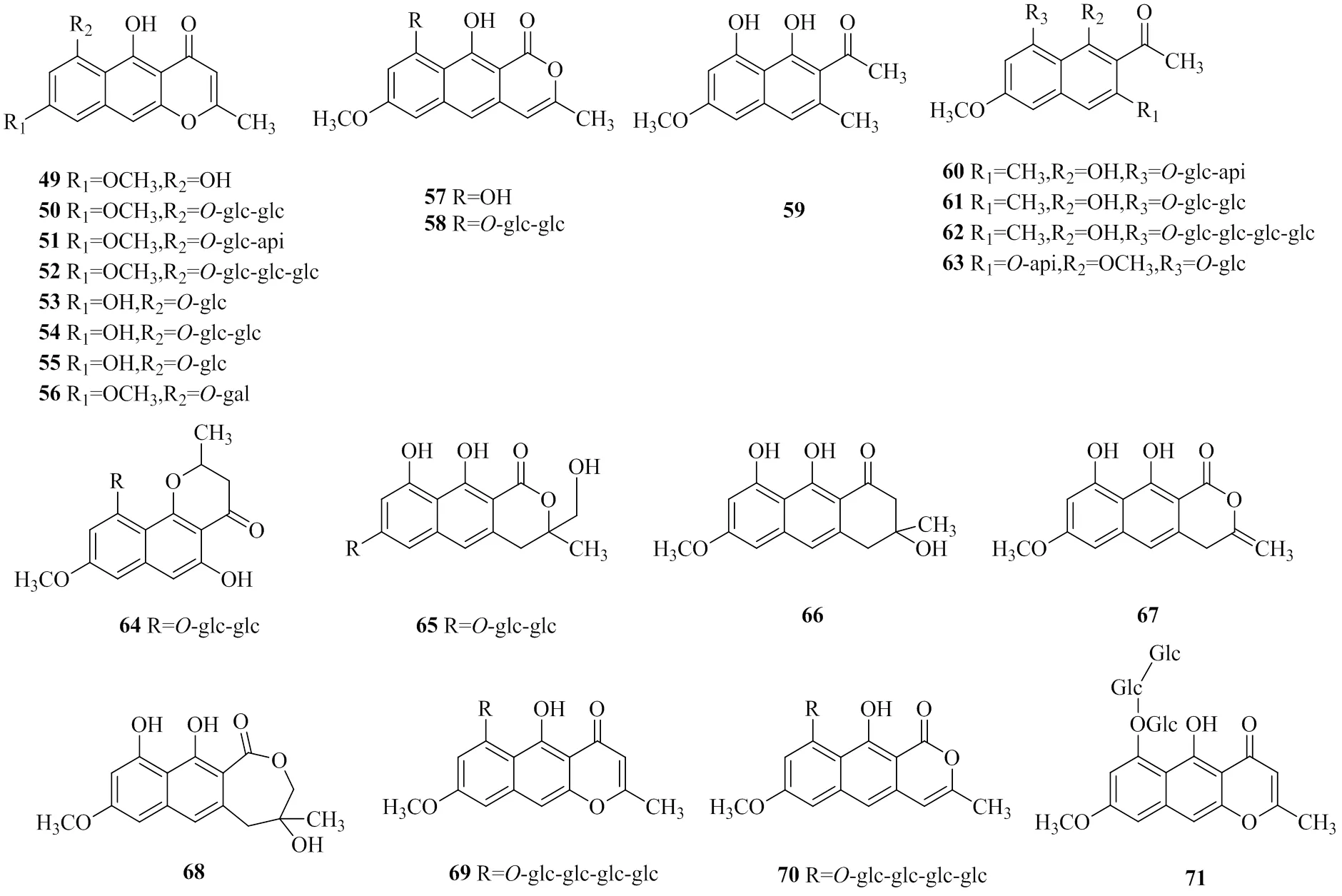
圖2 決明子中萘并吡喃酮類成分
2 藥理作用
2.1 降血壓作用
有研究表明,決明子水、醇提物具有明顯的降血壓作用[33]。譚穎杰[34]以自發性高血壓大鼠為模型,分別以決明子水提物、卡托普利、蒸餾水進行干預,結果表明決明子水提物能顯著降低大鼠收縮壓和舒張壓2項指標,并且高劑量組效果優于低劑量組。而后葉泉英等[35]以-硝基--精氨酸甲酯誘導的高血壓大鼠為模型,比較決明子提取物組與高血壓模型組的血壓,同時檢測血清谷草轉氨酶、尿素、血肌酐以及肝腎中的一氧化氮、血管緊張素轉化酶(angiotensin converting enzyme,ACE)活性等指標,決明子水提物組血壓明顯降低,且有效降低肝腎中血管緊張素轉化酶活性,改善肝腎功能,此結果表明決明子水提物的降壓機制包含上調內皮型一氧化氮合酶、抗氧化和抑制ACE等,除此之外,決明子甲醇提取物以及蒽醌苷類成分橙黃決明素葡萄糖苷具有抑制ACE的作用,具有潛在降壓作用[36]。有動物實驗證明[37]決明子中蒽醌苷、低聚糖和蛋白質等物質均可以降低大鼠血壓,且降壓作用蒽醌苷>低聚糖>蛋白質。另有研究者首次從決明子熱蛋白酶水解物中提取出抗高血壓肽FHAPWK[38],證明FHAPWK可與ACE活性位點的幾個關鍵殘基相互作用,抑制ACE活性,起到抗高血壓的作用。Li等[39]對決明子中橙黃決明素舒張全身動脈的作用機制進行研究,首次證明發現橙黃決明素松弛離體大鼠腸系動脈的作用,是一種潛在的血管擴張劑,通過內皮磷脂酰肌醇3-激酶(phosphatidylinositol- 3-kinase,PI3K)/堿性磷酸酶/一氧化氮合酶/一氧化氮信號通路舒張全身動脈,依賴于內皮完整性和一氧化氮的產生發揮作用,可能對高血壓的治療有積極作用。
2.2 調血脂作用
決明子蒽醌類物質是調血脂的有效部位,主要包括大黃素、大黃酚、蘆薈大黃素、大黃素甲醚、大黃酸、橙黃決明素等[40]。熊英[41]對蒽醌苷防治高脂血癥進行實驗研究,監測三酰甘油(triglyceride,TG)、血清總膽固醇(total cholesterol,TC)、高密度脂蛋白膽固醇(high density lipoprotein cholesterol,HDL-C)及低密度脂蛋白膽固醇(low density lipoprotein cholesterol,LDL-C)指標變化,結果顯示一定劑量的決明子蒽醌苷可降低TC、TG、LDL-C、升高HDL-C水平,同時推測蒽醌類物質可能是通過減少脂質吸收、增加其排泄而達到調脂效果。劉國華等[42]曾對決明子中蒽醌類調脂成分做詳細研究,用色譜法分離法從決明子提取物中分離出3種化合物,經鑒定初步認定有可能為羥基蒽醌的葡萄糖苷。Mei等[43]聯用降膽固醇益生菌和決明子蒽醌,探究二者對非酒精性脂肪肝的治療作用,結果顯示二者聯用可使血脂顯著降低,通過上調脂肪代謝過程中產生的膽固醇7α-羥化酶、低密度脂蛋白受體和過氧化物酶體增殖物激活受體(peroxisome proliferator-activated receptor,PPAR)α蛋白表達,同時下調3-羥基-3-甲基戊二酰輔酶a還原酶、PPAR-γ的表達,調節肝臟脂質代謝。決明子提取物也具有顯著的調脂活性。膽固醇調節元件結合蛋白裂解激活蛋白是調節細胞膽固醇平衡的一種傳感器,決明子的粗提物可抑制固醇調節元件結合蛋白通路活性從而抑制膽固醇的生物合成,起到調脂作用[44]。決明子95%乙醇提取物可通過激活脂蛋白脂肪酶和肝素化血漿脂解酶活性促進脂肪代謝,降低血漿及肝臟中的脂質水平[45]。此外,決明子多糖、蛋白質等也能起到一定的調脂作用[46]。
2.3 抗糖尿病及并發癥作用
有研究表明[47],決明子提取物具有降血糖及預治糖尿病并發癥的作用。決明子提取物能明顯改善糖尿病大鼠的胰島素抵抗,增強骨骼肌的胰島素敏感性,其機制可能與絲氨酸/蘇氨酸激酶B1(Liver kinase B1,LKB1)-腺苷酸活化蛋白激酶(AMP- activated protein kinase,AMPK)-葡萄糖轉運蛋白亞型4(glucose transporter 4,GLUT4)信號通路的損傷修復和骨骼肌的氧化應激有關[48]。決明子50%乙醇提取物可促進GLUT4易位改善糖代謝,從而起到降糖作用[49]。決明子醇提物中蒽醌類及萘并吡喃酮類成分可能是決明子發揮降糖作用的主要成分[50]。糖尿病并發癥多達百種,包括大血管、微血管受損及心、腦、腎、周圍神經、眼睛、足等相關疾病,腎臟病變是糖尿病的主要并發癥之一。宋云梅[51]發現決明子蒽醌苷對糖尿病引發的腎損傷具有保護作用,機制可能為通過降低腎損傷因子-1含量,抑制體內腎素和血管緊張素表達進而抑制腎損傷進程,起到保護作用,另有研究證明[50]決明子提取物可通過下調腎組織中晚期糖基化終產物受體的表達保護腎臟。Lee等[52]經體外生物測定方法發現決明子中3種萘并吡咯酮糖苷(決明子苷、rubrofusarin-6--β--gentiobioside、toralactone-9-- 13--gentiobioside)有抑制晚期糖基化終產物活性的作用,可減慢糖尿病并發癥發生的進程。決明子中大黃素和alaternin 2種成分可作為α-葡萄糖苷酶和蛋白酪氨酸磷酸酶1B(protein tyrosine phosphatase 1B,PTP1B)抑制劑,減慢葡萄糖吸收速率以及阻礙PTP1B對胰島素的作用,具有潛在的降血糖活性[53]。
2.4 肝保護作用
早有關于決明子抗肝毒的報道,例如決明子苷、紅鐮霉素-6--β--龍膽二糖苷和紅鐮霉素-6--β--芹菜糖基-(1→6)--β-葡萄糖苷等可對抗四氯化碳和半乳糖胺對小鼠肝細胞的毒害作用[54]。決明子水溶性成分對四氯化碳所致小鼠急性肝損傷也有積極作用,經實驗證明,決明子水溶物可抑制丙氨酸氨基轉移酶、天冬氨酸轉苷酶及丙二醛含量上升,促進谷胱甘肽過氧化物酶含量上升,保護肝細胞[55]。有研究顯示,決明子總蒽醌可影響肝細胞的增殖與凋亡,促進肝細胞修復再生[9]。蒲加偉等[56]探究決明子總蒽醌對脂多糖誘導大鼠急性肝損傷的作用,發現決明子總蒽醌通過高遷移率族蛋白B1介導Toll樣受體4、核因子κB(nuclear factor-κB,NF-κB)通路,抑制此通路的激活,降低炎癥反應,從而對肝臟起到保護作用。除此之外,決明子苷C可上調核因子紅細胞-2-相關因子2,醌氧化還原酶1和血紅素氧合酶1的表達保護肝臟[57]。這些實驗結果顯示決明子具有保護肝臟的生物活性成分。
2.5 對眼部疾病的作用
研究表明[58],中藥決明子在治療眼科疾病時具有促進作用。高眼壓是糖尿病患者的常見并發癥,邵鴻展[59]采用決明子水煎液對患者玻璃體視網膜術后高眼壓進行預防,結果顯示決明組發生高眼壓人數明顯低于對照組,且繼續用決明子水煎液對已發生高眼壓的患者進行治療,治愈率達88%,說明決明子能夠降低糖尿病患者玻璃體視網膜術后高眼壓的發生率,提高治愈率,對眼睛起到保護作用。張新等[60]對青光眼大鼠采用決明子多糖進行干預發現無論劑量高低對視網膜結構均起到恢復作用,中、高劑量組視網膜細胞未出現損傷,證實決明子多糖的護目作用,此作用機制可能與抑制小膠質細胞的炎癥病變有關。決明子提取物可減少氧自由基的生成,增加晶狀體組織內的谷胱甘肽水平,改善改善小鼠晶狀體的過氧化氧化應激狀態,保護晶狀體[61]。
2.6 抗氧化作用
決明子蒽醌類、萘并吡喃酮、多糖、蛋白質等均具有抗氧化活性。劉月麗等[62]以脂肪肝大鼠為模型,考察決明子抗氧化能力,中高劑量組決明子提取物能明顯降低大鼠肝組織中的丙二醛、一氧化氮水平,且高劑量組明顯增強總超氧化物歧化酶活性,顯示強抗氧化能力。李磊等[63]采用網絡藥理學方法對決明子抗氧化成分及作用機制進行研究,最終篩選出11個抗氧化活性成分,主要是蒽醌類成分及萘并吡喃酮類成分,11個成分作用于34個靶點,可通過調控活性氧代謝、參與細胞氧化還原反應、調控細胞增殖等多種途徑發揮抗氧化作用。其中蘆薈大黃素對氧自由基有較強的清除能力,并介導絲裂原活化蛋白激酶、蛋白激酶C、NF-κB等信號通路,這些通路與細胞氧化還原反應相關,這可能是蘆薈大黃素發揮抗氧化作用的機制[64]。有研究首次報道[65],決明子蛋白水解產物具有抗氧化活性,在模擬胃腸道消化及熱處理后仍然保持清除自由基活性且無毒,可作為抗氧化劑。郭曉強等[66]對決明子水溶性多糖的抗氧化活性進行研究,精制的決明子多糖對羥自由基有強清除能力,多糖體系質量濃度達到0.022 mg/mL時對超氧陰離子產生明顯抑制作用。
2.7 調節腸道功能作用
決明子蒽醌類成分是調節腸道功能的主要活性成分[67],并且多糖和纖維素具有一定的潤腸通便作用。張加雄等[68]以燥結便秘小鼠為模型,研究決明子提取物對腸道的影響,結果顯示決明子正丁醇提取物及石油醚提取物有一定的導瀉作用,可縮短首便時間,增加排泄量,并且決明子正丁醇提取物中主要為蒽醌苷和萘并吡喃酮苷類。劉旭等[69]考察決明子對便秘小鼠結腸運動功能的影響,發現決明子灌胃治療可抑制結腸內水通道蛋白3的功能,增加腸道水分,發揮潤腸通便作用。
2.8 抗菌作用
決明子對細菌、真菌都有一定的抗菌作用。熊衛東等[70]通過抑菌試驗對決明子、虎杖等含有蒽醌類成分中藥的天然抑菌性進行研究,發現決明子對大腸桿菌、產氣桿菌、金黃色葡萄球菌、肺炎球菌、青酶等具有較強的抑菌活性,其中蒽醌類成分大黃素對金黃色葡萄球菌、肺炎球菌有強抑制作用[71],大黃酚和大黃素甲醚除抑菌作用外還有一定的免疫調節作用[54]。此外決明子水浸物對某些皮膚真菌有抑制作用,其醇提取物可抑制金黃色葡萄球菌、傷寒及副傷寒桿菌及白喉桿菌[72]。除了對人體病原菌有抗菌作用外,決明子對植物病原菌也有一定抑制作用,決明子乙醇提取物及氯仿提取物對油菜菌核病菌、棉花炭疽病菌、彎孢菌、金黃色葡萄球菌、鐮刀菌的抑制作用較好[73]。
2.9 其他作用
決明子提取物及其組分對神經系統疾病有顯著的預防保護作用,影響人單胺氧化酶(human monoamine oxidase,hMAO)活性,尤其高選擇性的抑制hMAO-A活性,對焦慮及抑郁有預防作用[74];有實驗證明[75],大黃素及大黃素甲醚為多巴胺D3R激動劑和血管加壓素V1A拮抗劑,對神經系統起到一定的保護作用。此外,Yu等[76]研究發現決明子蒽醌類成分obtusifolin和aurantio-obtusin可作為開發新型凝血酶抑制劑的先導化合物,是強凝血酶抑制劑。Yuen等[77]探究發現決明子化合物可能與5-羥色胺受體結合后激活受體控制食欲而發揮抗肥胖作用。另有研究報道大黃素甲醚是一種潛在的治療宮頸癌的藥物成分[78]。
3 毒性研究
決明子的藥理活性十分廣泛,但越來越多的不良反應也同時顯現出來,近年來決明子的毒性研究不斷深入,有相關實驗表明[79]決明子可能存在一定的亞慢性毒性,主要發生于消化系統、肝腎及生殖系統,毒性成分可能為蒽醌類成分[80],因此決明子不宜長期服用。Yang等[81]對其潛在肝毒性進行了進一步研究,監測大鼠TC、TG、LDL、HDL等指標的變化,發現決明子水提物可使大鼠脂代謝紊亂,進而對肝臟造成一定損傷,潛在的肝毒性植物化學物質為大黃素、大黃酸、橙黃素等成分。
4 決明子的Q-Marker預測分析
中藥質量是中藥臨床安全有效的基礎,劉昌孝院士提出的中藥Q-Marker的新概念為中藥質量控制、質量標準的建立提供了新思路。中藥Q-Marker是存在于中藥材和中藥產品(如中藥飲片、中藥煎劑、中藥提取物、中成藥制劑)中固有的或加工制備過程中形成的、與中藥的功能屬性密切相關的化學物質,作為反映中藥安全性和有效性的標示性物質進行質量控制。因此通過文獻分析,對決明子Q-Marker進行預測,有利于建立決明子科學全面的質量控制方法。
4.1 基于植物親緣性及化學成分特有性的決明子Q-Marker預測分析
決明子來源于豆科決明屬的決明和小決明,決明屬植物全世界有600余種,主要分布于熱帶、亞熱帶及溫帶地區,我國決明屬植物有10余種,其中含有的中藥材有決明子、番瀉葉、野扁豆等。決明屬化學成分多種多樣,目前已分離出化合物單蒽核蒽醌及其苷類85個、蒽酚及蒽酮衍生物13個、萘并吡喃酮類26個、黃酮類化合物73個、生物堿類16個、苯丙素類12個、萜類11個,還有一些二苯乙烯類化合物、多糖、脂肪酸、氨基酸等[82]。蒽醌類、黃酮類及萘并吡喃酮類化合物是決明屬的主要次生代謝產物,其中蒽醌類成分和萘并吡喃酮類成分被認為是決明子主要活性物質[83]。
藥用植物代謝產物與環境條件直接相關,產地、品種等因素直接影響植物體內次生代謝產物的積累差異。楊東方等[84]對22批不同產地、采集方式的決明子中5種游離蒽醌成分進行比較,發現不同來源的決明子在化學成分的組分和含量上存在不同程度的差異,這表明其化學成分與產地、地理位置等生態環境存在一定的相關性。有研究表明[85]決明、小決明、生品決明、炒決明的總蒽醌、結合蒽醌、游離蒽醌、蒽醌苷元含量各有差異,因此通過對不同結構蒽醌類成分在各種群的分布情況也可以反映出這些種群之間的親緣及進化關系。除此之外,萘并吡喃酮類化合物是決明屬中一類特異性成分,且大部分成分可從決明子中分離得到,含量較高,是決明子有效活性成分。綜合以上對決明子化學成分分布差異性和特有性分析,蒽醌類成分及萘并吡喃酮類成分可作為決明子Q-Marker篩選的重要參考。
4.2 基于化學成分與有效性相關證據的決明子Q-Marker預測分析
4.2.1 成分與傳統功效相關性 《中國藥典》2020年版中描述決明子的功效為清熱明目,潤腸通便,用于治療目赤澀痛,羞明多淚,頭痛眩暈,目暗不明,大便秘結。決明子屬于清熱瀉火藥,其清肝火,瀉熱作用較強。現代藥理研究表明,決明子蒽醌類成分是潤腸通便的主要活性成分,大黃素、大黃酚、大黃素甲醚、蘆薈大黃素具有規律的瀉下和潤腸通便作用,可緩解便秘[86],并且蒽醌糖苷類成分可增強腸道的排泄功能,達到導瀉效果,這與決明子潤腸通便的傳統功效相一致。決明子屬于清熱瀉火藥,其清熱明目作用主要體現在降壓、抗炎、抗菌、保肝護目等藥理作用。橙黃決明素可降低NO、前列素E2的生成,降低脂多糖誘導的RAW264.7細胞核因子κB的激活,表明其具有一定的抗炎作用[87],且橙黃決明素可舒張全身動脈,擴張血管,對高血壓引起的頭暈有一定治療作用[39];蘆薈大黃素可低劑量相關性降低血壓[88]。除此之外決明子多糖具有抗氧化、保肝護目等作用,研究表明多糖成分對視網膜結構具有恢復作用,降低視網膜損傷程度。以上所提成分的生物活性與決明子傳統功效有共同之處,蒽醌類成分為主要藥效物質基礎,大黃素、大黃酚、蘆薈大黃素、大黃素甲醚、橙黃決明素及蒽醌糖苷類成分可考慮作為決明子的Q-Marker,另外決明子多糖的活性表明也可將其列入Q-Marker的主要選擇范圍。
4.2.2 成分與傳統藥性相關性 “性、味、歸經”是中藥藥性理論的重要組成部分,藥性來自藥物自身所含的有效成分、生物活性及其藥理作用,是指導中醫臨床用藥的重要依據,可作為確定Q-Marker的指標之一。決明子性微寒,味甘、苦,歸肝、大腸經。根據中藥藥性理論,“甘味”“苦味”的物質基礎應具有“甘味”“苦味”的味覺特征及功能屬性。“甘味”能補能緩能和,甘味藥的化學成分多以糖類、皂苷、脂肪、維生素、蛋白質、甾醇及氨基酸等為主[89];“苦味”能泄能燥,化學成分多以生物堿、揮發油、苷類、醌類、黃酮類及苦味素等為主,決明子性微寒,因而屬苦寒藥,化學成分尤以生物堿和苷類為主[90]。經以上分析,決明子“甘味”“苦味”相關的成分主要為苷類、多糖類,可作為決明子Q-Marker選擇的重要參考依據。
4.2.3 成分與現代藥效用途相關性 糖尿病、高脂血癥是現代人們易患的2種疾病,同時帶來各種并發癥危害身心健康。現代臨床研究證明,決明子對這兩種疾病的防治有積極作用,具有顯著的調血脂及抗糖尿病并發癥的作用。決明子蒽醌類物質是調血脂的主要成分,蒽醌糖苷具有減少膽固醇吸收,降低高脂血癥大鼠血清TC、TG及LDL-C水平的作用。張加雄等[91]從決明子正丁醇提取物中分離出6個有效單體化合物,包括鈍葉素、橙黃決明素、鈍葉決明素苷、鈍葉素苷、大豆苷和cassitoroside,發現橙黃決明素可通過增強低密度脂蛋白受體基因的轉錄水平來調節血脂。有證據表明,大黃素、橙黃決明素、chryso-obtusin-2--β-- glucoside具有抑制AR活性作用,影響糖尿病并發癥發展,決明子苷、決明子苷C、紅鐮霉素-6--β葡萄糖苷、鈍葉素、大黃素可抑制AGEs的生成,阻礙糖尿病并發癥的發生,其中紅鐮霉素-6--β--葡萄糖苷對NF-κB的激活和fibronectin與轉化生長因子β1的表達有顯著的抑制作用,防治糖尿病腎病[92]。分析可知,大黃素、橙黃決明素、蒽醌糖苷等蒽醌類物質及決明子苷、決明子苷C等萘并吡喃酮類物質是決明子調血脂、抗糖尿病的主要物質基礎,可作為決明子Q-Marker的篩選對象。
4.3 基于成分可測性的決明子Q-Marker預測分析
成分可測性是中藥Q-Marker的篩選依據之一,是建立質量評價標準的必要條件,常用的定性定量手段為色譜分析技術。經前文分析,決明子中蒽醌類成分、萘并吡喃酮類成分及決明多糖是決明子主要藥效物質基礎,因此考慮作為決明子Q-Marker的主要選擇。駱宜等[17]采用HPLC-IT-TOF MS聯用技術對決明子化學成分進行鑒別,共鑒別出了17個成分,包括7個萘并吡喃酮類成分、7個蒽醌類成分和3個萘酚類化合物,同時建立了測定決明子藥材中決明子苷C、決明子苷B2及紅鐮霉素龍膽二糖苷三個萘并吡喃酮成分的HPLC含量測定方法[93]。魏喜芹等[94]建立了決明子蒽醌苷元類及萘并吡喃酮苷類成分含量的一測多評方法,主要對6批決明子中紅鐮霉素龍膽二糖苷、大黃酚和大黃素甲醚進行測定,結果準確可靠。姬蕾等[95]采用超高效液相色譜技術建立了決明子指紋圖譜,初步確認決明子中10種化合物,包括決明子苷B2、決明子苷C2、紅鐮霉素-6--β-龍膽二糖苷、決明子苷C、橙黃決明素、大黃酸、黃決明素、大黃素、大黃酚、大黃素甲醚。申玉龍等[96]建立可同時測定4種蒽醌類成分HPLC測定方法,可用于決明子的質量評價。目前,決明子多糖的測定方法局限性較大,多糖成分種類多,結構復雜,分離純化及結構鑒定難度大,多糖的定性、定量測定尚存在較大困難[97]。決明子多糖的測定大多在分析多糖水解后的單糖組成的基礎上,根據摩爾比通過標準單糖了解多糖的基本組成和特征。萬強等[98]采用分光光度法和HPLC衍生化法測定多糖水解后單糖含量,建立12批藥材的決明子多糖HPLC指紋圖譜,分析的決明子多糖的組成特征。鄧施璐等[99]應用氣相色譜法分析決明子多糖的單糖組成,并采用苯酚硫酸法進行換算,測定決明子多糖的含量。
決明子蒽醌類成分、萘并吡喃酮類成分含量較高,且易通過色譜法測定,可作為篩選Q-Marker的重要依據,同時需對其化學物質組進行深入研究,提高測定方法的專屬性。決明子多糖與其有效性密切聯系,可考慮決明子Q-Marker的篩選對象,但決明子特異性、結構性的定量測定方法相對匱乏,需進一步開發研究。
4.4 基于炮制對化學成分影響的決明子Q-Marker預測分析
已有相關研究報道[100-101]采用高效液相色譜技術建立生、炒決明子的指紋圖譜,比較兩者差異考察炮制對決明子化學成分的影響,分析發現炮制前后決明子化學成分發生明顯變化,某些苷類成分含量顯著降低,部分苷元類成分含量明顯升高,部分不變或降低。賴日明[102]比較了決明子生品、清炒炮制品和微波炮制品中蒽醌類成分含量差異,生品中結合蒽醌含量高于炮制品,炮制品游離蒽醌遠高于生品,且微波法對化學成分含量影響更大。戈大春等[103]采用高效液相色譜法對決明子中6種游離蒽醌的含量進行檢測,炮制方法為清炒法,與生品比較,橙黃決明素和大黃酸的含量變化不大,大黃酚和大黃素甲醚含量降低,決明蒽醌和大黃素含量升高,而楊冰等[104]建立HPLC方法測定不同炒制程度下決明子中11種成分含量,橙黃決明素、決明素、黃決明素、美決明子素、大黃素含量變化不大,大黃酚及大黃素甲醚7種蒽醌苷元成分呈現升高趨勢,這與前人實驗結果相餑,由此推測化學成分含量的變化可能與炮制方法、時間及溫度有關,直接影響化學成分含量高低;炒制后決明子苷、決明子苷B2、決明子苷C及紅鐮霉素-龍膽二糖苷四種萘并吡喃酮苷類成分含量顯著下降,可能是由于受熱苷類分解導致成分含量降低。炮制會影響決明子有效成分的含量變化,但原有的有效成分仍存在,因此可選擇蒽醌類成分大黃素、大黃酚、大黃素甲醚、橙黃決明素及萘并吡喃酮苷類成分決明子苷、決明子苷B2、決明子苷C及紅鐮霉素-龍膽二糖苷為決明子Q-Marker的主要對象。
5 結語
決明子為典型的清熱瀉火藥,應用歷史悠久,資源豐富,藥食同源的特性使其具有廣闊的開發前景。決明子含有蒽醌類、萘并吡喃酮類、脂肪酸類、多糖等多種化學成分,表現出廣泛的生理活性,但多集中于降壓調脂、抗氧化、保護肝臟等作用方面,需加強對決明子化學成分的研究,開發出新的藥理作用,并逐漸延伸至臨床研究,擴大決明子的應用范圍,此外決明子長期服用存在一定的毒性,限制了決明子的應用,必須加大對其毒理研究,增加臨床用藥的安全性。決明子的品質受產地、品種、炮制等多方面因素的影響,使其化學成分和藥效存在差異,例如受炮制影響生決明子長于清肝熱、潤腸燥,而炒決明子長于平肝養腎。因此應從多方面評價決明子的品質好壞,傳統的以單一指標成分和標準來評價決明子質量的評價方法已不適用,建立全面、科學的決明子質量評價方法,指導決明子合理利用十分必要。
本文在總結分析決明子化學成分及藥理作用的基礎上,以中藥Q-Marker新概念為指導,從植物親緣性及化學成分特有性、化學成分有效性,成分可測性和炮制的影響5個方面對決明子Q-Marker的預測和篩選進行初步分析和論證,蒽醌類成分大黃素、大黃酸、大黃酚、蘆薈大黃素、大黃素甲醚、橙黃決明素及萘并吡喃酮類成分決明子苷、決明子苷C、紅鐮霉素龍膽二糖苷、決明子苷B2為主要篩選對象。中藥質量與中藥有效性及安全性緊密聯系,質量優略是臨床應用是否有效的重要標準,Q-Marker理論對建立更完善的質量標準具有重要意義。同時,基于決明子Q-Marker的預測分析,結合現代生物學技術展開對其質量的深入研究,進一步明確決明子的Q-Marker是重要研究方向。
利益沖突 所有作者均聲明不存在利益沖突
[1] 葛肖波, 薛曉琳, 李鑫, 等. 基于現代文獻探討干預血脂異常的藥食同源類藥物用藥特點及其病機分析 [J]. 世界中西醫結合雜志, 2020, 15(5): 845-849.
[2] 中國藥典 [S]. 一部. 2020: 151.
[3] 陳鴻平, 劉飛, 郭換, 等. 兩基原中藥決明子UPLC指紋圖譜研究 [J]. 中草藥, 2017, 48(18): 3826-3832.
[4] 劉昌孝, 陳士林, 肖小河, 等. 中藥質量標志物(Q-Marker): 中藥產品質量控制的新概念 [J]. 中草藥, 2016, 47(9): 1443-1457.
[5] 劉飛. 兩基原中藥決明子質量等同性與安全性研究 [D]. 成都: 成都中醫藥大學, 2017.
[6] 馮蕾. 決明子水溶性多糖的精細結構、構象特征及其流變行為研究 [D]. 南昌: 南昌大學, 2018.
[7] Guo R X, Wu H W, Yu X K,. Simultaneous determination of seven anthraquinoneaglycones of crude and processed semen cassiae extracts in rat plasma by UPLC-MS/MS and its application to a comparative pharmacokinetic study [J]., 2017, 22(11): E1803.
[8] Guo C Y, Liao W T, Qiu R J,. Aurantio-obtusin improves obesity and insulin resistance induced by high-fat diet in obese mice [J]., 2021, 35(1): 346-360.
[9] Dong X, Fu J, Yin X,. Cassiae semen: A review of its phytochemistry and pharmacology (Review) [J]., 2017, 16(3):2331-2346.
[10] 李婷, 馮占民, 楊巡紜, 等. 決明屬植物的化學成分及藥理作用研究進展[J]. 林產化學與工業, 2012, 32(6): 107-118.
[11] 陳秋東, 徐蓉, 徐志南, 等. 決明子中蒽醌類化學成分及其生物活性研究進展[J]. 中國現代應用藥學, 2003(02):120-124.
[12] Pang X, Li N N, Yu H S,. Two new naphthalene glycosides from the seeds of[J]., 2019, 21(10) :970-976.
[13] Tianaka S, Takido M. Studies on the constituents of the seeds ofL. The structures of two naphthopyrone glycosides [J]., 1988, 36(10): 3980-3984.
[14] Youn I S, Han A R, Choi J S,. A new naphthalenic lactone glycoside from the seeds of[J]., 2017, 53(3): 429-431.
[15] Tang L Y, Wang Z J, Fu M H,. A new anthraquinone glycoside from seeds of[J]., 2008, 19(9): 1083-1085.
[16] Wang S Y, Feng K Y, Han L F,. Glycosidic compounds fromseeds and their inhibitory effects on OATs, OCTs and OATPs [J]., 2019, 32: 105-109.
[17] 駱宜, 張樂, 王衛華, 等. 高效液相色譜-離子阱-飛行時間質譜鑒定決明子化學成分 [J]. 藥物分析雜志, 2015, 35(8): 1408-1416.
[18] Takahashi S, Takido M. Studies on the constituents of the seeds ofL.II. (on the purgative crude drugs. VII.) the structure of the new naphtho-α-pyrone derivative, toralactone [J]., 1973, 93(3): 261-267.
[19] Hatano T, Uebayashi H, Ito H,. Phenolic constituents ofand antibacterial effect of some naphthalenes and anthraquinones on methicillin-resistant[J].(Tokyo), 1999, 47(8): 1121-1127.
[20] Zhang Z, Yu B. Total synthesis of the antiallergicnaphtho- alpha-pyronetetraglucoside, cassiasideC(2), isolated from[J]., 2003, 68(16): 6309-6313.
[21] Hatano T, Uebayashi H, Ito H,. Phenolic constituents ofand antibacterial effect of some naphthalenes and anthraquinones on methicillin-resistant[J]., 1999, 47(8): 1121-1127.
[22] Lee G Y, Jang D S, Lee Y M,. Naphthopyroneglucosides from the seeds ofwith inhibitory activity on advanced glycation end products (AGEs) formation [J]., 2006, 29(7): 587-590.
[23] Tianaka S, Takido M. Studies on the constituents of the seeds ofL. The structures of two naphthopyrone glycosides [J]., 1988, 36(10): 3980-3984.
[24] 孟哲, 王曼澤, 劉萬毅. 決明子中不飽和脂肪酸高效液相色譜重疊峰的解析 [J]. 化學世界, 2012, 53(3): 146-150.
[25] 蔡瑾瑾, 陳璐. GC-MS分析王不留行、決明子、酸棗仁炒制前后脂肪油成分的變化 [J]. 中國實驗方劑學雜志, 2017, 23(15): 31-34.
[26] 刁全平, 侯冬巖, 郭華, 等. 決明子中脂肪酸的氣相色譜-質譜分析 [J]. 鞍山師范學院學報, 2014, 16(4): 28-30.
[27] 項略, 胡啟迪, 顧青青, 等. GC-MS法測定決明子脂肪油組成及穩定性探討 [J]. 上海中醫藥雜志, 2012, 46(7): 78-81.
[28] Cheng J, He S, Wan Q,. Multiple fingerprinting analyses in quality control ofpolysaccharides [J]., 2018, 1077/1078: 22-27.
[29] 劉金金, 殷軍藝, 黃曉君, 等. 決明子多糖結構和生物活性功能研究進展 [J]. 食品研究與開發, 2019, 40(23): 212-224.
[30] 周菊峰, 彭愛姣. 差示分光光度法測定決明子中8種必需氨基酸 [J]. 西北藥學雜志, 2011, 26(1): 25-27.
[31] 馮潛, 劉祖碧, 宋濤, 等. 決明子營養價值分析及蛋白提取工藝研究 [J]. 生物學雜志, 2014, 31(4): 103-106.
[32] 楊冰, 秦昆明, 徐瀅, 等. 決明子生品及炮制品中無機元素的含量測定 [J]. 中華中醫藥雜志, 2018, 33(8): 3294-3299.
[33] 方雪琴. 決明子研究進展 [J]. 上海醫藥, 2011, 32(8): 391-394.
[34] 譚穎杰. 決明子水提物對自發性高血壓大鼠降壓作用的實驗研究 [J]. 中外醫學研究, 2012, 10(27): 141.
[35] 葉泉英, 陳啟生, 李艷文, 等. 決明子水提物干預-硝基--精氨酸甲酯誘導高血壓模型大鼠血壓的變化 [J]. 中國組織工程研究, 2021, 25(11): 1705-1711.
[36] Hyun S K, Lee H, Kang S S,. Inhibitory activities ofand its anthraquinone constituents on angiotensin-converting enzyme [J]., 2009, 23(2): 178-184.
[37] 賀韻涵, 辛寶. 三種具有降壓作用的藥食兩用物品研究進展 [J]. 中西醫結合心血管病電子雜志, 2018, 6(27): 169.
[38] Shih Y H, Chen F A, Wang L F,. Discovery and study of novel antihypertensive peptides derived fromseeds [J]., 2019, 67(28): 7810-7820.
[39] Li S, Li Q, Lv X,. Aurantio-obtusin relaxes systemic arteries through endothelial PI3K/AKT/-dependent signaling pathway in rats [J]., 2015, 128(3): 108-115.
[40] 李丹, 董開心, 劉燕華, 等. 降脂類中藥降脂成分及降脂機制的研究進展 [J]. 江西醫藥, 2020, 55(11): 1736-1740.
[41] 熊英. 決明子蒽醌苷防治高脂血癥實驗研究 [J]. 湖北中醫雜志, 2015, 37(1): 18-19.
[42] 劉國華, 張延敏. 決明子降血脂的有效成分研究 [J]. 河南中醫, 2012, 32(11): 1535-1536.
[43] Mei L, Tang Y C, Li M,. Co-administration of cholesterol-lowering probiotics and anthraquinone fromL. ameliorate non-alcoholic fatty liver [J]., 2015, 10(9): e0138078.
[44] Li J Z, Wang X, Yuan Y,. Antest system for evaluation of SCAP-SREBP pathway inhibitory activities of traditional Chinese medicines [J]., 2017, 7(78): 49244-49250.
[45] Awasthi V K, Mahdi F, Chander R,. Hypolipidemic activity ofseeds in hyperlipidemic rats [J]., 2015, 30(1): 78-83.
[46] 張喜, 董慧. 決明子及其主要成分治療高血脂癥的研究進展 [J]. 現代中西醫結合雜志, 2014, 23(35): 3972-3974.
[47] 王秋燕. 決明子提取物的制備工藝、質量控制及抗糖尿病作用研究 [D]. 武漢: 華中科技大學, 2019.
[48] Wang Q Y, Tong A H, Pan Y Y,. The effect ofextract on the regulation of the LKB1-AMPK- GLUT4 signaling pathway in the skeletal muscle of diabetic rats to improve the insulin sensitivity of the skeletal muscle [J]., 2019, 11: 108.
[49] Zhang M L, Li X, Liang H F,.extract improves glucose metabolism by promoting GlUT4 translocation in the skeletal muscle of diabetic rats [J]., 2018, 9: 235.
[50] Wang Q Y, Zhou J W, Xiang Z N,. Anti-diabetic and renoprotective effects ofextract in the streptozotocin-induced diabetic rats [J]., 2019, 239: 111904.
[51] 宋云梅. 決明子蒽醌苷對糖尿病大鼠腎損傷的保護作用 [J]. 中醫臨床研究, 2018, 10(20): 6-7.
[52] Lee G Y, Jang D S, Lee Y M,. Naphthopyrone- glucosides from the seeds ofwith inhibitory activity on advanced glycation end products (AGEs) formation [J]., 2006, 29(7): 587-590.
[53] Jung H A, Ali M Y, Choi J S. Promising inhibitory effects of anthraquinones, naphthopyrone, and naphthalene glycosides, fromon α-glucosidase and human protein tyrosine phosphatases 1B [J]., 2016, 22(1): E28.
[54] 駱宜, 張樂, 王衛華, 等. 高效液相色譜-離子阱-飛行時間質譜鑒定決明子化學成分 [J]. 藥物分析雜志, 2015, 35(8): 1408-1416.
[55] 謝薇, 劉廣超. 決明子水溶性成分對四氯化碳所致小鼠急性肝損傷的保護作用研究 [J]. 中國民康醫學, 2016, 28(3): 76-77.
[56] 蒲加偉, 楊雄, 吳余, 等. 決明子總蒽醌對脂多糖誘導大鼠急性肝損傷的作用及其機制探討 [J]. 中國現代醫學雜志, 2020, 30(20): 6-11.
[57] Seo Y, Song J S, Kim Y M,. Toralactone glycoside inmediates hepatoprotection via an Nrf2-dependent anti-oxidative mechanism [J]., 2017, 97: 340-346.
[58] 周維維. 中藥決明子在眼科輔助性治療方面的研究 [J]. 人人健康, 2019(13): 200-201.
[59] 邵鴻展. 決明子對糖尿病患者玻璃體視網膜術后高眼壓的預防作用 [J]. 糖尿病新世界, 2020, 23(1): 171-173.
[60] 張新, 趙燕, 魏玲. 決明子多糖對大鼠青光眼視網膜細胞的保護作用及機制 [J]. 中國老年學雜志, 2018, 38(15): 3739-3742.
[61] 黃曉丹, 鄭榮波, 譚蕊蓉, 等. 決明子提取物對小鼠實驗性晶狀體氧化應激狀態的影響 [J]. 中藥新藥與臨床藥理, 2012, 23(2): 167-170.
[62] 劉月麗, 陳依雨, 呂俊華. 決明子對脂肪肝大鼠肝組織抗氧化能力的影響 [J]. 海南醫學院學報, 2014, 20(12): 1617-1618.
[63] 李磊, 趙花金, 伍子燾, 等. 決明子抗氧化作用機制的網絡藥理學分析 [J]. 浙江農業學報, 2020, 32(10): 1855-1865.
[64] Dong X, Zeng Y W, Liu Y,.-emodin: A review of its pharmacology, toxicity, and pharmacokinetics [J]., 2020, 34(2): 270-281.
[65] 蔡俊泰, 徐芷茵, 徐國強, 等. 決明子蛋白水解產物的抗氧化活性:熱和胃腸穩定性,肽鑒定和計算機分析 [J]. 現代食品科技, 2019, 35(9): 38-48.
[66] 郭曉強, 顏軍, 鄔曉勇, 等. 決明子水溶性多糖的純化及抗氧化活性研究 [J]. 食品科學, 2007, 28(8): 205-208.
[67] 紀曉萍, 張炯豐, 方東生. 大黃提取物中游離蒽醌對實驗性便秘小鼠的瀉下作用 [J]. 黑龍江中醫藥, 2019, 48(6): 336-337.
[68] 張加雄, 萬麗, 胡軼娟, 等. 決明子提取物瀉下作用研究 [J]. 時珍國醫國藥, 2005, 16(6): 467-468.
[69] 劉旭, 杜愛林, 姜洪波, 等. 決明子對便秘小鼠結腸肌電和水通道蛋白3表達的影響 [J]. 中國老年學雜志, 2015, 35(8): 2145-2147.
[70] 熊衛東, 馬慶一. 含蒽醌的中草藥: 一類潛在的天然抑菌防腐劑初探 [J]. 天津中醫藥, 2004, 21(2): 158-160.
[71] 陳琦, 樓秀芹, 劉濤, 等. 大黃素對金黃色葡萄球菌生物膜抑制作用的體外研究 [J]. 中華微生物學和免疫學雜志, 2020, 40(9): 703-708.
[72] 周止敬. 決明子驗方 [J]. 家庭醫學, 2016(9): 54.
[73] 程玲鈴, 孫梅, 涂凌. 決明子提取物對植物病原菌的抑菌活性初探 [J]. 四川理工學院學報: 自然科學版, 2005, 18(2): 53-55.
[74] Paudel P, Seong S H, Shrestha S,.and in silico human monoamine oxidase inhibitory potential of anthraquinones, naphthopyrones, and naphthalenic lactones fromLinn seeds [J]., 2019, 4(14): 16139-16152.
[75] Paudel P, Seong S H, Fauzi F M,. Establishing GPCR targets of hMAO active anthraquinones fromlinn seeds usingandmethods [J]., 2020, 5(13): 7705-7715.
[76] Yu X, Wei L H, Zhang J K,. Anthraquinones fromas thrombin inhibitors:andstudies [J]., 2019, 165: 112025.
[77] Yuen H, Hung A, Yang A W H,. Mechanisms of action offor weight management: A computational molecular docking study of serotonin receptor 5-HT2C [J]., 2020, 21(4): E1326.
[78] 王淑紅, 楊春娟, 劉璐, 等. HPLC測定決明子中6種游離蒽醌含量 [J]. 哈爾濱醫科大學學報, 2015, 49(1): 22-26.
[79] Zhao Y M, Wu L, Zhang S,. Safety evaluation and risk control measures of[J]., 2017, 42(21): 4074-4078.
[80] 楊津蘭, 李雅秋, 王旗. 決明子中28種主要化學成分潛在腎毒性篩選[A]//新時代·新技術·新策略·新健康論文集[C] 武漢: 中國藥理學會, 2019: 1.
[81] Yang J L, Zhu A, Xiao S,. Anthraquinones in the aqueous extract ofcause liver injury in rats through lipid metabolism disorder [J]., 2019, 64: 153059.
[82] 孫建慧, 黃圓圓, 郭蘭萍, 等. 決明屬植物化學成分與藥理作用研究進展 [J]. 西部中醫藥, 2020, 33(9): 145-159.
[83] 李春曉, 王月明, 韋東來, 等. 決明子的主要化學成分和藥理作用研究進展 [J]. 現代農業研究, 2018(6): 47-50.
[84] 楊東方, 胡云飛, 蔡翠芳, 等. 基于特征圖譜分析市售決明子質量現狀 [J]. 中成藥, 2019, 41(6): 1328-1333.
[85] 李金金, 羅長浩. 中藥決明子有效成分、藥理作用與發展前景 [J]. 農產品加工, 2018(17): 71-72.
[86] 高娃, 付立波. 決明子對家兔離體小腸平滑肌活動的影響[J]. 中國老年學雜志, 2015, 35(3): 735-736.
[87] Hou J Y, Gu Y, Zhao S,. Anti-inflammatory effects of aurantio-obtusin from seed ofL. through modulation of the NF-κB pathway [J]., 2018, 23(12): E3093.
[88] 李牧, 杜智敏. 蘆薈大黃素的藥理作用研究進展 [J]. 中國臨床藥理學雜志, 2015, 31(9): 765-768.
[89] 于培明, 田智勇, 林桂濤. 甘味藥的藥性理論及其配伍探討 [J]. 時珍國醫國藥, 2005, 16(1): 77-78.
[90] 吳安芝, 張引拖. 論述苦味藥的藥性特征及其配伍作用 [J]. 內蒙古中醫藥, 2011, 30(7): 85-86.
[91] 張加雄, 萬麗, 王凌. 決明子降血脂有效部位的化學成分 [J]. 華西藥學雜志, 2008, 23(6): 648-650.
[92] Jung D H, Kim Y S, Kim N H,. Extract ofand its major compound inhibit S100b-induced TGF-beta1 and fibronectin expression in mouse glomerular mesangial cells [J]., 2010, 641(1): 7-14.
[93] 駱宜, 劉斌. HPLC法測定決明子中3個萘并吡喃酮類成分的含量 [J]. 中華中醫藥雜志, 2016, 31(9): 3774-3777.
[94] 魏喜芹, 魏世杰, 馬研妮. 一測多評法測定決明子中蒽醌苷元類和萘并吡喃酮苷類有效成分含量 [J]. 中國生化藥物雜志, 2016, 36(4): 189-192.
[95] 姬蕾, 楊冉冉, 喬藝涵,等. 決明子超高效液相色譜指紋圖譜研究 [J]. 環球中醫藥, 2019, 12(5): 691-696.
[96] 申玉龍, 徐達, 金艷敏, 等. 高效液相色譜法測定決明子4種成分含量 [J]. 中國藥業, 2020, 29(9): 134-136.
[97] 張慧娟, 龔蘇曉, 許浚, 等. 澤瀉藥材的研究進展及其質量標志物的預測分析 [J]. 中草藥, 2019, 50(19): 4741-4751.
[98] 萬強, 吳學昊, 范華均, 等. HPLC衍生化法分析決明子多糖水解產物中單糖組分及其多糖組成特征的研究 [J]. 分析測試學報, 2014, 33(11): 1231-1236.
[99] 鄧施璐, 龍遠春, 張兵, 等. 決明子多糖含量測定方法 [J]. 南昌大學學報: 理科版, 2019, 43(3): 241-245.
[100]郭日新, 于現闊, 張曉, 等. 決明子炮制過程化學研究 [J]. 中國中藥雜志, 2018, 43(15): 3145-3149.
[101]白發平, 楊冰, 謝莉, 等. 決明子炮制前后指紋圖譜比較研究 [J]. 江西科學, 2018, 36(6): 909-915.
[102]賴日明. 不同炮制方法對決明子中蒽醌類成分含量的影響 [J]. 中國民族民間醫藥, 2015, 24(20): 5.
[103] 戈大春, 沈多榮, 王卓君. 炮制對決明子中六種游離蒽醌含量的影響 [J]. 世界中醫藥, 2018, 13(7): 1763-1765.
[104]楊冰, 秦昆明, 李偉東, 等. 不同炒制程度下決明子中11種成分含量變化研究 [J]. 世界科學技術―中醫藥現代化, 2019, 21(7): 1364-1371.
Research progress on chemical composition and pharmacological effects ofand predictive analysis on quality markers
DONG Yu-jie1, JIANG Yuan-qi1,LIU Yi2,3,4, CHEN Jin-peng2,3,4, GAI Xiao-hong2,3,4, TIAN Cheng-wang2,3, 4, CHEN Chang-qing2,3,4
1. Tianjin University of Traditional Chinese Medicine, Tianjin 300193, China 2. Tianjin Institute of Pharmaceutical Research, Tianjin 300301, China 3. Tianjin Key Laboratory of Quality Marker of Traditional Medicine, Tianjin 300301, China 4. State Key Laboratory of Drug Delivery and Pharmacokinetics, Tianjin Institute of Pharmaceutical Research, Tianjin 300301, China
is a traditional Chinese medicinal material in China, which has both value of edible and medicinal values. It is mainly distributed in the south area of the Yangtze River and produced in Anhui, Guangxi, Sichuan and other places. In recent years, with the wide application ofin medicine and health care products, the research on its multi-types of chemical components and pharmacological effects has been deepened step by step. Based on the review of its chemical composition and pharmacological effects, combined with the definition of quality marker (Q-Marker), this study processed predictive analysis on Q-Marker ofat aspects of plant affinity, component specificity, component availability, component measurability and the effects of processing on chemical composition and so on, which provides a scientific basis for quality evaluation of
; anthraquinones; naphthopyrones; hypolipidemic; quality marker; emodin; rhein; chrysophanol; aloe-emodin; physcion; aurantio-obtusin; cassiaside; cassiaside C; rubrofusarin gentiobioside; cassiaside B2
R284
A
0253 - 2670(2021)09 - 2719 - 14
10.7501/j.issn.0253-2670.2021.09.014
2021-03-20
重大新藥創制專項(2019ZX09201005-001-002);國家中醫藥管理局中藥國際化專項(0610-2040NF020928)
董玉潔,女,碩士研究生。Tel: 18712831252 E-mail: 18712831252@163.com
田成旺 E-mail: tiancw@tjipr.com
陳常青 E-mail: chencq@tjipr.com
[責任編輯 王文倩]

