Cd(II)與As(V)在土壤鐵氧化物和細菌表面上的共吸附研究
尹雪斐 ,楊蕊嘉 ,劉玉玲 ,鐵柏清 *,聶寧 ,杜輝輝
1. 湖南農業大學資源環境學院,湖南 長沙 410128;2. 湖南省灌溉水源水質污染凈化工程技術研究中心,湖南 長沙 410128;3. 農業農村部南方產地污染防控重點實驗室,湖南 長沙 410128
隨著中國經濟和社會的快速發展,土壤重金屬污染尤其是鎘砷復合污染問題非常突出。2014年《全國土壤污染狀況調查公報》顯示,鎘點位超標率為7.0%、砷點位超標率為 2.7%(The Ministry of Environmental Protection,2014)。研究發現,廣東大寶山礦區周邊存在以鎘砷為主的多金屬復合污染,礦區部分稻田中鎘砷最大超標倍數超出土壤環境二級標準值10倍以上(Shan et al.,2017)。此外,周俊馳等(2017)調查結果顯示,湖南株洲某縣耕地土壤受鎘砷復合污染的高風險區域面積達23.23 km2。重金屬和類金屬的共存對生物和生態安全構成的風險高于其單一存在(Huang et al.,2009),直接影響土壤和農產品安全,威脅人體健康。因此,有必要探究鎘砷在共存條件下的生物地球化學行為。
在土壤中,鎘通常以陽離子形式存在,具有失電子趨向;砷多以陰離子形式存在,如 AsO43-、AsO33-,有得電子趨向,兩者在土壤中的固定、遷移以及被植物吸收富集等方面均具有相反的特質(Li et al.,2018)。土壤中的主要活躍組分如礦物和有機膠體,通過吸附解吸、氧化還原和沉淀溶解等過程,影響重金屬的形態、分布和遷移轉化(Alessi et al.,2010)。重金屬和類金屬對不同土壤組分具有不同的親和力。礦物,尤其是金屬氧化物,多攜帶正電荷,表面位點密度高,與陰離子常常通過配位反應形成穩定的內圈絡合物,因此對砷有很好的親和性(Gallegos et al.,2012)。例如,有學者報道砷主要在鐵氧化物表面形成雙齒共角絡合物(Goldberg et al.,2001;Ona-Nguema et al.,2005;Sherman et al.,2003)。土壤有機膠體如微生物、腐殖酸,多攜帶負電荷,且含有較多含氧官能團,吸附絡合陽離子的能力很強,對金屬陽離子有較高的親和力(Bradl,2004;Gadd,1990;Reuter et al.,1977)。例如Du et al.(2017)通過分析EXAFS數據證明,枯草芽孢桿菌和惡臭假單胞菌的羧基均可與Cd(II)結合形成單齒和雙齒復合物。Bai et al.(2019)從FT-IR分析結果得出,枯草芽孢桿菌細胞外蛋白酰胺I和II鍵、C-H、羧基等官能團幾乎都可以與Cu(II)和 Pb(II)結合。
近年來,國內外學者對土壤礦物、有機組分吸附單一金屬或類金屬研究頗多,但較少關注金屬-類金屬復合體系。在單一體系中獲得的吸附規律無法完全適用于多金屬或類金屬復合污染體系,因此進一步探究典型土壤礦物、微生物對金屬-類金屬共吸附特點和機制十分必要。中國南方稻田常常存在鎘砷復合污染,在南方偏酸性土壤中鐵氧化物占固相比例很大。基于此,本研究擬選取一種代表性鐵氧化物,即針鐵礦和一株土壤細菌,借助宏觀批吸附試驗,結合X-射線光電子能譜技術,從宏觀和微觀角度闡釋 Cd(II)-As(V)的共吸附特點和機制,期望獲得土壤鐵氧化物、微生物對 Cd(II)-As(V)共吸附存在普遍規律,為調控其形態和轉化提供理論參考。
1 材料與方法
1.1 針鐵礦制備
針鐵礦制備參考Atkinson et al.(1967)的方法。在聚乙烯塑料杯中裝入 500 mL 0.1 mol·L-1Fe(NO3)3溶液,在不斷攪拌過程中逐滴加入 3 mol·L-1NaOH溶液直至溶液pH為12,隨后將懸液置于60 ℃油浴鍋中老化24 h。用去離子水不斷洗滌礦物,直至電導率小于20 μS·cm-1,烘干、研磨,過100目(孔徑為0.150 mm)篩備用。
1.2 蠟狀芽孢桿菌懸液(Bacillus cereus)制備
該細菌為本實驗保存的一株革蘭氏陽性菌,其GenBank登錄號為 MH 345838(https://www.ncbi.nlm.nih.gov/nuccore/MH345838.1/)。細菌培養采用LB 培養基(酵母提取物 5 g·L-1、氯化鈉 5 g·L-1、蛋白胨10 g·L-1)。將配制好的1 L培養基分裝至3個錐形瓶中,放入高壓滅菌鍋121 ℃滅菌20 min。在無菌操作臺中挑取平板上菌種一環于培養基中,30 ℃恒溫搖床培養 24 h。將菌體離心收集,并用0.1 mol·L-1KNO3(實驗中使用的電解質溶液)沖洗3次。隨后,將細菌懸浮在0.1 mol·L-1KNO3溶液中,取0.5 mL菌懸液烘干測細菌質量,用于計算菌懸液濃度。
1.3 實驗方法
1.3.1 批吸附實驗
用去離子水配制 1000 mg·L-1的 CdCl2、Na3AsO4母液。在等溫吸附實驗中,向50 mL離心管加入一定體積的金屬母液,再將一定量的礦物或細菌懸液加入離心管中,用0.1 mol·L-1KNO3溶液定容至30 mL,混合均勻后使用0.1 mol·L-1NaOH和0.1 mol·L-1HNO3調節pH至6.5。隨后將離心管放入恒溫培養振蕩器,反應12 h后取出,離心、過濾。我們預實驗顯示吸附實驗可在12 h達到平衡。鎘砷濃度的測定使用電感耦合等離子發射光譜(ICP-OES,PerkinElmer Optima 8300)。在一元及二元吸附體系中金屬濃度均設置為0、0.01、0.05、0.1、0.15、0.2 mmol·L-1,吸附劑質量濃度均為 0.05 g·L-1,設置兩組平行試驗。
1.3.2 樣品表征方法
使用掃描電子顯微鏡(FE-SEM/EDX,Quanta F250)觀察針鐵礦、蠟狀芽孢桿菌細胞形貌。首先將樣品固定在25 mL·dm-2戊二醛中,進行一系列乙醇脫水,再于-53 ℃的冷凍干燥機中干燥。
使用KRATOS Axis Ultra X射線光電子能譜儀(Thermo Fisher Scientific,USA)對針鐵礦和蠟狀芽孢桿菌吸附鎘砷前后的樣品進行分析。使用C1s峰(284.8 eV)校準結合能。用軟件包XPSPEAK 41進行數據處理,背景信號用 Shirley方法扣除,采用Lorentzian-Gaussian方法進行分峰擬合。
2 結果與分析
2.1 SEM結果
從掃描電鏡照片可以看出(圖1),針鐵礦是一種納米級別的針狀礦物,主要由針狀晶體構成。蠟狀芽孢桿菌呈桿狀,長約為2 μm,直徑約為0.5—1 μm,有蓬松的表面紋理,表明存在胞外聚合物。因此,形貌及尺寸結果顯示,針鐵礦和細菌可代表土壤中典型的活性膠體組分(<2 μm)。

圖1 針鐵礦(a)、蠟狀芽孢桿菌(b)掃描電鏡照片Fig. 1 Scanning electron micrograph of goethite (a) and Bacillus cereus (b)
2.2 等溫吸附結果
Langmuir模型已被廣泛應用于描述金屬在礦物和細菌表面的吸附過程(Komarek et al.,2015)。表1中的擬合度(R2>0.95)表明,該吸附模型適用于描述Cd(II)、As(V)在針鐵礦和蠟狀芽孢桿菌上的吸附。Langmuir吸附模型(Langmuir,1918)公式如下:

表1 針鐵礦和蠟狀芽孢桿菌對Cd(II)、As(V)吸附的Langmuir模型參數Table 1 Langmuir parameters for the adsorption of Cd(II)/As(V)on goethite and Bacillus cereus

其中:Ce為平衡濃度(mmol·L-1);Qe為平衡濃度下的吸附量(mg·g-1);Qmax為最大吸附容量(mg·g-1);KL為吸附親和力常數(L·g-1)。
圖2為針鐵礦和蠟狀芽孢桿菌對Cd(II)、As(V)的等溫吸附結果。在一元體系中,針鐵礦和蠟狀芽孢桿菌對Cd(II)、As(V)的吸附都是隨平衡濃度的增加而增加,并在一定范圍內增加較快,隨后趨于平緩達到吸附平衡。其中,針鐵礦對Cd(II)的吸附是在 Cd(II)平衡濃度在 0.02—0.04 mmol·L-1間增加最快,對 As(V)的吸附在 0.014—0.021 mmol·L-1間增加最快;蠟狀芽孢桿菌對Cd(II)的吸附是在平衡濃度 0.02—0.053 mmol·L-1間快速增大,對 As(V)的吸附在0.01—0.03 mmol·L-1間快速增加。針鐵礦對 Cd(II)、As(V)的最大吸附量分別為 305.00、1259.82 mmol·kg-1,蠟狀芽孢桿菌對 Cd(II)、As(V)的最大吸附量分別為 1291.64、120.22 mmol·kg-1(表1)。由此可知,針鐵礦對As(V)的吸附能力大于Cd(II),而蠟狀芽孢桿菌對于Cd(II)的吸附能力大于As(V)。

圖2 針鐵礦和蠟狀芽孢桿菌對Cd(II)、As(V)的等溫吸附圖譜,實線為Langmuir擬合線Fig. 2 Isothermal adsorption of Cd(II)/As(V) on goethite and Bacillus cereus Solid lines are the Langmuir fits
在二元吸附體系中,針鐵礦對Cd(II)、As(V)的吸附量均大于單一體系,這表明在針鐵礦表面,Cd(II)-As(V)的吸附存在協同效應;此外,As(V)對Cd(II)的促進率為38.4%,而Cd(II)對As(V)的促進率只有 16.5%。在蠟狀芽孢桿菌表面,As(V)對Cd(II)的吸附幾乎無影響,Cd(II)對As(V)則存在抑制作用(表1)。
2.3 XPS結果
圖3是針鐵礦吸附Cd(II)、As(V)前后的O1s高分辨光譜。對于純針鐵礦,529 eV處的峰歸屬于Fe-O-Fe,531 eV處的峰歸屬于Fe-O-H(Zhu et al.,2019),圖中標注的百分比為每個組分的面積所占總面積的比值。針鐵礦吸附 Cd(II)、As(V)前后的O1s光譜存在明顯差異,吸附金屬后在531 eV處的峰變寬且峰面積增大。在純針鐵礦中,Fe-O-H所占面積比為69.06%,在單一Cd(II)、單一As(V)以及Cd(II)-As(V)復合體系中該組分分別增加3.67%、17.77%、6.32%。這一結果表明,針鐵礦表面Fe-OH與鎘砷發生了絡合反應,可能進一步形成Fe-OCd(As)絡合物。有學者(Lakshmipathiraj et al.,2006)研究發現砷酸鹽可與 Fe-O鍵結合生成 Fe-O-As,而O’ Reilly et al.(2001)研究表明砷酸鹽主要以針狀雙核絡合物的形式吸附在針鐵礦上。此外,針鐵礦在吸附 As(V)后 531 eV處的峰強度增加更加明顯,表明吸附的 As(V)比 Cd(II)更多,這與等溫吸附結果一致。
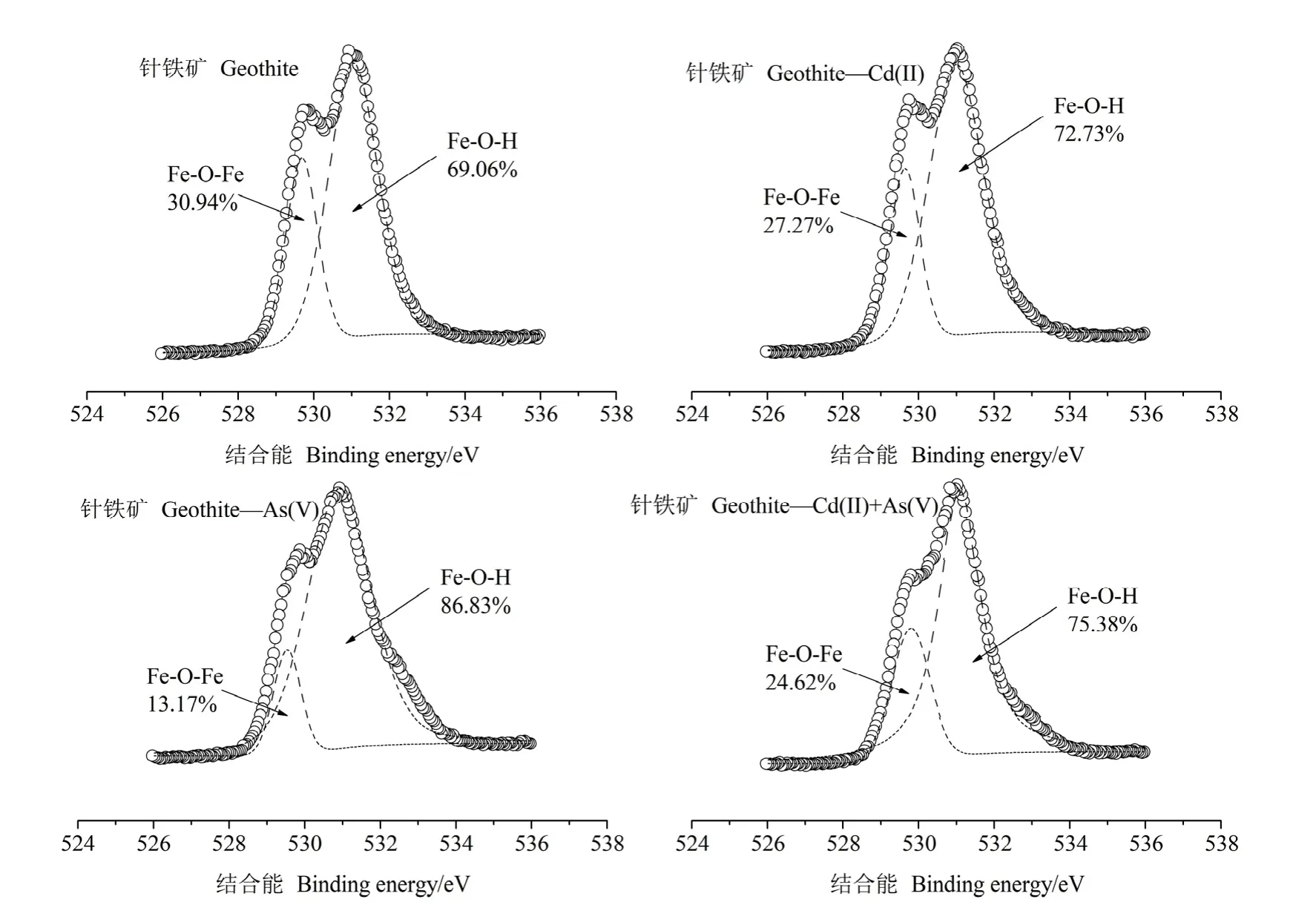
圖3 針鐵礦吸附Cd(II)、As(V)前后的高分辨率O1s XPS光譜Fig. 3 High-resolution O1s XPS spectra of goethite before and after the sorption of Cd(II)/As(V)
圖4是蠟狀芽孢桿菌吸附Cd(II)、As(V)前后的C1s高分辨光譜。對于蠟狀芽孢桿菌,其碳峰可分解為3個部分:288 eV處的峰歸屬于碳與氧形成單鍵或雙鍵(C=O、C-O-C),包括羧酸鹽;286 eV處的峰歸屬于C-(O, H);285 eV處歸屬于C-(O, N),這兩部分主要包括醚,醇,胺和酰胺(Lei et al.,2019)。分析C1s光譜發現,吸附Cd(II)、As(V)前后的蠟狀芽孢桿菌存在明顯差異,即吸附金屬后的蠟狀芽孢桿菌在285 eV處的峰變寬且峰面積增大。在純蠟狀芽孢桿菌中,C=O、C-O-C所占面積比為4.80%,在單一Cd(II)、單一As(V)以及Cd(II)-As(V)復合體系中該組分分別增加9.5%、7.83%、11.91%。Oh et al.(2009)研究表明,施氏假單胞菌吸附金屬的原因是金屬與細菌表面的C=O結合,而Uluozlu et al.(2010)的結果表明,金屬離子與微生物的羧基、羥基和酰胺基的氫原子之間的離子交換主要參與生物吸附。本實驗 XPS結果分析可得到類似的結論,蠟狀芽孢桿菌對Cd(II)、As(V)的吸附主要是與細菌的羧基和酰胺/胺基結合。而且蠟狀芽孢桿菌在吸附Cd(II)后288 eV處的峰強度增加更加明顯,表明吸附的 Cd(II)比 As(V)更多,這與等溫吸附結果一致。

圖4 蠟狀芽孢桿菌吸附Cd(II)、As(V)前后的高分辨率C1s XPS光譜Fig. 4 High-resolution C1s XPS spectra of Bacillus cereus before and after the sorption of Cd(II)/As(V)
3 討論
本研究發現,在針鐵礦體系,Cd(II)-As(V)的吸附存在協同效應,而在細菌體系,As(V)的存在對Cd(II)的吸附影響不大,Cd(II)卻能在一定程度上抑制 As(V)的吸附。分析總結出現這一現象的可能原因如下:針鐵礦在pH 6.5時表面帶正電荷(Wang et al.,2020),有研究表明,Cd(II)、As(V)均可在鐵氧化物表面形成內圈化合物(Collinos et al.,1999;Catalano et al.,2008),當 As(V)絡合在針鐵礦表面,增加了表面負電勢,促進了Cd(II)的靜電吸附,此外吸附態As(V)可能與Cd(II)形成三元絡合物(FeO-As-Cd),進一步促進 Cd(II)的吸附,Jiang et al.(2013)的研究同樣發現針鐵礦表面生成了Cd-As-針鐵礦三元復合物;同理,當Cd(II)通過表面絡合吸附在針鐵礦表面,增加了表面正電勢,進一步為 As(V)創造了更多新的吸附位點,所以 Cd(II)也促進 As(V)在針鐵礦上的吸附。細菌在pH 6.5時表面帶負電荷(Wang et al.,2016),與As(V)存在電荷斥力,因此在細菌體系,表面電勢改變對吸附的影響可能不顯著。由于Cd(II)、As(V)在細菌表面吸附的官能團一致(XPS結果),而細菌對Cd(II)的親和力遠強于As(V)(上文顯示Cd(II)吸附量是As(V)的10倍),因此As(V)對 Cd(II)吸附幾乎沒影響,而 Cd(II)會顯著抑制As(V)吸附。
在中國南方鎘砷復合污染酸性土壤中(pH<6.5),鐵氧化物占固相組分的比例很大(Indika et al.,2017;Du et al.,2016),Cd(II)、As(V)在土壤固相界面的吸附存在顯著協同效應,因此在應用單一體系的吸附規律去預估復合污染體系時,將大大低估土壤膠體對Cd(II)、As(V)的截留。而在土壤微區,如根際界面,微生物含量較多,Cd(II)對As(V)的吸附存在抑制作用,這也表明,運用單一體系吸附規律時將在一定程度上高估了根際土壤對As(V)的截留與固定。Cd(II)與As(V)的共吸附規律在土壤礦物和微生物上存在區別,這也意味著在土壤根際土壤與非根際土壤中有較大差異。因此在預測土壤Cd(II)、As(V)共存規律時也要考慮土壤組成,特別是有機物的含量等因素。綜上,本研究結果可為預測鎘、砷在土壤組分上的遷移轉化行為提供參考,為調控鎘砷形態,對預測鎘、砷在土壤中的生物地球化學循環有一定的參考價值。
4 結論
(1)在等溫吸附中,針鐵礦對As(V)的吸附強于 Cd(II),蠟狀芽孢桿菌對 Cd(II)的吸附強于As(V);
(2)在針鐵礦中,Cd(II)-As(V)的吸附存在協同效應,且 As(V)對 Cd(II)的促進作用強于 Cd(II)對As(V);在細菌體系中,As(V)對Cd(II)的吸附幾乎無影響,Cd(II)對As(V)則存在抑制作用;
(3)針鐵礦通過表面鐵羥基吸附絡合Cd(II)、As(V),形成內圈Fe-O-Cd(As)化合物,而蠟狀芽孢桿菌對于金屬的吸附主要通過表面羧基和酰胺/胺基;在 Cd(II)-As(V)復合體中,可能進一步形成了吸附劑-Cd-As或吸附劑-As-Cd三元絡合物。

