骨相關細胞來源外泌體miRNA調節骨形成的研究進展
劉 波,吳雨蒙,孫煜昕
(江西中醫藥大學藥學院,江西 南昌 330004)
骨骼是一個動態活性組織,它的形成需要各類骨細胞共同參與。骨形成通常始于骨細胞的死亡,釋放的生物活性分子,誘導其他存活的骨細胞分泌核因子κB受體活化因子配體(receptor activator of nuclear factor-κB ligand,RANKL),隨后破骨細胞前體被趨化蛋白招募,核因子κB受體活化因子(receptor activator of nuclear factor-κB,RANK)和RANKL在其表面結合啟動了破骨細胞生成。與此同時,成骨細胞分泌的巨噬細胞集落刺激因子(macrophage-stimulating factor,M-CSF)、單核細胞趨化蛋白l(monocyte chemoattractant protein-1,MCP-1)和RANKL還能募集破骨細胞前體并促進其向破骨細胞分化。破骨細胞吸收破損骨時分泌胰島素樣生長因子(insulin like growth factor,IGF)和轉化生長因子-β(transforming growth factor-β,TGF-β)等耦合因子,可促進成骨細胞對骨骼腔隙的填充,當新礦化的細胞外骨基質完全替代吸收的骨基質時,骨形成過程完成[1]。
近年來,大量文獻顯示,骨組織中的骨髓間充質干細胞(bone marrow-mesenchymal stem cells,BMSCs)、成骨細胞(osteoblast)、破骨細胞(osteoclast)和骨細胞(osteocyte)等產生的外泌體介導了上述骨形成過程。陳長軍等[2]全面地介紹了外泌體在骨以及關節疾病中的作用和在再生醫學領域中的應用,本文則主要介紹骨相關細胞來源外泌體中的miRNA對骨形成的調節作用。
1 外泌體簡介
1.1 外泌體生物學特性外泌體(exosome)是Johnstone等[3]首先在研究網織紅細胞成熟過程中發現的,是一種形似杯狀直徑約30-150 nm的細胞外囊泡(extracellular vesicles,EVs)。其主要來源于細胞膜內出芽形成的多囊泡體(multivesicular bodies,MVBs),經多囊泡體膜與細胞膜融合后釋放到細胞外基質,在外環境中通過受體細胞內吞作用、受體配體相互作用及細胞膜相互融合進行攝取,調節受體細胞的生物學活性[4]。外泌體內容物主要有蛋白質、miRNAs、脂質等[5]。不同來源的外泌體均包含膜轉運融合蛋白(GTPase、Annexins和 flotillin),四跨膜蛋白(CD9、CD63、CD81和CD82)和熱休克蛋白(Hsc70、Hsp 90、Hsp60和Hsp20)等,其中四跨膜蛋白常是區別外泌體與其他細胞外囊泡(微囊泡和凋亡小體)的分子標記物[6]。外泌體脂質雙分子層中富含膽固醇、神經酰胺及鞘磷脂等,可防止外泌體內部的RNA、蛋白質等生物活性物質在細胞外環境中被破壞,通過轉運這些生物信息分子,在細胞間通訊中發揮了重要作用。
1.2 外泌體的應用Welker等[7]發現慢性丙型肝炎患者血清中可溶性CD81水平顯著升高;而Goto等[8]在尋找胰腺癌早期診斷標志物時發現,胰腺癌患者血清外泌體中miR-191、miR-21、miR-451a表達水平比健康人高,上述研究表明,外泌體的分子成分如外泌體相關蛋白和微小RNA等,具有作為分子標記物用于臨床診斷的潛力。外泌體可從血液、尿液、唾液、腦脊液等體液中獲取[9],研究發現,來自人尿干細胞的外泌體可以促進骨形成相關基因OCN、ALP、RUNX2的表達,而通過轉運CTHRC1和OPG抑制破骨的形成[10]。外泌體還具有細胞毒性小、生物相容性好、免疫抑制性低等優點,可作為天然的納米級藥物載體[11]。目前運用外泌體載藥有以下幾種方式[12]:(1)藥物與外泌體共孵育;(2)通過轉染試劑或者電轉染將藥物裝載入外泌體中;(3)藥物與供體細胞共孵育或者轉染供體細胞,供體細胞分泌的外泌體就含有藥物。Aqil等[13]便是直接用姜黃素與外泌體共孵育來獲得載藥外泌體,結果表明,與游離姜黃素相比,載藥外泌體組抗炎活性和抗腫瘤活性更高,提高了姜黃素的生物利用度。
2 外泌體miRNA對骨形成的作用
miRNA是一類非編碼單鏈RNA分子,包含19-25個核苷酸[14]。miRNA不穩定易于降解,外泌體中的miRNA有外泌體的包裹,因而對普遍存在的RNA酶,極端溫度和pH水平具有更好的耐受性甚至可以在細胞外環境中保存較長時間。受體細胞通過質膜融合和胞吞作用攝取外泌體miRNA并發揮其生物學功能[15]。本文將著重描述骨相關細胞來源外泌體miRNA對骨形成的作用。
2.1 骨髓間充質干細胞來源外泌體miRNA對骨形成的作用骨髓間充質干細胞 (BMSCs)是一類具有自我更新和多向分化潛能的干細胞,在特定條件下可以分化為成骨細胞,BMSCs來源的外泌體可以上調生長因子、骨形態發生蛋白2(bone morphogenetic protein2,BMP2)和TGF-β1,還能使miRNA表達譜朝成骨細胞譜系分化促進骨形成。Xu等[16]首次對人骨髓間充質干細胞成骨分化過程中外泌體miRNA的表達譜進行分析,研究結果顯示,let-7a、miR-199b、miR-218、miR-148a、miR-135b、miR-203、miR-219、miR-299-5p和miR-302b表達水平顯著升高,而miR-221、miR-155、miR-885-5p、miR-181a和miR-320c表達水平顯著降低;對miR-885-5p進一步研究表明,miR-885-5p通過抑制Runx2從而抑制成骨細胞相關基因的表達,可作為BMSCs成骨分化的負調控因子。而Qin等[17]研究表明BMSCs源性外泌體miR-196a在體外能上調成骨相關基因ALP、OCN、OPN和RUNX2的表達從而影響成骨細胞的分化,體內實驗結果顯示了BMSCs來源外泌體可以增加顱骨缺損的SD大鼠的骨形成。Wang等[18]對人骨髓間充質干細胞成骨分化各階段分泌的外泌體進行研究,發現成骨分化后期外泌體miRNA的表達存在顯著差異,miRNA表達譜分析揭示了外泌體miRNA表達的變化,其中成骨分化負調控因子miR-31、miR-221和miR-144表達水平顯著降低,成骨分化正調控因子miR-21則顯著升高,表明這些外泌體miRNA參與了成骨分化的調節。以上研究說明,BMSCs源性外泌體miRNA在成骨細胞分化和成骨基因表達的調控中起著至關重要作用,進而影響骨形成。
2.2 破骨細胞來源外泌體miRNA對骨形成的作用在骨形成過程中,除了眾所周知的成骨細胞通過RANK/RANKL途徑調節破骨細胞生成及骨吸收以外,越來越多的證據表明破骨細胞可以通過ephrinA2/EphA2途徑等直接方式或旁分泌等間接方式調節成骨細胞的活動。外泌體miRNA經過旁分泌途徑參與成骨細胞和破骨細胞間的信息傳遞。破骨細胞分泌的富含miR-214-3p的外泌體可定向運輸至成骨細胞中,體外實驗結果表明破骨細胞源性外泌體miR-214-3p通過靶向成骨轉錄因子ATF4抑制成骨細胞活性進而抑制骨形成。實時熒光定量PCR結果顯示用破骨細胞源性外泌體miR-214-3p處理的小鼠成骨標志基因ALP、OPN、BSP和BGLAP的mRNA水平顯著降低,顯微CT分析顯示骨質量降低和骨小梁結構紊亂,這些結果闡明破骨細胞源性外泌體miR-214-3p可以抑制體內骨形成[19]。
另一項研究表明,破骨細胞分泌的外泌體miR-23a-5p通過靶向RUNX2來抑制成骨細胞的分化。該實驗顯示破骨細胞源性外泌體miR-23a-5p會抑制成骨細胞的活性,運用N-SMase抑制劑GW4869及Rab27a siRNAs抑制外泌體的釋放,發現破骨細胞源性miR-23a-5p對成骨細胞的抑制作用減弱了,提示外泌體對miR-23a-5p作用的發揮具有重要作用;此外,還進一步探討了破骨細胞源性外泌體miR-23a-5p抑制成骨細胞功能的具體機制,研究結果證明了miR-23a-5p可以靶向抑制成骨分化相關基因RUNX2的表達,通過調控下游信號通路(RUNX2-MT1DP- RUNX2反饋通路)影響成骨細胞分化,進而影響骨形成[20]。
2.3 成骨細胞來源外泌體miRNA對骨形成的作用在Cui等[21]的一項研究中,他們發現成骨細胞可以釋放出含有成骨性miRNA的外泌體,這些外泌體被骨髓基質細胞(ST2)攝取,從而促進了骨髓基質細胞向成骨細胞分化。此外,該研究顯示轉移成骨細胞外泌體后受體ST2細胞中miRNA譜發生顯著改變,計算機模擬數據表明,這些改變的miRNA可能會影響調控成骨細胞分化和功能的多個重要途徑,例如Wnt信號途徑,胰島素信號途徑,TGF-β信號途徑和鈣信號途徑。進一步研究證明了成骨細胞來源的外泌體通過激活Wnt信號通路抑制ST2細胞中Axin1表達并增加β-catenin表達來促進成骨。總之,該研究表明成骨細胞來源外泌體通過轉移miRNA影響受體ST2細胞向成骨細胞的分化,進而影響骨形成。
2.4 骨細胞來源外泌體miRNA對骨形成的作用Qin等[22]在研究骨骼與肌肉的相互作用時發現,肌肉細胞分泌的細胞因子(肌生長抑制素)可以促進骨細胞中成骨抑制基因(SOST,DKK1和RANKL)的表達,同時抑制miR-218在Ocy454細胞和其衍生的外泌體中的表達,表明肌生長抑制素(myostatin)通過抑制骨細胞來源的外泌體miR-218抑制成骨細胞的活性及其分化,暗示骨細胞源性的外泌體miR-218可以促進成骨細胞分化。該實驗結果顯示,經肌生長抑制素修飾的骨細胞源性外泌體抑制了Wnt/β-catenin信號通路,從而抑制成骨細胞的分化和活性。將肌生長抑制素修飾的骨細胞源性外泌體與成骨細胞共培養時發現,共培養組中促進成骨細胞分化的關鍵調節因子RUNX2和骨鈣素的mRNA表達下調,抑制成骨細胞分化的調節因子SOST mRNA表達上調;轉染的外源性miR-218通過抑制SOST可完全逆轉肌生長抑制素修飾的骨細胞外泌體對成骨細胞分化的抑制作用,證明骨細胞所分泌的富含miR-218的外泌體能夠通過激活Wnt信號通路抑制SOST的表達來促進成骨細胞的分化。
2.5 外泌體其他生物活性分子對骨形成的作用外泌體內含物除了miRNA以外,還有蛋白質、脂質及其他生物活性分子,這些生物活性分子也會影響骨形成。最近蛋白質組學研究表明,成骨細胞來源的外泌體包含大量蛋白質,這些蛋白質在成骨相關信號通路如整聯蛋白信號通路、mTOR信號通路和真核起始因子2(EIF2)信號通路中高度富集,可能對成骨產生影響[23]。成骨細胞分泌的富含RANKL的外泌體可以靶向運輸至單核細胞,在單核細胞表面與RANK結合從而激發破骨細胞形成,間充質干細胞分泌的外泌體通過上調Nfatc1、Trap和Ctsk的表達可以增強這一過程,隨后破骨細胞分泌的耦合因子可以促進成骨細胞骨形成,從而構成了一個正反饋通路[1]。
3 小結與展望
外泌體調節骨形成是一個受多種因素影響的復雜過程。骨相關細胞來源的外泌體可以通過調節成骨分化基因(ALP、RUNX2等)、成骨抑制基因(SOST,DKK1和RANKL)以及Wnt/β-catenin信號通路等機制來影響成骨細胞的活性和功能(Fig 1)。目前,骨相關細胞來源外泌體中miRNA作用的靶點尚不明確,盡管計算機模擬數據表明這些外泌體miRNA可以參與調節Wnt信號途徑,胰島素信號途徑,TGF-β信號途徑和鈣信號途徑,但是缺少相關文獻資料,對其進行驗證的研究也較少。因此進一步的研究需深入關注外泌體miRNA發揮調節骨形成的作用靶點。此外,大量文獻顯示,骨相關細胞中的外泌體不僅可以介導生理情況下骨髓微環境內的細胞間通訊,還參與了骨骼疾病的病理過程。霍春暉等[24]對骨質疏松癥患者血清外泌體的蛋白質組學進行研究時發現Integrinβ3、Integrinα2β1、Talin 1和Gelsolin等17個蛋白質的表達量在骨質疏松癥組和骨量減少組有顯著改變;杜昱和等[25]對骨量減少患者血清外泌體中miRNA進行篩選,結果顯示34個miRNA有顯著差異。所以,研究在生理及病理條件下骨相關細胞中外泌體的變化情況及其作用的靶點,對闡明骨質疏松癥發生發展的分子機制具有重大意義。
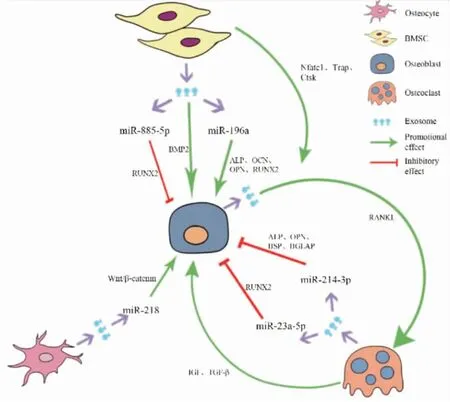
Fig 1 Effects of miRNA in exosomes derived from bone-related cells on osteoblasts
為了逐步實現中醫藥現代化,促進中醫藥事業的發展,中醫藥與外泌體相結合為其提供了新的研究思路。有研究表明,中藥可以引起外泌體內含物的改變,進而發揮調控疾病的作用。Yang等[26]研究顯示,補陽還五湯干預后間充質干細胞來源的外泌體可以促進內皮細胞中血管內皮生長因子的表達,而且補陽還五湯可以上調外泌體中miR-126的表達并下調miR-221和miR-222的表達,進而增加大鼠腦中的血管生成。張小藝等[27]研究表明梓醇可以促進神經母細胞瘤細胞分泌外泌體且梓醇修飾的外泌體可以保護神經;Wei等[28]研究表明紫草素通過下調腫瘤來源外泌體miR-128的表達抑制乳腺癌MCF-7細胞的增殖等。綜上,中藥能夠改變外泌體的分泌并發揮重要調控作用從而影響疾病的進程。目前,關于中醫藥通過外泌體對骨質疏松癥等疾病作用的報道較少,我們前期研究表明二仙湯防治骨質疏松與促進大鼠骨髓間充質干細胞增殖和骨向分化有關[29],且BMSCs源性外泌體能使miRNA表達譜朝成骨細胞譜系分化[18],但二仙湯對BMSCs來源外泌體的作用尚不清楚。從外泌體角度探討中醫藥防治疾病的分子機制將是未來研究方向之一。

