社區人群腦微出血與基底節區核團體積的相關性研究
蘇寧,王全,梁新宇,韓菲,周立新,姚明,崔麗英,龔高浪,朱以誠,倪俊
腦微出血(cerebral microbleeds,CMBs)是腦內微小血管病變導致的以血管周圍含鐵血黃素沉積為主要特征的一種腦實質損害[1]。CMBs是腦小血管病的影像標志物之一,在梯度回波T2*WI或SWI上顯示為邊界清晰的圓形或類圓形低信號灶[2],為局灶性含鐵血黃素沉積。根據解剖部位,CMBs可分為局限皮層CMBs以及深部/混合CMBs[3-6]。不同部位的CMBs,代表不同形式的病理改變,局限皮層CMBs病理上主要與腦淀粉樣血管病相關,而深部/混合CMBs主要與高血壓相關[7-8]。
腦體積是反映整體神經功能的重要標志,隨著年齡增長,腦體積逐漸減小,特定的病理條件可加速年齡以外的腦萎縮進程[9],因此整體的腦萎縮從宏觀角度反映了整體神經功能的退化。腦萎縮病理改變包括神經元丟失、皮層變薄,皮質下血管病變伴腦白質稀疏和萎縮,小動脈硬化、靜脈膠原變性和繼發性神經退行性改變等[7]。腦血管病理改變可通過影響腦體積而進一步影響認知及運動等神經功能。既往研究提出,腦萎縮可單獨預測卒中或癡呆的發生[10-11]。因此,腦萎縮是反映整體神經功能的重要指標。
關于腦小血管影像改變與腦體積或腦萎縮的相關性研究,多集中在缺血性影像改變,如腦白質高信號、腔隙,與皮層或皮層下結構的相關性,關于CMBs與腦體積的相關性研究較有限[12-13]。在遺傳性腦淀粉樣變性患者中發現,血管淀粉樣變是導致皮層萎縮的獨立危險因素[12]。北京順義社區人群隊列研究曾報道,CMBs負荷與皮層下白質及海馬體積負相關,并提出海馬萎縮可能是連接腦小血管病出血性病理改變與神經退行性改變的一個橋接因素[13]。國際及國內關于CMBs與基底節區核團體積的相關性研究較少。基底節區核團包括尾狀核、殼核、蒼白球、丘腦等,對運動控制及運動調節起著重要的作用[14-18]。顱內微出血病變是否會引起深部黑質核團的結構改變,進一步影響運動控制及感覺傳導等運動相關的功能改變,尚未可知。本研究旨在探討CMBs的部位及負荷與基底節區核團體積的相關性,為探討CMBs相關的腦結構及臨床神經功能改變提供更多的證據。
1 對象與方法
1.1 研究對象 順義研究是北京順義地區基于社區人群的長程隊列研究,該隊列的研究目的是探討中國社區人群腦改變的危險因素及結局[19]。研究納入順義地區大孫各莊鎮5個村(東尹家府、西尹家府、陀頭廟村、趙家裕村、小段村)年齡≥35歲且能夠獨立生活的受試者。基線信息的采集從2013年6月-2016年4月。本研究獲得北京協和醫院倫理審核會的批準(批準號:B-160),受試者均自愿簽署知情同意書。
納入標準:①年齡≥35歲,且能獨立生活;②已完善基線頭顱MRI檢查,且影像質量良好。
排除標準:①既往卒中病史;②缺乏認知數據或被診斷為癡呆。
1.2 研究方法
1.2.1 資料收集 基線評估內容包括標準結構化問卷、體格檢查、頭顱MRI檢查等[20-21]。應用統一設計的調查問卷收集所有受試者的基本臨床資料,包括年齡、性別、受教育程度、身高、體重、血壓、吸煙史、飲酒史、用藥史及腦血管病危險因素等。量表信息收集及體格檢查均由經過培訓的神經內科醫師完成。
1.2.2 腦血管病危險因素的評估 滿足以下任意一項者定義為高血壓:基線收縮壓≥140 mmg Hg或舒張壓≥90 mm Hg;既往診斷為高血壓;服用降壓藥;隨訪中出現新發高血壓。滿足以下任意一項者定義為糖尿病:既往診斷糖尿病;空腹血糖≥7.0 mmol/L;目前服用降糖藥或接受胰島素治療;隨訪過程中出現新發糖尿病。滿足以下任意一項者定義為高脂血癥:TC>5.2 mmol/L;LDL-C>2.58 mmol/L;目前服用降脂藥治療;既往診斷為高脂血癥。目前吸煙:最近1個月有吸煙。目前飲酒:最近一個月有飲酒,至少每周1次。
1.2.3 腦小血管病影像負荷評估 所有受試者圖像均使用同一臺3T MRI掃描儀(Skyra,Siemens,Erlangen,Germany),由放射科醫師負責數據采集,圖像采集時間2014年7月-2016年4月。一致性評估:每項腦小血管影像學指標由一名神經科醫師評估完成,1個月以后隨機抽取50名受試者的影像資料,計算評估者內一致性。腔隙的Kappa值為0.95,CMBs的Kappa值為0.9,基底節區和白質區血管周圍間隙(perivascular spaces,PVS)評分的Kappa值分別為0.71和0.61。腦白質高信號自動分割與手工半自動標注的DICE系數為0.62。
(1)CMBs:使用SWI評估CMBs情況。SWI參數:重復時間20 ms,回波時間27 ms,視野200 mm×220 mm,層厚1.5 mm,翻轉角15 °,共80張軸位圖像。CMBs在SWI上表現為小圓形或卵圓形、邊界清楚、均質性信號缺失灶,直徑不超過10 mm,病灶至少50%被腦實質圍繞,排除鐵或鈣沉積、骨質、血管流空影及彌漫性軸索損害等[1]。按照有無CMBs,將受試者分為無CMBs和有CMBs組;按照CMBs負荷分組,分為無CMBs、1~2個CMBs及≥3個CMBs組;按照CMBs部位分組,分為無CMBs、局限皮層CMBs及深部/混合CMBs組。僅有皮層CMBs,定義為局限皮層CMBs;有深部CMBs,伴或不伴皮層CMBs,定義為深部/混合CMBs。
(2)腦白質高信號:位于腦白質區域內,T1WI呈等信號或低信號,T2WI及FLAIR上呈高信號,不同于腦脊液信號。應用SPM12軟件和LST工具包進行腦白質高信號自動分割及容量計算。
(3)腔隙:直徑為3~15 mm,邊界不光滑的液化病灶,分布于基底節區、腦白質及腦干,在全部序列上呈腦脊液信號。腔隙在3D-T1WI上評估,需與血管周圍間隙鑒別。
(4)PVS:在全部MRI序列上均顯示為腦脊液信號;直徑一般<3 mm。根據解剖部位,PVS分為基底節區PVS(PVS in basal ganglia,PVS-BG)和皮層下白質區PVS(PVS in white matter,PVS-WM)。PVS-BG的分級標準如下:1級,PVS≤5個;2級,6~10個;3級,>10個但仍可數;4級,不可數,導致篩孔樣改變[22]。PVS-WM分級:1級,PVS總數≤10個;2級:PVS總數>10個且在包含最大數量PVS的層面≤10個;3級,在包含最大數量PVS的層面為11~20個;4級,在包含最大數量PVS的層面>20個[22]。重度PVS-BG定義為:PVS-BG評分3級或4級;重度PVS-WM定義為:PVS-WM評分3級或4級。
1.2.4 基底節區核團體積提取
(1)顱內總體積:應用S P M12 軟件及CAT12工具包在3D T1WI圖像上進行腦結構自動分割,計算腦灰質、腦白質和腦脊液體積。顱內總體積是腦灰質、腦白質及腦脊液三者容量之和。
(2)基底節區核團體積:應用CIVET軟件可以對腦影像數據進行自動化分析。通過使用FIRST皮層下核團計算軟件完成皮層下核團(尾狀核、蒼白球、殼核、丘腦)體積的提取[23]。在分析中,尾狀核、蒼白球、殼核、丘腦的體積分別是左右側核團體積之和的平均值,整體基底節區體積為左右側尾狀核、蒼白球、殼核、丘腦體積之和的平均值。統計分析通過工具包SurfStat完成。基底節、尾狀核、蒼白球、殼核、丘腦體積分數分別定義為相關部位體積所占顱內總體積的百分比,具體公式為:(基底節體積÷顱內總體積)×100%。
1.2.5 統計學方法 比較CMBs不同分組間基本流行病學信息、腦血管病危險因素、腦小血管病影像負荷及腦體積參數的差異。計數資料用頻數和率(%)進行描述,兩組及多組間的比較采用χ2檢驗。符合正態分布的計量資料用描述,兩組間比較采用t檢驗或秩和檢驗,多組間比較采用方差分析。對于多因素分析,采用廣義線性模型評估CMBs(無CMBs、1~2個局限皮層CMBs、≥3個局限皮層CMBs、1~2個深部/混合CMBs及≥3個深部/混合CMBs)與基底節區核團體積分數(基底節、尾狀核、蒼白球、殼核、丘腦)的相關性。模型1:校正年齡、性別;模型2:校正年齡、性別、高血壓、腦白質高信號體積及腔隙。分析結果用β(SE)來呈現,用偽發現率(false discovery rate,FDR)進行多重校正。使用SAS 9.4軟件進行統計分析,P<0.05為差異有統計學意義。
2 結果
2.1 一般資料 總人群共1844例,剔除未完成MRI檢查或影像質量不佳、既往卒中病史、未完成認知測試或癡呆受試者,最終納入分析997例(圖1)。納入分析人群平均年齡56.7±9.3歲,其中男性占34.7%;無CMBs的受試者共903例(90.6%),有CMBs的受試者共94例(8.4%)。
2.2 基底節區核團體積在不同腦微出血組間的差異
(1)有無CMBs組:相比無CMBs組,有CMBs組年齡更大、男性比例更高、高血壓所占比例更高,腦白質高信號體積及腔隙所占比例較高,基底節區、蒼白球、尾狀核及丘腦體積所占總腦體積的百分比較低,差異均具有統計學意義(表1)。
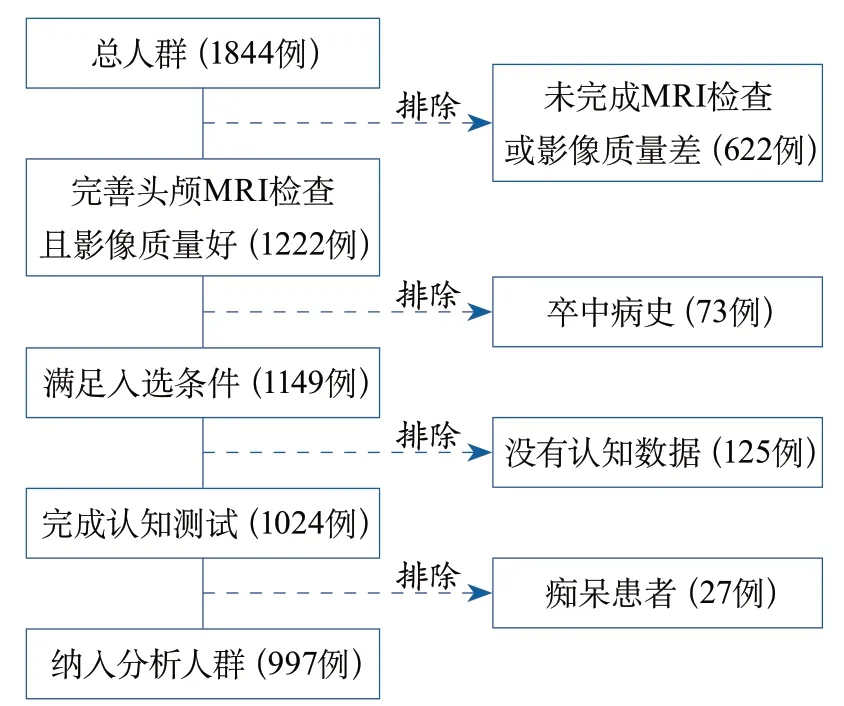
圖1 入組流程圖
(2)不同CMBs負荷組:無CMBs組903例,1~2個CMBs組73例,≥3個CMBs組21例;年齡、男性比例、目前飲酒所占比例、高血壓所占比例、腦白質高信號體積、腔隙所占比例,以及基底節區、蒼白球、尾狀核和丘腦體積所占總腦體積的百分比在三組間差異有統計學意義(表2)。
(3)不同CMBs分布組:無CMBs組903例,局限皮層CMBs組48例,深部/混合CMBs組46例;年齡、男性比例、高血壓所占比例、腦白質高信號體積、腔隙所占比例,以及基底節區、蒼白球、尾狀核和丘腦體積所占總腦體積的百分比在三組間差異有統計學意義(表3)。
2.3 腦微出血與基底節區核團體積的相關性多因素模型分析發現,與無CMBs相比,≥3個深部/混合CMBs與蒼白球體積負相關;使用FDR方法對結果進行多重校正,差異仍具有統計學意義。≥3個深部/混合CMBs雖與基底節體積、丘腦體積相關,但該相關性校正高血壓及缺血性腦小血管病影像標志物(腦白質高信號、腔隙)后無統計學意義(表4)。
3 討論
本研究主要探討CMBs部位及負荷與基底節區核團體積的相關性。本研究發現CMBs及負荷與腦體積存在相關性。進一步多因素分析顯示:較高負荷的深部/混合CMBs(≥3個)與較小的蒼白球體積緊密相關,該相關性獨立于腦血管病危險因素(高血壓)及腦小血管病缺血性影像改變(腦白質高信號及腔隙)。
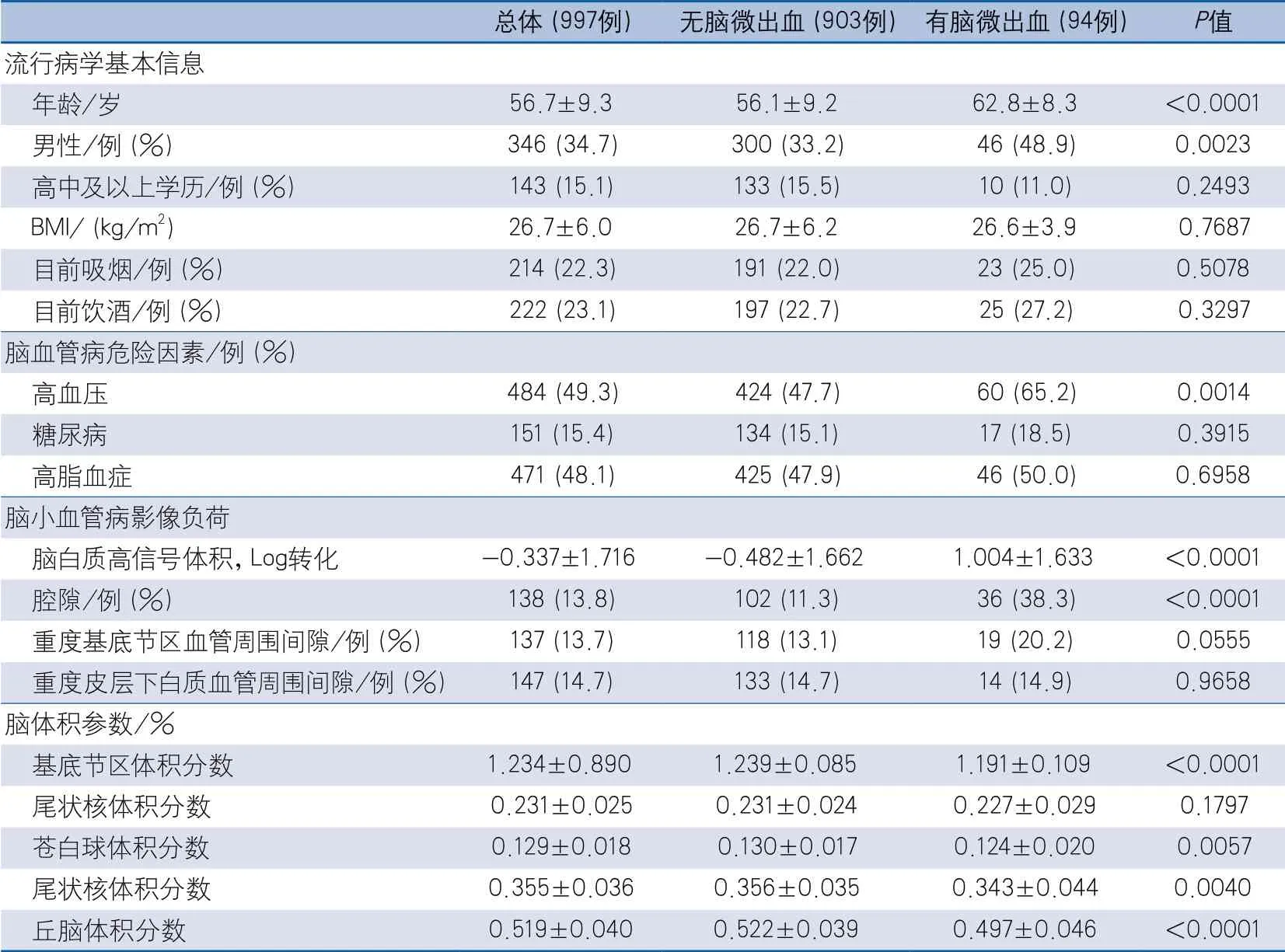
表1 基底節區核團體積在有無腦微出血組的情況
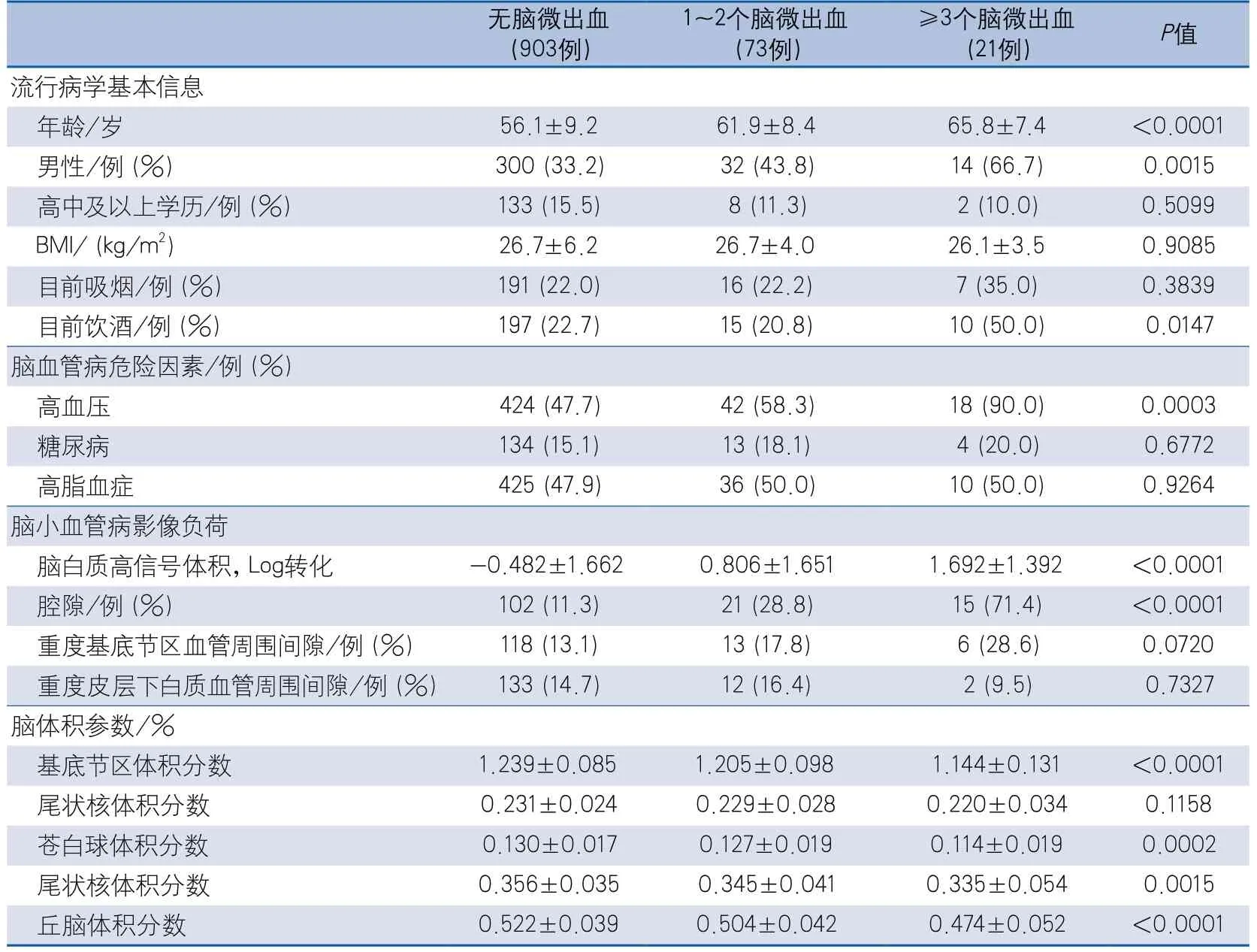
表2 基底節區核團體積在不同腦微出血負荷組的情況

表3 基底節區核團體積在不同腦微出血分布組的情況
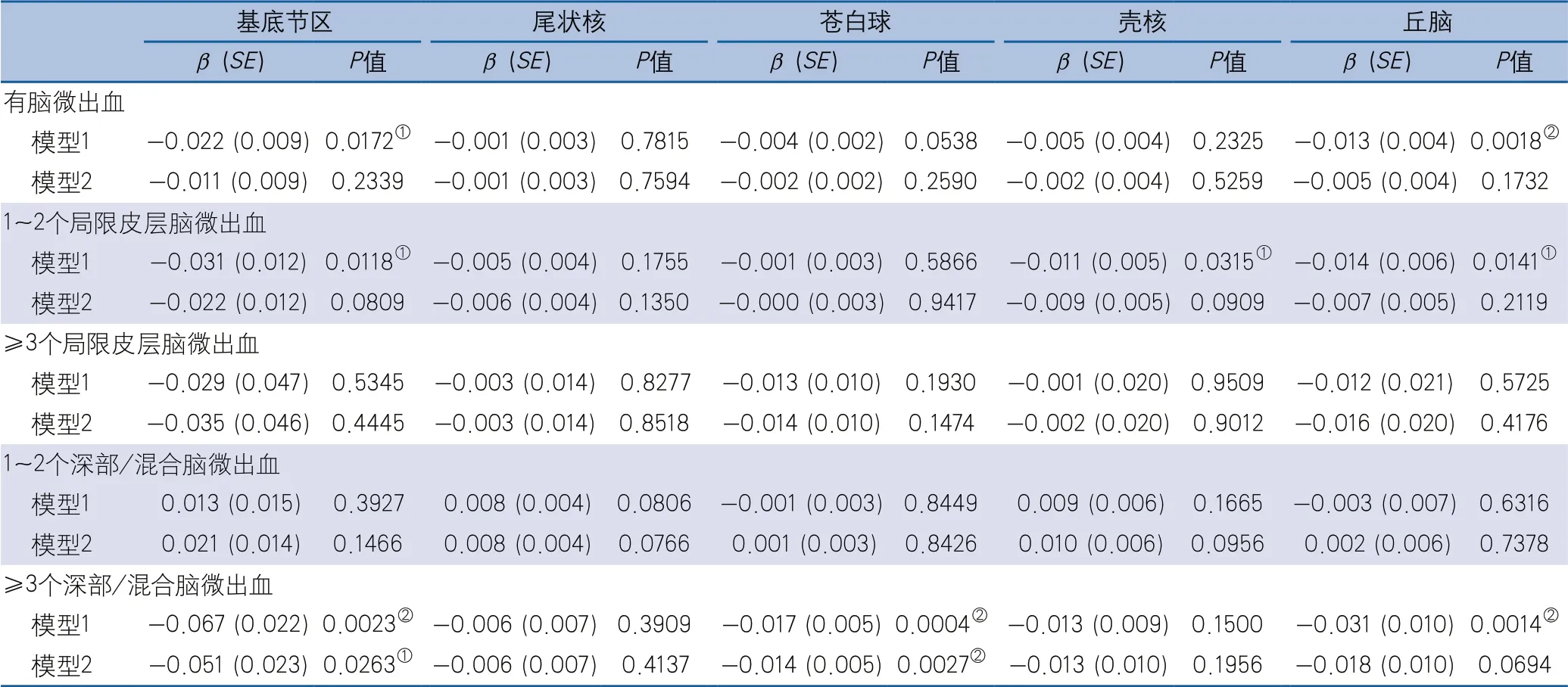
表4 多元線性模型分析腦微出血與基底節區核團體積的相關性
既往有研究探討CMBs與腦萎縮的相關性,腦結構方面主要集中在皮層[12]、皮層下白質或海馬等結構[13,24]。皮層CMBs被認為是腦血管淀粉樣變與卒中、腦老化、癡呆和阿爾茨海默病之間的特殊聯系,而深部CMBs被認為與高血壓緊密相關[25]。順義社區人群隊列研究發現無論是局限皮層CMBs還是深部/混合CMBs,當CMBs負荷增高(≥3個),皮層下白質體積相對較小[13],該研究結果可通過既往阿爾茨海默病隊列研究的發現來解釋,即多發CMBs可能造成白質纖維束完整性破壞,進一步引起皮層下白質纖維束的萎縮和體積減小[24]。研究的另外一個發現是高負荷的深部CMBs,在高血壓共同介導因素下,可同時引起海馬神經元退化而造成海馬萎縮[13]。因此,不同部位的CMBs及腦結構改變,可能意味著不同的病理生理機制參與其中,而臨床結局也有所不同。
本研究發現較高負荷的深部/混合CMBs與蒼白球體積呈現負相關。機制考慮以下幾點:①腦深部CMBs與長期高血壓相關。高血壓作為大小血管病共同高危因素發揮作用。一方面,長期高血壓導致小動脈纖維玻璃樣變,從而繼發影像學可視的深部CMBs;另一方面,蒼白球血供來自脈絡膜前動脈、大腦中動脈和大腦前動脈,其中大腦中動脈的穿支動脈提供了蒼白球大部分的血液供應[26]。長期高血壓可導致穿支動脈供血區低灌注,從而繼發神經元供血不足而出現萎縮。②從神經功能角度來講,基底節區核團主要參與四種神經功能環路,包括運動環路(涉及運動前區、輔助運動區、初級運動區)、動眼神經環路(涉及大腦皮層的額葉和輔助視野區)、執行關聯環路以及情感環路(即邊緣系統環路)[27]。基底節區存在廣泛的聯系纖維,其神經環路包括內部傳入及傳出通路。來自皮層的興奮性傳入信號傳至新紋狀體(尾狀核、殼核)及丘腦底核,基底節區內部的抑制性傳出信號主要由殼核傳至蒼白球,而又由蒼白球傳至丘腦及中腦腳間核。基底節區的神經核團如丘腦、殼核等,直接與皮層神經元形成廣泛的聯系,而蒼白球的神經纖維聯系相對局限。從神經纖維聯系的角度講,蒼白球較其他基底節區核團更依賴局部的神經信息傳遞,其中包括信號及營養傳遞。作為出血性的影像學標志物,雖然CMBs對局部腦結構的破壞性不強,但深部CMBs繼發的局部代謝改變,可能對神經元的代謝起到一定的負面影響,而蒼白球比其他核團對局部微環境改變適應性更差。因此蒼白球神經元可能較其他神經核團更易出現體積減小或萎縮改變。此外,既往研究顯示社區居住人群的蒼白球萎縮與步基增寬相關[16],本研究中蒼白球體積減小可能參與步態障礙形成的病理生理過程。但蒼白球體積減小是否介導了臨床功能損傷,仍需進一步證實。
本研究具有一定的局限性。首先,本研究是一個橫斷面研究,推斷因果關系具有局限性,需要長程研究驗證本文的研究結論。其次,本研究的研究對象為社區人群,相關結論無法推廣至癥狀性腦小血管病患者。本研究發現高負荷的深部/混合CMBs與較小的蒼白球體積相關,需長程研究進一步證實基線的深部/混合CMBs與基底節區核團萎縮的相關性。
【點睛】本研究顯示腦微出血負荷與深部灰質核團體積緊密相關,提示腦小血管病的出血性影像改變可能會加速或加重亞臨床神經功能缺失。

