異鼠李素通過減輕氧化應激改善游離脂肪酸誘導肝細胞脂質沉積
周健,杜鳳,康秉文,殷草草,蔣杉,石瑩,王玥,周耿瑤,秦緒軍*,王楓*(.空軍軍醫大學軍事預防醫學系 軍隊健康教育與管理教研室,西安 7003;.陜西中醫藥大學公共衛生學院,陜西 咸陽 7046)
非酒精性脂肪肝病(non-alcoholic fatty liver disease,NAFLD)是指在非過度飲酒的情況下,肝臟發生的脂質沉積現象,并排除藥物、自身免疫、病毒等因素造成的肝臟疾病[1],以過量的三酰甘油(triacylglycerol,TG)在肝臟中聚積為特征[2]。NAFLD 已成為全世界人們在慢性病領域關注的焦點,我國預計在2030年成為NAFLD導致肝臟相關疾病死亡率最高的國家[3]。對于目前重癥NAFLD 患者而言,除了改變不健康的生活方式之外,急需能夠有效治療NAFLD 的藥物。NAFLD 發病機制復雜,致病因素眾多。目前“多重打擊學說”認為形成NAFLD 的因素包括肝臟TG 沉積,胰島素抵抗(insulin resistance,IR),自噬能力減弱,炎性因子刺激以及氧化應激(oxidative stress,OS)等[4]。有研究表明,當大量活性氧(reactive oxygen species,ROS)發生OS 時,線粒體功能受到抑制,核因子相關因子2(NF-E2-related factor 2,Nrf2)與其內生的抑制劑Kelch 樣ECH 相關蛋白1(Kelch-like ECHassociated protein 1,keap1)的分離可能會受到抑制,影響抗氧化基因表達,形成惡性循環,使細胞功能受損,誘發脂質沉積[5]。因此抗氧化是防治NAFLD 的重要研究內容之一。
異鼠李素(isorhamnetin,Iso)由沙棘中分離而得,是黃酮類化合物槲皮素的直接代謝產物之一[6]。沙棘具有緩解咳嗽,促進食欲的功效,被廣泛用于治療輕癥的呼吸系統炎癥、高原肺病、食欲不振等[7]。近幾年,異鼠李素更是被證明具有保護心血管、抗炎、調節免疫、抗腫瘤、緩解肝臟纖維化等多種作用[8-11]。此外,異鼠李素抗氧化能力較強[9,12-13],能調節Nrf2 通路,從而增強血紅素加氧酶1(HO-1)、谷氨酸半胱氨酸連接酶修飾亞基(GCLM)、谷氨酸半胱氨酸連接酶催化亞基(GCLC)等抗氧化基因的表達,緩解超氧化物歧化酶(SOD)過分消耗,減少ROS產生,從而緩解OS,起到抗氧化保護作用[14-15]。異鼠李素是否可以通過調節Nrf2 通路來緩解OS造成的損傷從而減輕NAFLD,尚不明確。本研究采用游離脂肪酸(FFA)構建體外脂質沉積模型,觀察異鼠李素對細胞產生的ROS、抗氧化系統以及TG 沉積的變化影響,初步探討異鼠李素抗NAFLD 的可能性及其分子機制。
1 儀器與試藥
1.1 儀器
二氧化碳孵育箱(美國Thermo);紫外線超凈臺(江蘇蘇凈安泰);臺式離心機(陜西環宇);CKX41 倒置顯微鏡(日本Olympus);高速冷凍離心機5424 R(德國Eppendorf);Infinite200 PRO 全波長多功能酶標儀(德國Tecan);流式細胞儀(美國BD);Trans Blot Turbo 蛋白轉印系統、蛋白電泳儀、凝膠成像系統(美國Bio-Rad)。
1.2 試藥
異鼠李素(美國TargetMol,純度≥98%,批號:T2836);胎牛血清(FBS)、DMEM 高糖培養基(美國Gibco);蛋白定量分析試劑盒(美國Thermo);青-鏈霉素溶液(上海源培);油紅O、熒光探針(美國Sigma);過氧化氫酶(CAT)試劑盒、總SOD 試劑盒(上海 Beyotime);蘇木精(珠海貝索);TG 試劑盒(日本Wako);CCK-8試劑盒(上海漢恒);漿蛋白核蛋白提取試劑盒、丙二醛(MDA)試劑盒(江蘇凱基);Actin、CAT、SOD1、GPx1、GCLM 兔 抗單 克隆抗 體、SOD2 鼠抗單克隆抗體(美國Santa Cruz);Nrf2兔抗單克隆抗體(武漢 Proteintech);GCLC 兔抗單克隆抗體(南京巴傲德);HO-1 兔抗單克隆抗體(英國Abcam);ML385(美國TargetMol)。
2 方法
2.1 L-02 細胞培養與處理
人肝L-02 細胞(由中科院上海細胞庫購買)接種于含10% FBS、1%青-鏈霉素的DMEM 高糖培養基中,在37℃、5% CO2的孵育箱中培養。取處于對數生長期細胞,均勻接種于96 孔板(用于CCK-8 實驗)與6 孔板(用于蛋白水平表達等其他測定)中。油酸與棕櫚酸按2∶1 的比例溶于BSA中配制成FFA[14]。將細胞分為3 組:對照(control)組,FFA 組,FFA +Iso 組。其中FFA 濃度為0.6 mmol·L-1,異鼠李素濃度為10 μmol·L-1,共處理7 d。每組設立3 個平行樣。
2.2 細胞活力檢測
采用CCK-8 細胞增殖試劑盒檢測細胞活力。取對數生長期細胞按說明書均勻接種于96 孔板,分別給予0、5、10、20、40、80 μmol·L-1的異鼠李素培養24 h,再用10 μL CCK-8 溶液進行反應,37℃孵育2 h,在450 nm 處測定吸光度。
2.3 油紅O 染色
油紅O 充分溶于異丙醇中,過濾后配制5 g·L-1的儲存液,與超純水按3∶2 混合,過濾后配制成油紅O 工作液。4%多聚甲醛處理細胞30 ~60 min 用于固定,60%異丙醇孵育3 min,油紅O 工作液孵育5 min。蘇木素孵育1 min 后進行清洗,直到呈現紫藍色,顯微鏡下觀察[15]。
2.4 細胞TG 檢測
采用TG 試劑盒,通過GPO-DAOS 法測定細胞中TG 含量。按照試劑盒的說明進行操作:細胞用RIPA 裂解液常規裂解,4℃、14 000 g 離心20 min 后取上清液。檢測液A 與B 按1∶1 混合。取2 μL 上清液加入300 μL 混合好的檢測液,37 ℃孵育至少30 min,在600 nm 處測定吸光度。
2.5 細胞總ROS 檢測
采用2',7'-二氯熒光黃雙乙酸鹽(DCFHDA)熒光探針標記,流式細胞儀檢測熒光強度[16]。L-02 細胞消化重懸,加入濃度為10 μmol·L-1的DCFH-DA,37℃避光孵育30 min,孵育完成清洗3 次,重懸后用流式細胞儀FL-1通道測定平均熒光強度,激發波長為488 nm,發射波長為525 nm。
2.6 細胞MDA 含量、總SOD 活性和CAT 活性檢測
在樣品充分裂解后,按照說明進行操作,測定MDA、總SOD 活性及CAT 活性。MDA 熒光強度檢測采用激發波長515 nm、發射波長553 nm。總SOD 活性采用450 nm 波長測定吸光度,CAT 活性采用520 nm 波長測定吸光度。
2.7 核蛋白與漿蛋白提取
采用核蛋白、漿蛋白提取試劑盒提取核蛋白及漿蛋白,在細胞中加入預冷的450 μL Buffer A與50 μL Buffer B,混勻,冰上放置30 min。4℃、3000 g 離心10 min,上清液即為胞漿蛋白。沉淀加入100 μL Buffer C,渦旋震蕩15 s,冰上裂解60 min。4 ℃、14 000 g 離心30 min,上清液即為核蛋白。
2.8 Western blot
依照BCA 法,測定蛋白濃度。配制相應濃度的凝膠依次上樣,恒壓150 V 電泳60 min。電泳結束后,將蛋白轉移至PVDF 膜上。5%脫脂奶粉室溫孵育2 h。一抗在4 ℃孵育12 h,用TBST洗膜,共3次。二抗在25℃孵育2 h,TBST 洗膜,共4 次。發光液A 與發光液B 按1∶1 混勻,覆于PVDF 膜表面,并用凝膠成像進行成像。最后采用Bio-Rad Quantity One 軟件對條帶進行定量分析。
2.9 統計學分析
通過SPSS 22.0 統計分析軟件,實驗數據以±s形式表示。多組間數據采用單因素方差分析(One-way ANOVA),運用Dunnett’st檢驗比較實驗組與對照組之間的統計學差異,以P<0.05為差異有統計學意義。
3 結果
3.1 異鼠李素對L-02 細胞活力的影響
當 濃度≤20 μmol·L-1時,異鼠 李 素對細胞活力的影響無顯著區別;而當濃度≥40 μmol·L-1時,細胞活力顯著降低(見圖1)。因此,為了避免細胞活力受影響,選擇濃度為10 μmol·L-1的異鼠李素進行干預。
3.2 異鼠李素對FFA 誘導的L-02 細胞中TG 水平的影響
與Control 組相比,經FFA 處理的細胞紅色斑點大量生成,TG 水平顯著提高;而經異鼠李素干預后,紅色斑點顯著減少,表明細胞內TG水平顯著下降(見圖2)。
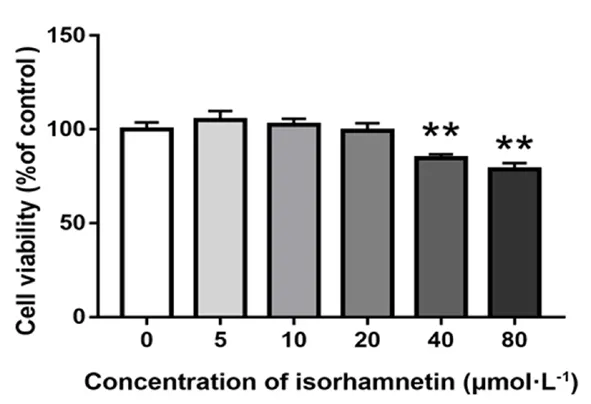
圖1 不同濃度的異鼠李素處理后對L-02 細胞活力的影響(24 h)Fig 1 Effect of different concentrations of isorhamnetin on the viability of L-02 cells(24 h)
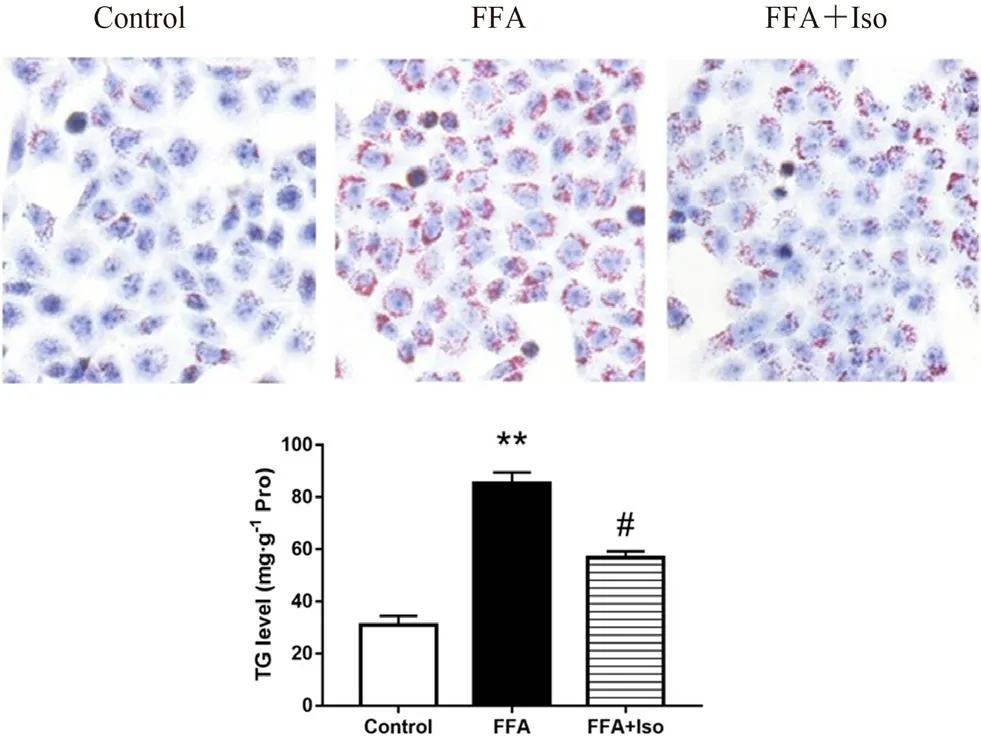
圖2 異鼠李素對FFA 誘導的L-02 細胞中TG 水平的影響(7 d)Fig 2 Effect of isorhamnetin on TG level in L-02 cells induced by FFA(7 d)
3.3 異鼠李素對FFA 誘導的L-02 細胞中總ROS及MDA 水平的影響
與Control 組相比,FFA 組的總ROS 水平與MDA 水平均顯著增高,表明FFA 可誘導細胞發生OS,使細胞受損;而經異鼠李素干預后,細胞總ROS 水平與MDA 水平均明顯降低,表明異鼠李素可以有效緩解FFA 造成的OS 損傷(見圖3)。
3.4 異鼠李素對FFA 誘導的L-02 細胞中抗氧化酶的影響
與Control 組相比,FFA 組SOD1、SOD2、GPx1的表達水平均顯著下降;在異鼠李素干預后,SOD1、SOD2、GPx1 的表達水平顯著提高(見圖4A)。除此之外,FFA 可顯著降低L-02 細胞總SOD 活性,而異鼠李素干預后總SOD 活性顯著增加(見圖4B)。
3.5 異鼠李素對FFA 誘導的L-02 細胞中Nrf2 蛋白及其下游蛋白水平的影響
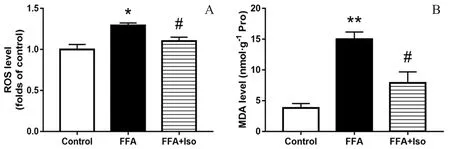
圖3 異鼠李素對FFA 誘導的L-02 細胞的總ROS 與MDA 水平的影響(7 d)Fig 3 Effect of isorhamnetin on total ROS and MDA level in L-02 cells induced by FFA(7 d)

圖4 異鼠李素對FFA 誘導的L-02 細胞的抗氧化酶的影響(7 d)Fig 4 Effect of isorhamnetin on anti-oxidases in L-02 cells induced by FFA(7 d)
FFA 處理后L-02 細胞胞核內的Nrf2 蛋白水平顯著下降,Nrf2 下游的GCLC、GCLM 的表達水平也顯著下降。與FFA 組相比,異鼠李素干預后細胞質中的Nrf2 蛋白(cyt Nrf2)水平顯著下降,而細胞核中的Nrf2 蛋白(nuc Nrf2)水平則顯著升高(見圖5A);Nrf2 下游的蛋白表達水平也有顯著提高(見圖5B)。
3.6 抑制Nrf2 后異鼠李素對FFA 誘導的L-02 細胞中TG 水平的影響
與Control 組相比,FFA 組TG 水平顯著升高,而異鼠李素進行干預后TG 水平有明顯的下降,表明異鼠李素可以減輕FFA 誘導的脂質沉積。而在應用Nrf2 特異性抑制劑ML385(1 μmol·L-1)與異鼠李素共同處理后,細胞內TG水平明顯回升,表明Nrf2 在受到抑制后,異鼠李素緩解脂質沉積的作用下降,進一步表明異鼠李素可能是通過調節Nrf2 通路緩解FFA 誘導的脂質沉積(見圖6)。

圖5 異鼠李素對FFA 誘導的L-02 細胞中Nrf2 蛋白及其下游蛋白水平的影響(7 d)Fig 5 Effect of isorhamnetin on Nrf2 and its downstream proteins in L-02 cells induced by FFA(7 d)
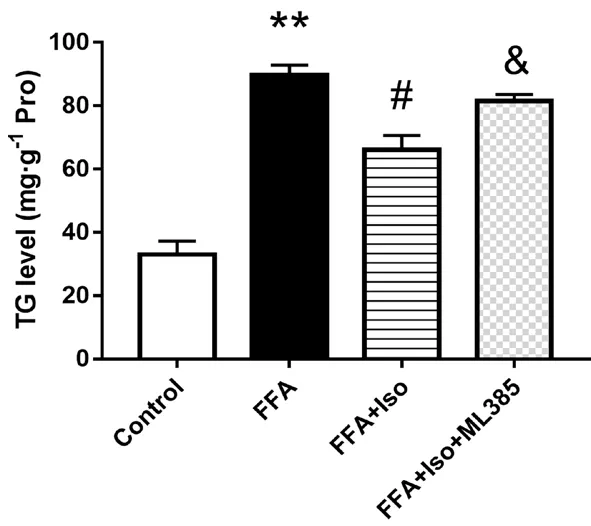
圖6 抑制Nrf2 后異鼠李素對FFA 誘導的L-02 細胞中TG 水平的影響(7 d)Fig 6 Effect of isorhamnetin on the TG level in L-02 cells induced by FFA after the inhibition of Nrf2(7 d)
4 討論
OS 是ROS 生成超過抗氧化的能力時出現的一系列應激反應,與NAFLD 的發生有著密切的聯系。過量的游離脂肪酸在肝細胞線粒體內發生β氧化,造成ROS 的不斷聚積,影響線粒體的活性,導致脂肪酸轉化為TG 儲存在肝細胞內,進一步破壞線粒體結構與功能,產生更多的ROS[17],大量TG 沉積在肝臟中最終形成NAFLD。而NAFLD 的形成也進一步使肝細胞受到脂質毒性的侵害,加重線粒體的破壞,產生更多的ROS,從而誘導IR與炎癥的發生,進一步使OS 損傷加劇,形成惡性循環[18]。因此,通過減少ROS 成為預防或治療NAFLD 的潛在有效手段[19]。
異鼠李素具有保肝的作用,可以有效緩解多種因素引起的肝細胞壞死與凋亡,這其中的機制可能與抗氧化相關[20]。在本研究中,我們發現FFA 可以誘導L-02 細胞發生脂質沉積,并且可以引起細胞發生OS 損傷,產生大量ROS,消耗多種抗氧化酶。而異鼠李素則可以有效緩解FFA誘發的脂質沉積,減少細胞中TG 的水平,并且緩解OS 損傷,減少ROS 與MDA 的水平,提高SOD1、SOD2、GPx1 的表達與活性,表明異鼠李素可能通過抗氧化來緩解脂質沉積。Nrf2 是上游重要的抗氧化轉錄因子,其調控機制尚不完全明確。但目前普遍的觀點認為,當遇到親電物質攻擊或是發生磷酸化使其構象發生改變[21],Nrf2就會與keap1 分離進入細胞核,與一個小蛋白形成異二聚體,并識別抗氧化反應原件(antioxidant response element,ARE)序列,加強下游抗氧化蛋白表達,從而減輕ROS 帶來的破壞,維持細胞的穩態[22]。此外,當keap1 發生構象的改變或是Nrf2 mRNA 水平上調,都可以促使Nrf2 通路的激活。我們進一步的研究發現,異鼠李素可以通過調控Nrf2 信號通路,促進Nrf2 進入細胞核,從而提高HO-1、GCLC、GCLM 的表達水平。這些結果表明異鼠李素可能是通過提高Nrf2 的轉錄活性,減輕了OS,從而緩解了FFA 誘導的脂質沉積。接下來本課題組應用Nrf2 的特異性抑制劑,發現異鼠李素緩解脂質沉積的作用減弱,細胞中TG 水平增加,這進一步表明Nrf2 通路是異鼠李素緩解脂質沉積的重要通路。Ganhold等[23]的研究證明異鼠李素可以緩解小鼠肝臟中的脂質沉積,其中的機制可能與過氧化物酶體增殖物激活受體γ(peroxisome proliferators activated receptorγ,PPARγ)通路有關。PPARγ通路與脂質合成相關,而有文獻報道Nrf2 可以調控PPARγ通路,因此異鼠李素還有可能通過調控Nrf2 抑制脂肪從頭合成,從而緩解脂質累積[24]。
綜上所述,本研究采用NAFLD 體外細胞模型,發現異鼠李素可顯著緩解FFA 引起的OS,提高細胞抗氧化的能力,降低FFA 誘導的脂質沉積,而調控Nrf2 通路是其中抗氧化的重要機制。該研究結果為進一步研究異鼠李素防治NAFLD提供了實驗依據。

