程序性死亡受體1抑制劑的神經系統不良反應及藥學監護
李草,趙志剛(首都醫科大學附屬北京天壇醫院藥學部,北京 100070)
免疫檢查點是參與維持免疫動態平衡的分子[1],其中,關于程序性細胞死亡受體-1(programmed cell death protein 1,PD-1)和程序性死亡配體-1(programmed death ligand 1,PD-L1)的研究最深最廣。臨床上,針對PD-1 和PD-L1 的單克隆抗體陸續被開發,在患者中顯示出良好的治療效果[2]。免疫檢查點抑制劑有一系列獨特的免疫相關不良反應,表現為靶向體內正常器官或組織的炎性或自身免疫性不良事件,最常見的癥狀出現在皮膚、內分泌系統、胃腸道、肝臟和心臟[3]。
隨著PD-1 抑制劑的逐漸應用,發生率較低的神經系統不良反應逐漸被進一步認知[4-6]。在應用此類藥物時,早期識別不良反應,嚴重時予停藥,并給予免疫抑制劑或其他相應藥物處理尤為重要,在此過程中,臨床藥師與患者及家屬的溝通、與醫師護士的合作發揮著重要作用。
1 PD-1 抑制劑神經系統不良反應
近期meta 分析顯示,免疫檢查點抑制劑的外周神經系統1 ~5 級不良反應占比為5%,中樞神經系統3 ~5 級不良反應占比為0.46%[7]。神經系統不良反應的癥狀差異較大,如重癥肌無力、外周神經病、非感染性腦膜炎、腦炎等(見表1)。外周神經病變一般相對較輕,中樞神經系統病變則通常較重;此外,不良反應發生時間差異較大且難以預測,疾病狀況發展可能較快甚至致命。

表1 PD-1 抑制劑神經系統不良反應癥狀及發生率(%)Tab 1 Symptoms and prevalence of PD-1 inhibitor related neurologic adverse reactions (%)
1.1 外周神經不良反應
1.1.1 周圍神經病 在一項納入347 名患者的研究中[4],有4 人發生了不同表型的外周神經系統病變。外周神經病變常見癥狀包括感覺缺失或異常、反射消失、感覺性共濟失調、麻木、疼痛等[8-9]。1 例黑色素瘤患者在使用10 個療程的PD-1 抑制劑后,在胸腰段發生了4 級軸突多發性神經病,停藥后使用潑尼松治療,神經系統癥狀持續數周后緩解;1 例使用PD-1 抑制劑治療黑色素瘤的患者發生嚴重的長度依賴性神經病變合并脫髓鞘病變,同樣在停藥并使用潑尼松治療后癥狀緩解;另1 例使用PD-1 抑制劑治療晚期腹膜間皮瘤的患者,在用藥5 個周期后出現非對稱性血管炎性周圍神經病,停藥后使用激素(甲強龍靜脈注射后口服潑尼松)處理后癥狀緩解[4]。PD-1 抑制劑聯合達拉菲尼(dabrafenib)的患者在治療35 周后左側臀部疼痛,隨后發展為雙腿虛弱,間歇性發燒和惡心,最終呈現特倫德倫堡步態。此患者MRI 排除腦和脊髓腫瘤轉移,經高劑量潑尼松龍治療后癥狀迅速改善[10]。
1.1.2 重癥肌無力 使用PD-1 抑制劑可能導致重癥肌無力,常見癥狀包括骨骼肌無力、易疲勞、眼皮下垂、視力模糊、抬頭困難、嚴重時呼吸困難[4,8]。病例報告顯示,1 例黑色素瘤患者在第3 次治療后,迅速發生了眼球轉動不靈活、呼吸困難等癥狀,其MRI 結果顯示腦部沒有腫瘤轉移,其他生化學指標指示為免疫誘導性的重癥肌無力。對于此例患者,僅靠高劑量糖皮質激素并不能緩解神經系統癥狀,進一步使用血漿置換術和溴吡斯的明處理后最終病情仍然進展[11]。
另一項大型回顧性研究表明,在9869 名使用PD-1 抑制劑的患者中,有12 名患者出現過重癥肌無力(包括6 名男性和6 名女性),均發生在治療后的早期階段,并迅速惡化。在這12 名患者中,4 例有肌炎,3 例有心肌炎,其中1 例同時發生肌炎與心肌炎。激素療法被用來處理神經系統并發癥,預后結果顯示有4 名患者緩解較差,且有2 名患者最終因為不良反應而死亡[12]。研究報道PD-1 抑制劑單藥治療或與CTLA-4(cytotoxic T-lymphocyte-associated protein 4)單抗聯用的患者出現了重癥肌無力的病例[13]。
1.1.3 吉蘭-巴雷綜合征 吉蘭-巴雷綜合征(Guillain-Barré syndrome,GBS)也被稱為格林巴利綜合征,是常見的周圍神經和脊神經根的脫髓鞘病變,表現為感覺-運動障礙并伴隨自主神經失調、腱反射減弱或消失,部分病例出現眼瞼下垂或復視、吞咽或發聲困難、呼吸困難等[5]。1 名黑色素瘤患者使用PD-1 抑制劑20 個療程后,出現2 級脊髓神經根多發性神經元炎,表現為GBS,停藥后靜脈注射免疫球蛋白后緩解[4]。病例報告顯示患者使用PD-1 抑制劑后,出現急性GBS 或者慢性炎癥性的多發性神經根脫髓鞘病變[14]。GBS 與脫髓鞘的發病機制包括自身免疫,這表明PD-1 抑制劑的不良反應可能與調節免疫功能相關。
1.2 中樞神經系統不良反應
中樞神經系統不良反應包括自身免疫性腦炎、無菌性腦膜炎以及脊髓炎[15-16],通常較為嚴重,能達到3 ~5 級。單獨基于臨床癥狀,不能斷定腦炎是否由免疫檢查點抑制劑引起,患者可能會出現頭痛、發燒、虛弱、疲勞、混亂、記憶困難、困倦、幻覺、癲癇發作以及頸部僵硬等,需深入分析以排除腦炎的其他潛在病因。因此,藥師要密切關注患者情況,并與醫護人員多討論、溝通。
Williams 等[16]報道CTLA-4 單抗和PD-1 抑制劑聯合治療后,產生了2 例自身免疫性腦炎。2 例患者在PD-1 抗體注射幾日內即出現自身免疫性腦炎,說明發生腦炎和使用免疫檢查點抑制劑的時間間隔較短,表明兩者之間有直接的關系。2 例患者在激素治療后均有顯著改善。另外,文獻報道1 例黑色素瘤患者使用PD-1 單抗一年后,出現邊緣性腦炎、進行性認知衰退,MRI 結果顯示大腦邊緣性結構改變,腦脊液檢查發現白細胞計數增多以及蛋白水平升高[13]。
1.3 病理生理學機制
PD-1 抑制劑引起神經系統不良反應的病理生理學機制仍然不明,多種機制可能參與了病變過程[9]。正常情況下部分患者的自身免疫與免疫耐受相互平衡,自身免疫不會攻擊機體自身,使用PD-1 抑制劑后平衡被打破,導致了臨床上的自身免疫性疾病[17]。腫瘤新抗原與組織的正常抗原發生交叉反應,導致了免疫相關的不良反應[18];PD-1 抑制劑也可以直接靶向正常組織,引起抗體依賴性的毒性和補體介導的炎癥。此外,機體本身存在的亞臨床炎癥、外界刺激、免疫檢查點抑制劑的抗體暴露也是可能的機制。還有,細胞因子與PD-1 抑制劑可能誘導并放大T 細胞的炎癥反應,并增加Th1/Th17 細胞的分化,促進白介素2、白介素7、白介素17、腫瘤壞死因子α的產生并減少Th2 細胞的白介素5、白介素13 的釋放。
2 藥學監護
由于神經系統不良事件可能會迅速發展并造成嚴重后果,因此藥學監護至關重要[15]。臨床藥師需要對這些不良反應保持高度關注,筆者根據國內外指南以及臨床實踐,總結簡單的臨床處理方法,見表2[16-19]。神經系統不良反應異質性較高,發病狀況可能有很大的不同,有些情況開始不明顯并呈現不斷變化的特點,部分嚴重的病變會在數天到數周內迅速進展。分級:1 級,輕度;2 級,中度;3 級,嚴重;4 級,危及生命;5 級,不良反應相關性死亡。分級標準為《常見不良反應評定標準(CTCAE_5.0)》。
2.1 PD-1 抑制劑神經系統不良反應評估
用藥后,如果出現不良反應,首先,應精確排除腫瘤本身可能引起的神經系統癥狀,比如排除腫瘤壓迫脊髓神經或者顱內轉移灶[19];其次,詳細觀察出現的癥狀,比如晨輕暮重的乏力癥狀通常與神經肌肉接頭相關;長度依賴性、感覺癥狀先于運動癥狀、緩慢漸進發展是外周神經病的癥狀;神經性肌炎癥狀包括四肢無力但感覺神經不受影響,累及眼部或呼吸系統,肌酸激酶升高(>1000 IU),肌電圖正銳波;重癥肌無力的癥狀通常包括視覺障礙,延髓、呼吸系統癥狀,單纖維肌電圖震顫增加等;認知或意識狀態改變多為中樞癥狀的腦炎,常伴發頭痛、運動或感覺功能失調、失語、發熱、腦脊液白細胞升高等[20]。血清學與電生理檢查也很有必要,包括血細胞計數、血生化(肌酸激酶、乙酰膽堿受體、維生素B12、葉酸、銅等)、甲狀腺功能、肌電圖、神經傳導功能、核磁共振等,能夠輔助確定不良反應類型。在某些特定情況下,可以進行腰椎穿刺,白細胞計數來輔助確定癥狀是否為免疫介導的神經系統病變。
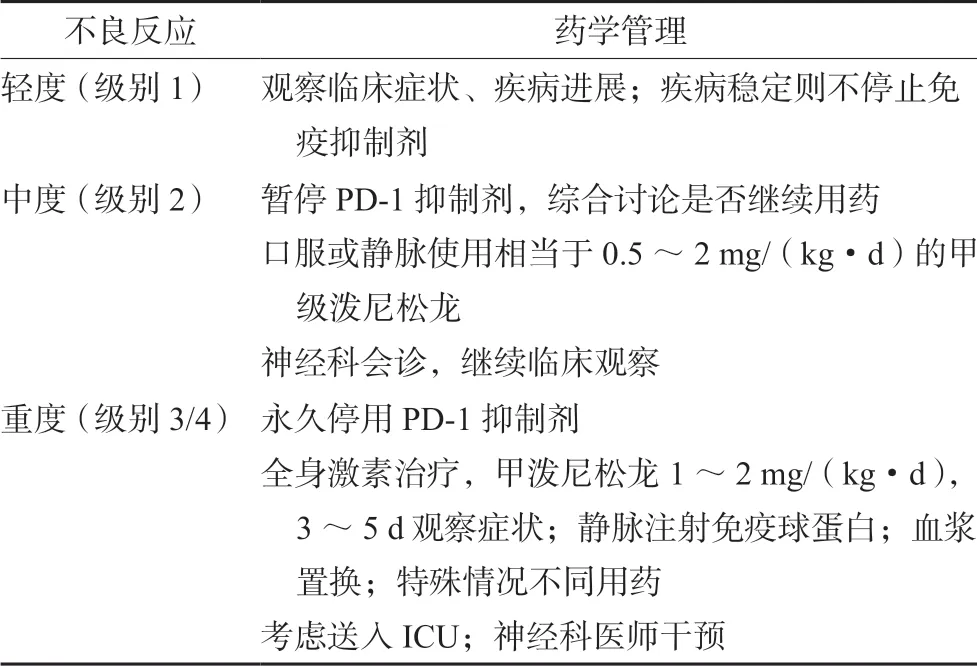
表2 PD-1 抑制劑神經系統不良反應的藥學管理Tab 2 Pharmaceutical management of PD-1 inhibitor related neurologic adverse reactions
2.2 藥學監護
系統性評估神經系統不良反應后,按照《常見不良反應評定標準(CTCAE_5.0)》標準,可將不良反應近似分為輕、中、重3 個級別,分別給予對應處理。在懷疑出現神經系統癥狀時,藥師應該引起警惕。
2.2.1 PD-1 潛在神經毒性 出現PD-1 潛在神經毒性系統輕度不良反應時,可以暫時不用藥物干預,需檢測血常規、電解質、肝腎功能、維生素B12/葉酸、排除感染等,密切關注患者狀況,如果癥狀進展則需使用激素治療[19-20]。
2.2.2 PD-1 中到重度不良事件 如果懷疑有免疫相關的中到重度不良事件,應當迅速使用高劑量激素,0.5 ~2 mg·kg-1潑尼松龍(或等效藥物)可能停止并逆轉神經系統并發癥[15]。鑒于PD-1抑制劑的半衰期長,激素必須在逐漸減量的情況下至少給予1 個月。如果發生嚴重的(3 級或4 級)神經毒性反應,應永久停用免疫檢查點抑制劑。如果激素不足以對抗不良反應,必須考慮進一步用免疫球蛋白治療(2 g·kg-1,連用5 d)、血漿置換術(2 周內共5 次)或免疫抑制劑英夫利昔單抗(5 mg·kg-1)[21]。懷疑中樞癥狀除應檢查常規血生化外,還應進行MRI、腰椎穿刺等,完善NMDA 受體、CASPR2 等免疫學檢測;外周不良反應鑒別則有神經電生理檢測、心電監測、呼吸監測,肌酸激酶、乙酰膽堿受體、肌肉特異性激酶檢測、肌肉活檢等。中樞與外周癥狀處理方式類似,但也有所不同,比如在重癥肌無力患者中,應當盡早使用溴吡斯的明(30 mg tid)或霉酚酸酯(500 mg bid)[20]。
2.2.3 不良反應的藥學監護 PD-1 抑制劑神經系統癥狀的藥物自身也可能引起不良反應。糖皮質激素是最常用的治療PD-1 抑制劑神經系統不良反應的免疫抑制劑,長時間應用可能增加病原菌感染風險,發生糖代謝異常、類庫欣綜合征、骨質疏松和高凝狀態等。臨床藥師在監護過程中,應關注這些額外的風險因素,避免迅速撤藥。也有研究報道,可使用其他藥物以及醫療技術治療PD-1 抑制劑神經系統不良反應,如溴吡斯的明、人免疫球蛋白和血漿置換術等[4,11,15-16]。溴吡斯的明不良反應包括泌尿生殖系統、精神、胃腸道等;人免疫球蛋白不良反應涉及心悸、一過性頭痛等。這些藥物應用于患者時,應注意甄別。
2.3 停藥管理
免疫相關不良事件的頻率和嚴重程度可能是劑量依賴性的,并且可以預測免疫檢查點抑制劑使用后的療效[21-22]。然而,不良反應的發展常常會導致免疫檢查點抑制劑治療中斷。值得一提的是,部分因為神經系統不良反應中斷了治療的患者,仍然對放療敏感。目前,在使用免疫檢查點抑制劑時,只有有限的數據可用于預測哪些患者可能發生嚴重不良事件[14]。
2.4 患者教育
PD-1 抑制劑為新一代抗腫瘤藥物,在使用前應與患者充分溝通。應告知以下內容:① 藥物名稱、治療時間周期、劑量、頻次[23]。② 說明不良反應的類別、癥狀、發生和持續時間、是否能恢復,使其對發生程度和應對措施有充分認知。③ 出現神經癥狀時患者的自我管理:家屬和照護者的陪護;不良反應的自我監測;出現癥狀后及時與藥師、醫護人員溝通。這些癥狀包括輸液相關的過敏反應如頭暈、心悸、呼吸困難等;消化道如腹瀉、腹痛、血便、黏液便、黑便等;肺部如咳嗽、咳血、呼吸困難、胸痛等;腎臟如尿液顏色、尿量改變、血尿、腰痛、下肢水腫等;肝臟如鞏膜和皮膚黃疸、白便或黏土色便;甲狀腺如畏冷畏熱、體質量異常增減等;皮膚如瘙癢、皮疹、水泡等;以及前文所述的中樞、外周神經系統癥狀。④ 患者對新藥的期望值較高,應與患者、家屬溝通此類藥物在相應疾病中的臨床治愈率;晚期腫瘤患者也存在恐懼、絕望等負面情緒,臨床藥師應充分與患者和家屬溝通,解決出現的問題,提升人文關懷。
3 討論
盡管臨床益處明顯,但免疫檢查點抑制劑伴隨著免疫相關獨特的不良反應。隨著這些藥物獲批適應證的增加,越來越多的患者使用此類藥物,不良反應也增多。腫瘤患者在接受PD-1 抑制劑治療時,有發生神經系統并發癥的風險。應注意藥物不良反應和疾病本身進展以及其他潛在原因的排除和鑒別。
臨床藥師進行藥學監護實踐中,管理患者不良反應包括以下流程:
① 熟悉神經系統不良反應:主要包括免疫介導性多發性神經病、GBS、重癥肌無力、可逆性腦病綜合征、無菌性腦膜炎、腸神經病變、橫貫性脊髓炎以及免疫性腦炎等。
② 確定特殊人群:患者基本情況、免疫疾病史、腫瘤特征、感染狀態、是否高齡等。
③ 掌握處理方法:主要有口服或者全身皮質類固醇激素、免疫球蛋白、英夫利昔單抗、溴吡斯的明療法,以及血漿置換術等。
④ 跟蹤隨訪:神經系統不良反應種類較多,出現的時間各異,應結合患者狀態以及實驗室和影像學檢查,密切與患者溝通,綜合判斷出現的不良反應,與其他藥物聯合治療可能出現的不良反應進行區別。
臨床藥師必須在整個藥學監護的過程中保持警惕,甚至在治療完成后一段時間內也不能掉以輕心,每3 個月進行一次綜合評估。

