淺談血管內亞低溫治療儀技術的研究進展
張曉康
(廣東省醫療器械質量監督檢驗所,廣東 廣州 510663)
亞低溫技術已經歷了70 多年的發展歷史,國內外大量的研究證實了適當的低溫及方法的腦保護臨床作用。目前,醫學界將低溫分為輕、中、深度低溫,分別為33 ~35℃、28 ~32℃及16℃以下。1993 年我國學者把輕、中度低溫定為亞低溫,隨即此概念被世界同行所廣泛引用。亞低溫技術在20 世紀50 ~60 年代逐步發展并成熟起來,在80 ~90 年代,取得舉世矚目的成果來自亞低溫治療重型顱腦損傷的實驗研究。在80 年代中期,開始有大量關于亞低溫與腦缺血的實驗研究。現已證實,28 ~33℃的亞低溫具有確切的神經保護作用。臨床應用結果還發現,亞低溫治療不產生任何嚴重并發癥,從而表明,亞低溫治療重型顱腦損傷患者具有安全方便和療效肯定等優點。因此,治療重型顱腦損傷和腦缺血患者的有效措施是亞低溫治療法。
亞低溫經歷了外敷冰袋、冰帽、冰毯,到低溫治療機、血管內低溫灌注、低溫體外循環的發展歷程,這些方法雖能降低人體溫度,但由于人體差異、溫度、時間、復溫、不良反應等諸多原因而得不到廣泛有效應用。此次的研究,經過十幾年臨床與基礎研究,總結了亞低溫的方法和經驗,研究得出,利用低溫介質通過球囊導管在血管內(中心靜脈)與血液進行熱交換,使患者體溫降到理想的目標溫度,從而實現了腦保護的目的。
1 作用機理
1.1 低溫可抑制代謝率
低溫可抑制腦組織的氧代謝率,保存高能磷酸化合物,抑制乳酸蓄積,維持細胞內外的pH 值。
1.2 低溫可抑制自由基產生,促進自由基清除
低溫可抑制興奮性氨基酸(EAA)和兒茶酚胺介導的氧化應激、實驗研究發現,低溫缺血可明顯抑制EAA 的釋放并且使腦缺血時兒茶酚胺的釋放減少60%,減少自由基的產生。
1.3 低溫可抑制興奮性氨基酸(EAA)生物合成、釋放和重攝取
低溫可維持質膜結構的完整性,降低細胞質Na+和細胞外K+濃度的升高,降低對谷氨酸的重攝取。研究發現,低溫可以降低缺血后腦組織中的谷氨酸和甘氨酸濃度。
1.4 低溫可以改變缺血后多種酶的活性
研究發現,低溫可影響磷脂酶A2、鈣調素依賴性蛋白激酶Ⅱ、蛋白激酶、一氧化氮合成酶等多種酶的活性。腦缺血再灌注期間,磷脂酶A2的激活可使細胞膜溶解,導致神經細胞的完整性破環。低溫可促進Na+、K+、Ca+、ATP 酶活性的恢復,減少細胞內Ca+超載,進而抑制磷脂酶A2的激活。低溫還可保護蛋白激酶C、鈣調素依賴性蛋白激酶Ⅱ的活性,減輕缺血性神經元損傷。
1.5 低溫可影響信號傳遞
核因子為一種轉錄因子,在腦缺血后激活,激活可致多種炎性基因的表達。有人曾對大鼠在過性大腦中動脈閉塞后核因子表達的影響作了研究,在缺血2h 即可見核因子在細胞質表達、核內移位、結合活性,并持續24h。低溫可使核因子移位和結合活性減弱,但并不影響核因子的總體表達。低溫對炎癥的抑制有2 種途徑:低溫可使炎細胞核因子活性減弱,導致炎癥的直接抑制。低溫保護的其他細胞如神經元可因炎性信號傳遞蛋白生成的減少而影響幸存的神經元,間接減少炎性細胞的繼發性刺激。
1.6 低溫可激活抗炎性機制
近期2 項研究證實,低溫可使心臟驟停復蘇后昏迷患者存活率升高,明顯改善神經功能預后。低溫的作用機制涉及細胞保護途徑的激活。例如,低溫可誘導熱休克蛋白70 的表達,導致心肺分流時炎性級聯反應變換,減少促炎性介質,增加抗炎性細胞因子白介素10 的水平。
2 產品結構與技術原理
血管內亞低溫治療儀由主機溫度控制系統(如圖1)、一次性導管連接套件(如圖2)、一次性中心靜脈球囊導管(如圖3)組成。

圖1 主機溫度控制系統

圖2 一次性導管連接套件
圖3 一次性中心靜脈球囊導管
產品結構(見圖4)和工作方式(見圖5):

圖4 產品結構
系統工作方式示意圖(見圖5):

圖5 工作方式
中心靜脈球囊導管經患者股靜脈穿刺(見圖6),置于下腔中心靜脈位置。一次性無菌套件用于連接熱交換系統主機和一次性中心靜脈球囊導管,形成封閉的循環系統,生理鹽水(見圖7)作為傳熱介質,經蠕動泵推注,在閉環系統中,在計算機控制下,生理鹽水通過一次性無菌中心靜脈球囊導管的球囊與患者血管內血液形成熱交換,從而將人體溫度平衡至亞低溫區域,從而達到亞低溫治療效果。
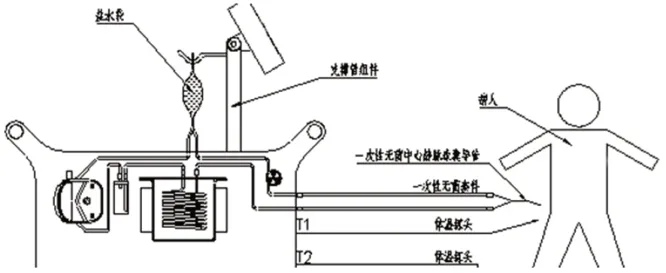
圖6 治療過程示意圖
3 產品的臨床應用
3.1 心跳驟停后的腦復蘇
因各種原因導致的心跳驟停在臨床上并不少見,多數患者將會死亡,部分存活者通常遺留嚴重的永久性神經功能缺損。心臟復蘇成功后的腦保護治療對患者的預后至關重要,其中重要的一項措施就是盡早實施亞低溫治療。

圖7 生理鹽水流向
3.2 急性卒中
亞低溫對急性卒中具有確切的保護作用,以往的臨床研究多采用體表降溫方法。由于缺血性卒中的腦水腫高峰期在發病后3 ~4h,因此,血管內亞低溫技術能夠及時實現亞低溫治療,并維持亞低溫時間48 ~72h。有研究發現,采用血管內降溫方法使其核心溫度降至33℃,持續12 ~24h 后復溫至36.5℃,復溫過程歷時12h,采用哌替啶+丁螺環酮+皮膚保溫減少寒戰。有臨床數據表明,所有患者均能耐受血管內降溫的不良反應和不適感,延長亞低溫持續時間至12~24h,并未出現明顯不良反應。因此,認為血管內降溫聯合應用抗寒戰治療對清醒的急性卒中患者是安全可行的。
3.3 急性心肌梗死
體溫是影響急性心肌梗死(acutemyocardialin farction,AMI)患者心肌壞死體積的重要因素,而降低心肌溫度可縮小梗死體積,即使是在冠狀動脈閉塞后再開始降溫也同樣有效。研究發現,血管內降溫(34℃)可明顯降低心肌溫度和縮小梗死體積,低溫雖可造成心率減慢和收縮壓下降,但在復溫后均能恢復正常。42 例發病1h 內的AMI 患者隨機分為血管內降溫組和對照組(每組21 例),血管內降溫的目標溫度為33℃,維持時間為3h,采用體表保溫、口服丁螺環酮和靜滴哌替啶以減少寒戰,在發病后30h 時測定梗死體積。結果發現,20 例患者成功實施了血管內降溫(占95%),全部達到目標溫度(33.2±0.9)℃,再灌注期間的平均體溫為(34.7±0.9)℃,患者均能耐受低溫,無血流動力學障礙,心律失常發生率也未增高。低溫治療組無一例患者出現嚴重心臟事件,而對照組有2 例,低溫治療組梗死體積有縮小的趨勢。因此,學者認為:血管內降溫是AMI 患者在冠狀動脈支架手術中的一項安全可行的輔助手段。
4 結語
綜上,本技術可用于神經內科、外科、重癥監護、急診科、燒傷科、麻醉科、心臟科、器官移植等,在多個臨床領域發揮其積極作用,且操作簡單、功能齊全;臨床中亞低溫治療可以用于神經外科腦損傷的中樞保護,在術中術后均可應用;麻醉科在進行低溫麻醉中,本技術具有精準控制體溫的性能,因此,大大避免了低溫麻醉的并發癥;在神經內科,用于卒中患者的腦保護。

