小桐子低溫誘導(dǎo)型啟動(dòng)子JcDnaJ20p 的克隆及煙草轉(zhuǎn)化功能鑒定
王海波 郭俊云
(曲靖師范學(xué)院 生物資源與食品工程學(xué)院,曲靖 655011)
轉(zhuǎn)錄水平的調(diào)控在植物基因表達(dá)中發(fā)揮重要作用[1-2]。啟動(dòng)子是功能基因上游負(fù)責(zé)RNA 聚合酶識(shí)別并開(kāi)始轉(zhuǎn)錄的順式作用元件(Cis-acting element),其包含RNA 聚合酶特異結(jié)合所需的保守序列,以及控制轉(zhuǎn)錄精確起始的TATA-box 核心元件與控制轉(zhuǎn)錄頻率的CAAT-box 和GC-box 元件[1],也可通過(guò)與特定反式作用因子(Trans-acting element)如轉(zhuǎn)錄因子的結(jié)合,從而調(diào)節(jié)功能基因轉(zhuǎn)錄的速度與頻率[1-3]。根據(jù)基因的表達(dá)方式,啟動(dòng)子分為組成型啟動(dòng)子(如花椰菜花葉病毒CaMV35S 啟動(dòng)子[4]、水稻肌動(dòng)蛋白ActinI 啟動(dòng)子[5]、玉米泛素Ubiquitin啟動(dòng)子[6])、組織特異性啟動(dòng)子(如擬南芥韌皮部AtPP2基因啟動(dòng)子[7]、火炬松微管組織PAL基因啟動(dòng)子[8])、誘導(dǎo)型啟動(dòng)子(如干旱誘導(dǎo)Lea啟動(dòng)子[9]、rd29A啟動(dòng)子[10]、低溫誘導(dǎo)cor15a啟動(dòng)子[11]、高鹽誘導(dǎo)Rab16A啟動(dòng)子[12]、病原誘導(dǎo)SRA啟動(dòng)子[2,13]等)。目前,在植物遺傳轉(zhuǎn)化研究中,大部 分 使 用CaMV35S(Cauliflower mosaic virus 35S promoter)作為目的基因表達(dá)的啟動(dòng)子,作為典型的植物組成型強(qiáng)啟動(dòng)子,CaMV35S 驅(qū)動(dòng)外源基因在植物中表達(dá)沒(méi)有組織特異性與發(fā)育階段特異性,但會(huì)造成轉(zhuǎn)基因植物由于過(guò)表達(dá)浪費(fèi)大量物質(zhì)與能量,增加代謝負(fù)擔(dān),甚至改變植物的代謝途徑與外部形態(tài),從而影響植物正常生長(zhǎng)發(fā)育[14],而誘導(dǎo)型啟動(dòng)子具有逆境誘導(dǎo)表達(dá)特性且不影響植物正常生長(zhǎng)的優(yōu)點(diǎn),成為培育植物抗逆新品種的最好選擇。
目前,已經(jīng)從多種植物中分離出低溫誘導(dǎo)表達(dá)啟動(dòng)子。擬南芥cor15a基因?qū)俚湫偷蜏卣T導(dǎo)表達(dá)基因,其過(guò)量表達(dá)可以顯著提高擬南芥的低溫抵抗能力,同時(shí)該基因的啟動(dòng)子也具有低溫誘導(dǎo)表達(dá)特性,能夠在低溫條件下,特異驅(qū)動(dòng)GUS基因的表達(dá)[11]。另外,擬南芥rd29A基因啟動(dòng)子在植物抗冷基因工程中也有廣泛的應(yīng)用,且由rd29A啟動(dòng)子驅(qū)動(dòng)的轉(zhuǎn)基因植株比由CaMV35S 啟動(dòng)子驅(qū)動(dòng)的轉(zhuǎn)基因植株生長(zhǎng)影響更小[10]。
能源植物小桐子作為主要的生物柴油植物之一,其種子含油量高,且流動(dòng)性與石化油摻和性好,成為未來(lái)最有可能替代化石能源的潛力樹(shù)種,我國(guó)在“十五”、“十一五”、“十二五”能源發(fā)展綱要中都把發(fā)展小桐子產(chǎn)業(yè)列為可再生能源中長(zhǎng)期發(fā)展規(guī)劃的重點(diǎn)[15]。小桐子(Jatropha curcasL.)屬大戟科(Euphorbiaceae)麻瘋樹(shù)屬(Jatropha)多年生落葉半肉質(zhì)小喬木或大灌木[16],目前在我國(guó)滇、黔、川、桂、閩、粵及瓊等省份有較多野生資源分布[17]。小桐子原產(chǎn)中南美洲的熱帶及亞熱帶地區(qū),低溫冷害是限制小桐子種植面積進(jìn)一步擴(kuò)大與產(chǎn)業(yè)發(fā)展的主要環(huán)境因素。前期通過(guò)小桐子低溫轉(zhuǎn)錄組[18]與數(shù)字基因表達(dá)譜[19]測(cè)序表明,小桐子低溫條件下高誘導(dǎo)表達(dá)基因主要包括電子傳遞與氧化還原平衡類(lèi)基因、水解酶基因、滲透調(diào)節(jié)物運(yùn)輸家族基因以及轉(zhuǎn)錄因子家族基因,暗示小桐子在響應(yīng)低溫過(guò)程中能量平衡、光合效率、滲透調(diào)節(jié)等功能起重要作用。DnaJ20 蛋白屬于Hsp40 家族分子伴侶,在逆境脅迫下能保護(hù)胞內(nèi)蛋白質(zhì)等的結(jié)構(gòu)與功能穩(wěn)定性。DnaJ20基因在12℃低溫處理12、24、48 h 下上調(diào)表達(dá)都達(dá)到極顯著水平,與小桐子的抗冷性直接相關(guān),而其啟動(dòng)子是否也具有低溫誘導(dǎo)表達(dá)特性還未見(jiàn)報(bào)道。本研究克隆了DnaJ20基因上游2 023 bp 的啟動(dòng)子序列,并通過(guò)GUS基因融合構(gòu)建了pCambia1381Z-JcDnaJ20p-GUS 植物表達(dá)載體,進(jìn)而在煙草中瞬時(shí)表達(dá)鑒定了該啟動(dòng)子的低溫誘導(dǎo)特性,旨在為小桐子抗冷性基因工程的研究提供理論與應(yīng)用依據(jù)。
1 材料與方法
1.1 材料
實(shí)驗(yàn)所用小桐子材料采自云南省元謀縣干熱河谷地區(qū)。遺傳轉(zhuǎn)化受體煙草品種為云煙87。大腸桿菌(Escherichia coli)菌株DH5α、根癌農(nóng)桿菌(Agrobacterium tumdfaciens)菌株EHA105、植物表達(dá)載體pCambia1381Z 由本實(shí)驗(yàn)室保存。pMD18-T 載體、T4 DNA 連接酶、基因組提取試劑盒、凝膠回收試劑盒及質(zhì)粒提取試劑盒均購(gòu)自寶生物工程有限公司(TaKaRa)。TaqDNA 聚合酶購(gòu)自TOYOBO 公司,限制性內(nèi)切酶購(gòu)自Fermentas 公司。其他試劑為國(guó)產(chǎn)分析純。引物合成與測(cè)序由深圳華大基因有限公司完成。
1.2 方法
1.2.1 小桐子JcDnaJ20p 啟動(dòng)子的克隆及序列分析 根據(jù)本實(shí)驗(yàn)室前期小桐子數(shù)字基因表達(dá)譜(低溫12℃處理12、24、48 h)數(shù)據(jù)[19],分子伴侶DnaJ20基因?qū)儆诘蜏馗唔憫?yīng)基因。通過(guò)DnaJ20基 因 的mRNA 序 列(GenBank 登 錄號(hào):XM_012230104.2)對(duì)小桐子基因組數(shù)據(jù)庫(kù)(JatCur_1.0)進(jìn)行Blast 相似性檢索,獲得該基因起始密碼子ATG 上游2 500 bp 的啟動(dòng)子序列。利用Primer5.0 軟件設(shè)計(jì)擴(kuò)增引物(JcDnaJ20p_C),上游F:5'-ACGCGTCGACCGTTTGAAAGTTTGGAAGG-3',下劃線表示SalI 酶切位點(diǎn);下游R:5'-CCCAAGCTTG AGATCATTCCTGCAGTAG-3',下劃線表示Hind III 酶切位點(diǎn),菌落PCR 驗(yàn)證引物(JcDnaJ20p_T),上游F:5'-ACGCGTCGACCGTTTGAAAGTTTGGAAGG-3';下游R:5'-CAAAGGGAAATAATTTCATTG-3'(擴(kuò)增長(zhǎng)度284 bp)。
采用植物基因組DNA 提取試劑盒提取小桐子葉片基因組DNA。以基因組DNA 為模板,使用高保 真DNA 聚 合 酶KOD FX Neo DNA Polymerase 及JcDnaJ20p_C 引物進(jìn)行PCR 擴(kuò)增,擴(kuò)增條件為:98℃預(yù)變性5 min;98℃變性10 s,60℃退火30 s,68℃延伸2 min,30 個(gè)循環(huán),68℃后延伸5 min。將擴(kuò)增片段切膠回收后與克隆載體pMD18-T 連接,命名為pMD18-T-JcDnaJ20p,轉(zhuǎn)化大腸桿菌DH5α 感受態(tài)細(xì)胞,涂LB 抗性平板(包含50 mg/L Amp),過(guò)夜生長(zhǎng)。利用引物JcDnaJ20p_T 進(jìn)行菌落PCR 驗(yàn)證的陽(yáng)性克隆,送檢測(cè)序并提取重組質(zhì)粒。測(cè)序序列 通 過(guò)PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)對(duì)啟動(dòng)子順式作用元件進(jìn)行鑒定。
1.2.2 植物表達(dá)載體的構(gòu)建 將pMD18-TJcDnaJ20p 質(zhì)粒與植物表達(dá)載體pCambia1381Z 經(jīng)SalI、Hind III 雙酶切,切膠回收后利用T4 DNA 連接酶16℃過(guò)夜連接,將小桐子啟動(dòng)子JcDnaJ20p序列克隆至pCambia1381Z 的多克隆位點(diǎn),獲得JcDnaJ20p 啟動(dòng)子與GUS基因融合的植物表達(dá)載體pCambia1381Z-JcDnaJ20p-GUS,將該質(zhì)粒轉(zhuǎn)化大腸桿菌DH5α 感受態(tài)細(xì)胞,涂布LB 抗性平板(含50 mg/L 的Kan),37℃過(guò)夜生長(zhǎng),提取重組質(zhì)粒,通過(guò)SalI 與Hind III 雙酶切進(jìn)行鑒定。同時(shí)構(gòu)建CaMV35 啟動(dòng)子與GUS基因融合的植物表達(dá)載體pCambia1381Z-35S-GUS,將pCambia1381ZJcDnaJ20p-GUS、pCambia1381Z-35S-GUS 融合載體與pCambia1381Z-GUS 空質(zhì)粒通過(guò)凍融法轉(zhuǎn)化根癌農(nóng)桿菌EHA105 菌株。
1.2.3 煙草轉(zhuǎn)化及GUS 組織化學(xué)染色 將以上轉(zhuǎn)化了不同載體的農(nóng)桿菌菌株挑取單克隆于1 mL LB液體培養(yǎng)基中(含50 mg/L Rif 與50 mg/L Kan),28℃震蕩培養(yǎng)24 h。將過(guò)夜培養(yǎng)的農(nóng)桿菌轉(zhuǎn)至25 mL LB 液體培養(yǎng)基中(含50 mg/L Rif 與50 mg/L Kan),加入100 μL 0.5 mol/L 2-(N-嗎啉)-乙磺酸(2-N-morpholino ethane sulfonic acid,MES),28℃震蕩培養(yǎng)至OD 值約為1.0,4 000 r/min 離心15 min,棄上清,用10 mmol/L MgCl2重懸菌體至OD 值約為1.0,靜置3 h。取正處于生長(zhǎng)期的煙草葉片,用針頭在葉片反面扎數(shù)個(gè)創(chuàng)傷孔,將轉(zhuǎn)化pCambia1381ZJcDnaJ20p-GUS 質(zhì)粒的農(nóng)桿菌菌液通過(guò)注射器注入葉片下表皮進(jìn)行浸染,同時(shí)以轉(zhuǎn)化pCambia1381Z-35S-GUS 與pCambia1381Z-GUS 空質(zhì)粒的農(nóng)桿菌為對(duì)照浸染煙草葉片。將以上浸染的煙草葉片分別置于15、4℃的培養(yǎng)箱中進(jìn)行低溫處理24 h,室溫25℃為對(duì)照,之后進(jìn)行GUS 組織化學(xué)染色。將煙草葉片置于GUS 染液(購(gòu)自Coolaber 公司)室溫下染色1 h,用70%乙醇進(jìn)行脫色,每次1 h,重復(fù)4 次,拍照觀察。
2 結(jié)果
2.1 小桐子JcDnaJ20p啟動(dòng)子的克隆及植物表達(dá)載體的構(gòu)建
根據(jù)GenBank 中發(fā)表的小桐子基因組數(shù)據(jù)設(shè)計(jì)引物,擴(kuò)增得到JcDnaJ20基因起始密碼子上游2 023 bp 的啟動(dòng)子DNA 片段,命名為JcDnaJ20p(圖1-A)。pCambia1381Z 是包含標(biāo)記基因GUS的啟動(dòng)子功能分析專(zhuān)業(yè)植物表達(dá)載體,雙酶切-T4 DNA 連接酶法構(gòu)建了JcDnaJ20p 啟動(dòng)子與GUS基因融合的植物表達(dá)載體pCambia1381Z-JcDnaJ20p-GUS(圖2),通過(guò)農(nóng)桿菌菌落PCR(擴(kuò)增長(zhǎng)度284 bp)(圖1-B)與SalI、Hind III 雙酶切驗(yàn)證(圖1-C)顯示,pCambia1381Z-JcDnaJ20p-GUS 已成功轉(zhuǎn)化農(nóng)桿菌EHA105 菌株,同時(shí)提取陽(yáng)性菌落的重組質(zhì)粒(圖1-D)并送樣進(jìn)行測(cè)序。測(cè)序結(jié)果表明,克隆的JcDnaJ20p 啟動(dòng)子序列與小桐子基因組中的序列相似性為99.8%(圖3-D)。
2.2 小桐子JcDnaJ20p啟動(dòng)子的序列分析
根據(jù)Wu 等[20]構(gòu)建的小桐子基因組高密度遺傳連鎖圖譜,通過(guò)Scaffold 數(shù)據(jù)在染色體水平定位JcDnaJ20基因,并使用MapChart 軟件進(jìn)行可視化繪圖顯示,小桐子JcDnaJ20基因定位7 號(hào)染色體(總長(zhǎng)度131.4 cM)的9.7 cM(圖3-A)。進(jìn)一步通過(guò)基因組數(shù)據(jù)分析顯示,小桐子JcDnaJ20基因(GenBank登錄號(hào):105644672)長(zhǎng)度為894 bp,包含1 個(gè)外顯子(618 bp),在基因兩端還鑒定到長(zhǎng)度分別為82 bp、194 bp 的5'-UTR、3'-UTR 區(qū)域(圖3-B)。

圖1 小桐子JcDnaJ20p 啟動(dòng)子的克隆
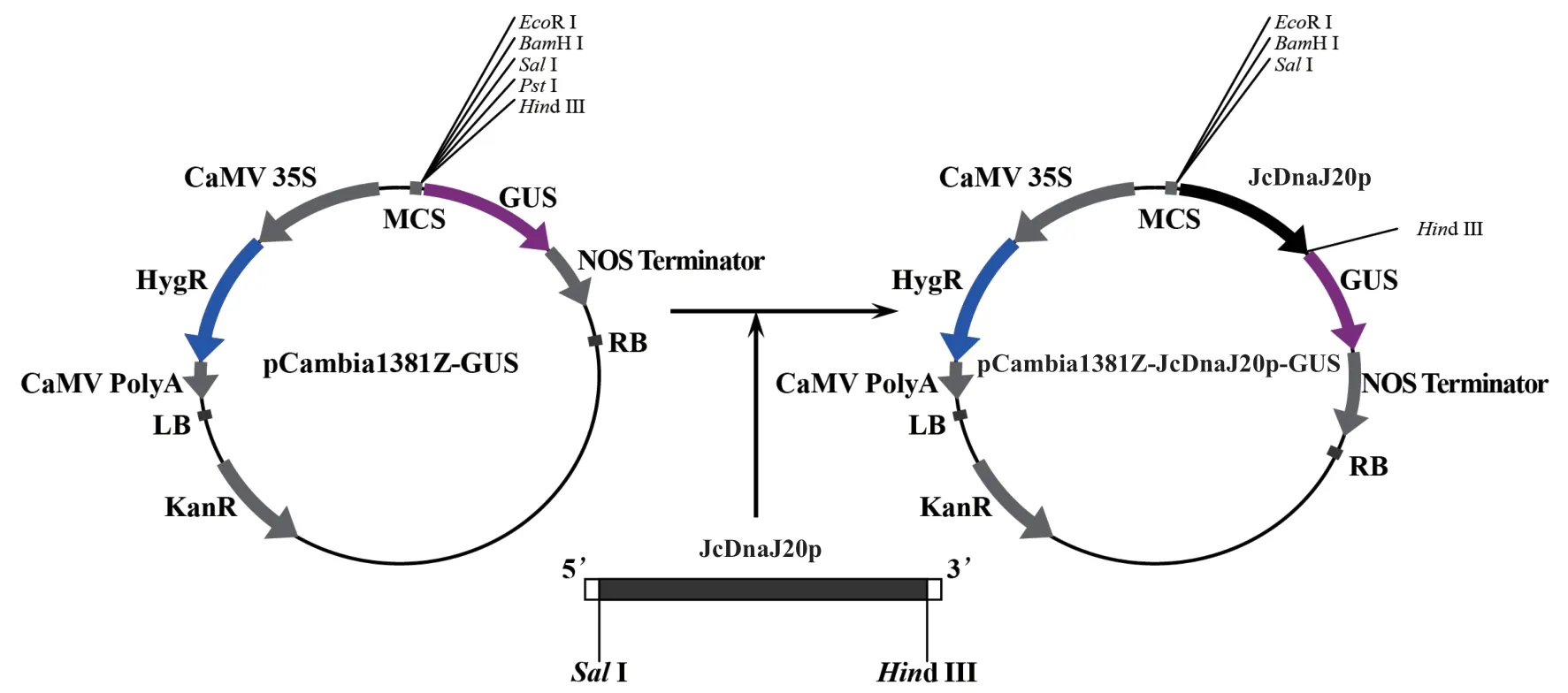
圖2 小桐子JcDnaJ20p 啟動(dòng)子與GUS 基因融合植物表達(dá)載體的構(gòu)建
利用PlantCARE 工具分析克隆的JcDnaJ20p 啟動(dòng)子序列存在的順式作用元件。結(jié)果表明,該啟動(dòng)子具有真核生物典型的核心啟動(dòng)子序列,包含31 個(gè)CAAT-box 和87 個(gè)TATA-box。另外,還鑒定到激素類(lèi)的響應(yīng)元件,如脫落酸響應(yīng)元件(ABRE,核心序列ACGTG)、赤霉素響應(yīng)元件(P-box,核心序列CAAAAGG),以及非生物脅迫類(lèi)響應(yīng)元件,如低溫/脫水響應(yīng)元件(DRE,核心序列ACCGAGA)(圖3-C)。還包括MYB、MYC 轉(zhuǎn)錄因子識(shí)別(CAACGG)與 結(jié) 合(CAACAG) 序列,MYBHv1 結(jié)合元件(CCAAT-box,核心序列CAACGG),從而具備與多種信號(hào)轉(zhuǎn)導(dǎo)系統(tǒng)互作的通路,同時(shí),具有多個(gè)光信號(hào)響應(yīng)元件(ATC-motif,核心序列AGTAATCT;GT1-box,核心序列GGTTAA;Gap-box,核心序列CAAATGAA;TCCC-motif, 核心序列TCTCCCT;TCT-motif,核心序列TCTTAC)(圖3-D)。另外,通過(guò)GenBank 數(shù)據(jù)庫(kù)下載JcDnaJ20基因上游5000 bp 啟動(dòng)子序列,與克隆的2 023 bp 序列相似性為99.8%,且在克隆序列的上游鑒定到更多的與防御、脅迫相關(guān)的響應(yīng)元件(TC-rich repeats,核心序列GTTTTCTTAC)。

圖3 小桐子JcDnaJ20p 啟動(dòng)子順式作用元件的分析
2.3 煙草葉片GUS活性的組織化學(xué)染色
以轉(zhuǎn)化空質(zhì)粒pCambia1381Z-GUS、35S啟動(dòng)子融合GUS的載體pCambia1381Z-35S-GUS 為對(duì)照,將pCambia1381Z-JcDnaJ20p-GUS 重組載體采用農(nóng)桿菌滲透法轉(zhuǎn)化煙草葉片,之后以常溫25℃為對(duì)照,分別置于15、4℃經(jīng)過(guò)低溫處理24 h 后進(jìn)行GUS 染色。結(jié)果顯示,轉(zhuǎn)化pCambia1381Z-GUS 的煙草葉片,由于缺乏啟動(dòng)子,GUS報(bào)告基因在3 個(gè)溫度下都沒(méi)有表達(dá),而轉(zhuǎn)化pCambia1381Z-35S-GUS 的煙草葉片在3 個(gè)溫度下都檢測(cè)到GUS表達(dá)活性,但染色深度基本一致,與35S 啟動(dòng)子為組成型啟動(dòng)子的特性一致。另外,轉(zhuǎn)化pCambia1381Z-JcDnaJ20p-GUS 的煙草葉片在3 個(gè)溫度下也都表現(xiàn)出GUS表達(dá)活性,且隨著溫度的降低,表達(dá)量逐漸升高,GUS 染色的顏色也逐漸加深(圖4),表明小桐子JcDnaJ20p 啟動(dòng)子具有啟動(dòng)子活性,且屬于低溫誘導(dǎo)型啟動(dòng)子。

圖4 轉(zhuǎn)基因煙草葉片的GUS 組織化學(xué)染色
3 討論
功能基因啟動(dòng)子區(qū)域的不同順式作用元件決定了該基因的誘導(dǎo)表達(dá)模式。通過(guò)分析發(fā)現(xiàn),小桐子JcDnaJ20基因啟動(dòng)子區(qū)除了具有真核生物典型核心啟動(dòng)子元件CAAT-box 和TATA-box 外,也鑒定到低溫、干旱響應(yīng)DRE 元件(Dehydration Responsive element),文獻(xiàn)報(bào)道,DRE 順式作用元件普遍存在于干旱、高鹽、低溫脅迫應(yīng)答基因的啟動(dòng)子中[10-11],說(shuō)明其可能參與小桐子抗冷性與抗旱性的脅迫響應(yīng)過(guò)程。同時(shí),還鑒定到參與多種脅迫調(diào)節(jié)的MYB元件、MYC 元件。如擬南芥抗逆rd(Responsive to drought)系列基因都包含MYB 元件[21],另外,擬南芥低溫誘導(dǎo)CBF系列基因都包含MYC 元件[22],暗示JcDnaJ20基因及其啟動(dòng)子在小桐子抗冷性及其他抗逆性響應(yīng)中發(fā)揮重要作用,成為未來(lái)小桐子轉(zhuǎn)基因研究的主要候選功能基因。
植物逆境誘導(dǎo)型啟動(dòng)子,對(duì)下游調(diào)控基因只在逆境脅迫條件下才誘導(dǎo)其表達(dá),避免過(guò)量表達(dá)浪費(fèi)植物的物質(zhì)與能源而導(dǎo)致生長(zhǎng)發(fā)育障礙[1-3,14]。目前,國(guó)內(nèi)外對(duì)植物低溫信號(hào)轉(zhuǎn)導(dǎo)機(jī)制以及低溫誘導(dǎo)啟動(dòng)子已有一些報(bào)道。cor15a作為典型的低溫誘導(dǎo)基因,其過(guò)量表達(dá)能顯著提高擬南芥的低溫抵抗能力,同時(shí)cor15a基因啟動(dòng)子也具有低溫誘導(dǎo)表達(dá)特性[11]。將該啟動(dòng)子與GUS標(biāo)記基因構(gòu)建融合表達(dá)載體并轉(zhuǎn)化馬鈴薯表明,經(jīng)過(guò)低溫處理的轉(zhuǎn)基因馬鈴薯葉片都檢測(cè)到GUS 產(chǎn)物,而未經(jīng)低溫處理的對(duì)照組則未檢測(cè)到GUS 活性[23]。低溫冷害誘發(fā)的次級(jí)水分脅迫也被認(rèn)為是冷害的主要原因之一,在擬南芥rd29A啟動(dòng)子區(qū)域鑒定到干旱、低溫及高鹽脅迫響應(yīng)的順式作用元件[10]。Kasuga 等[24]將組成型啟動(dòng)子CaMV35S 與低溫誘導(dǎo)啟動(dòng)子rd29A驅(qū)動(dòng)的CBF基因在轉(zhuǎn)基因煙草中進(jìn)行表達(dá),發(fā)現(xiàn)兩個(gè)轉(zhuǎn)基因株系都表現(xiàn)出較野生型對(duì)照組更強(qiáng)的抗冷性,且由rd29A驅(qū)動(dòng)的CBF轉(zhuǎn)基因植株比CaMV35S 驅(qū)動(dòng)的轉(zhuǎn)基因植株表現(xiàn)出更弱的生長(zhǎng)抑制。另外,擬南芥ADH 啟動(dòng)子[25]、LT178 啟動(dòng)子[26]、CBF2 啟動(dòng)子[27],小麥mwcs120 啟動(dòng)子[28],水稻Tdcor39 啟動(dòng)子[29]及大麥blt4.9 啟動(dòng)子[30]也都表現(xiàn)出低溫誘導(dǎo)特性,DnaJ20基因是小桐子低溫誘導(dǎo)上調(diào)表達(dá)較顯著的基因,屬于分子伴侶DnaJ基因家族,煙草瞬轉(zhuǎn)及低溫誘導(dǎo)表達(dá)證明,該基因啟動(dòng)子能夠提高GUS基因的表達(dá)量,具有低溫誘導(dǎo)啟動(dòng)子活性。本研究對(duì)深入理解低溫脅迫下DnaJ基因家族的作用機(jī)制奠定了基礎(chǔ),同時(shí)為后續(xù)小桐子抗冷育種的研究積累了潛在基因資源。
4 結(jié)論
轉(zhuǎn)錄組測(cè)序表明,DnaJ20基因是小桐子低溫誘導(dǎo)高表達(dá)基因。本研究克隆到小桐子DnaJ20基因上游2 023 bp 的啟動(dòng)子序列,PlantCARE 分析表明,該啟動(dòng)子中包含低溫脅迫等響應(yīng)元件。同時(shí),成功構(gòu)建了該啟動(dòng)子驅(qū)動(dòng)的GUS標(biāo)記基因的植物表達(dá)載體,通過(guò)煙草瞬時(shí)轉(zhuǎn)化表達(dá)顯示,該啟動(dòng)子能夠顯著提高GUS基因的表達(dá)量,具有低溫誘導(dǎo)啟動(dòng)子活性。