五味子乙素對博來霉素誘導小鼠肺纖維化的干預作用及機制研究
趙紅舟 龍杞 劉肇恒 顧瀟楓 龐慶祿 焦揚
特發性肺纖維化(idiopathic pulmonary fibrosis,IPF)是一種慢性、炎癥性、間質性肺疾病,具有進行性、不可逆轉和致死性的特點。IPF在世界范圍內的發病率正在逐年增加,從診斷到死亡的平均生存時間只有2~3年[1],5年內的生存率不到40%[2]。近年來有研究發現吡非尼酮和尼達尼布等抗纖維化藥物在改善IPF患者癥狀和延緩肺功能下降等方面具有一定作用,但是此類藥物價格昂貴,而且其安全性尚未得到充分證明[3]。因此,研究IPF的發病機制和治療方法,對于指導臨床具有重要的意義。一般認為,特發性肺纖維化的形成機制包括肺泡上皮細胞損傷、氧化應激、炎癥反應、細胞凋亡等,并在此基礎上釋放細胞因子等活性物質,刺激肌成纖維細胞增殖分化,促使肺成纖維細胞灶形成和膠原沉積,進而導致細胞外基質(extracellular matrix,ECM)的大量合成,最終導致IPF[4]。
五味子為木蘭科五味子的干燥成熟果實,其皮肉甘酸,核中苦辛,皆有咸味,五味具備,故名之。現代藥理學研究表明五味子的成分主要源于木脂素類化合物,其中五味子乙素(Schisandrin B, Sch B)含量最高,現代藥理研究發現,它具有保護中樞神經系統、抗炎、抗氧化、抗腫瘤、保肝等多種藥理作用[5-8]。眾多實驗表明其能夠升高細胞內超氧化物歧化酶超氧化物歧化酶(Superoxide dismutase,SOD)水平,抑制脂質過氧化反應,減少乳酸脫氫酶、丙二醛和活性氧的釋放,并可直接清除自由基,發揮抗氧化作用[9]。通過文獻整理回顧近年來關于五味子乙素對肺纖維化的基礎研究可以發現,多是集中在從抗炎機制和抑制轉化生長因子β1蛋白通路等角度為切入點,對于其抗氧化機制的干預研究未曾探討。本實驗從分析肺組織染色結果,以及相關的纖維化、氧化及抗氧化指標水平的改變,研究五味子乙素對博來霉素所致的小鼠肺纖維化的干預作用,從氧化應激與抗氧化的角度探討五味子乙素治療肺間質纖維化的作用機制,為臨床治療提供實驗依據和理論基礎。
1 材料與方法
1.1 實驗動物與材料
C57BL6雄性小鼠24只,體重(20±2)g,購于北京維通利華動物技術公司,生產許可證號:SCXK(京)2016-0001。Sch-B(成都曼斯特生物科技有限公司,純度>98%)、注射用鹽酸博來霉素(Fresenius Kabi 6115292)、異丙醇(國藥40064360)、無水乙醇(國藥10009218)、TRIZOL(Invitrogen 10296028)、DEPC(MDL MD911875)、超純瓊脂糖(ABI-invitrogen 16500100)、SuperScript III Rt 逆轉錄儀(ABI-invitrogen 11752050)、SOD熒光定量PCR試劑盒(ABI-invitrogen 4472920)、血紅素氧合酶(Heme oxygenase,HO-1)熒光定量PCR試劑盒(ABI-invitrogen 4472920)、羥脯氨酸(hydroxyproline,HYP)的含量 Elisa試劑盒(Dogesce DG94697Q-96T)、血8-異前列腺素(8- Isoprostaglandin,8-iso-PGF) Elisa試劑盒(Dogesce DG94697Q-96T)、臺式高速冷凍離心機(THERMO LEGEND MICRO 21R)、分光光度計(THERMO Nanodrop lite)、移液器(Eppendorf)、熒光定量PCR儀(Applied biosystems Step One Software)、電泳儀(biorad Eps 300)、凝膠成像儀(biorad 2500)。
1.2 實驗分組及干預方法
根據體重將24只小鼠隨機分為空白組、模型組和Sch-B組,每組8只,先適應性喂養1周,然后在異氟烷麻醉的情況下,向模型組和Sch-B組小鼠氣管內滴入1 mL博來霉素稀釋液(含Bleo2.5 u)造模,空白組用同法滴入等量的0.9%氯化鈉注射液。造模后第1天空白組和模型組小鼠每天按(0.01 mL/g)體重灌胃給予0.9%氯化鈉注射液,Sch-B組小鼠每天按(100 mg/kg)體重灌胃給藥,并測量體重變化,隨時調整給藥劑量,觀察各組小鼠的精神及活動狀態,14天后頸椎脫臼處死小鼠,每組隨機抽取三只小鼠取其左肺制作石蠟切片,用于HE和Masson染色并進行鏡下觀察;其余肺組織于液氮中速凍后存于-80℃冰箱中,進行PCR和Elisa測定。
1.3 肺組織病理學觀察
1.3.1 HE染色觀察肺組織炎性程度 先將組織樣本進行常規石蠟包埋,隨后將組織切片放入載玻片上用40℃溫水浸泡,隨后將切片先后放入二甲苯和無水乙醇中浸泡10分鐘,再將其置于85%的乙醇中浸泡5分鐘,待充分水化后將組織樣本切片用PBS溶液浸泡清洗,再用移液法吸取蘇木素染色液,每個組織切片滴加100 μL,充分染色10分鐘,。用1%的鹽酸乙醇將組織切片分化,然后用雙蒸水將組織切片沖洗干凈。將促藍液加入組織切片中,反藍結束后先用清水進行清洗。向組織樣本切片中加入伊紅染液3分鐘,染色完畢后,將組織切片分別用濃度為80%、95%以及無水乙醇進行梯度脫水。將脫水后的組織樣本切片使用二甲苯浸泡8分鐘,使用中性樹膠封片,行顯微鏡下觀察。肺泡炎性分級和評分標準參照Szapiel等方法[10]:0級:無肺泡炎,記0分;1級:輕度肺泡炎,鏡下觀察可見肺泡隔浸潤增厚,但病變范圍不超過全肺20%,肺泡結構未見明顯改變,記1分;2級:中度肺泡炎,肺泡炎癥病變面積占全肺的20%~50%,肺泡結構發生變化,記2分;3級:重度肺泡炎,病變范圍超過全肺面積的50%,肺泡腔可見炎性細胞及紅細胞,記3分。
1.3.2 Masson染色觀察肺組織纖維化程度 先將組織樣本進行常規石蠟包埋,再用4%多聚甲醛固定切片,脫蠟后入重鉻酸鉀—醋酸液1小時,水洗后染Regaud氏蘇木素10分鐘,再次充分水洗后,用2%鹽酸酒精分化,流水沖洗至藍黑色,加入1%麗春紅酸性品紅液染色5分鐘;隨后用蒸餾水進行水洗,加入1%磷鉬酸水溶液媒染5分鐘;然后入1%醋酸液分色1分鐘,最后進行脫水處理并用中性樹膠封固,行鏡下組織觀察。用Image-J軟件對Masson染色結果進行圖像處理分析,每張切片隨機選取5個不重疊視野(×200),評價肺纖維化程度,肺纖維化百分比=肺纖維化面積/肺組織面積×100%。
1.4 熒光定量PCR檢測SOD、HO-1
取100 mg右肺組織加入1 mL的Trizol,電動勻漿,冰上反應30分鐘后轉移到1.5 mL無菌無酶EP管中。按照哺乳動物蛋白RNA提取試劑盒說明書提取各組總RNA并逆轉錄為cDNA,采用SYBR一步法熒光定量PCR試劑盒定量分析HO-1、SOD的表達。計算出樣品的△CT值,以比較域值法將其與同一樣本內參基因β-actin的△CT值做相應對比。
1.5 酶聯免疫吸附試驗(ELISA)法測定8-iso-PGF、HYP
先在酶標包被板上標準品準確加樣50 μL,待測樣品孔中先加樣品稀釋液40 μL,然后再加待測樣品10 μL。將樣品加于酶標板孔底部,輕輕晃動混勻。再用封板膜封板后置37℃溫育約30分鐘,將30倍濃縮洗滌液用蒸餾水30倍稀釋后備用,然后揭掉封板膜,棄去液體,甩干后每孔加滿洗滌液,靜置30秒后棄去,如此重復5次后拍干。每孔分別加入顯色劑A50 μL和顯色劑B50 μL,輕輕震蕩混勻,37℃避光顯色約10分鐘,再加入終止液50 μL。以空白空調零,450 nm波長依序測量各孔的吸光度(OD值)。
1.6 統計學處理
2 結果
2.1 各組小鼠肺組織HE染色炎癥評分比較
空白組小鼠肺組織結構正常,肺內結構清晰,肺泡間隔正常,無明顯水腫、炎癥或纖維化的表現;與空白組相比,模型組小鼠肺泡結構破壞明顯,肺泡腔萎縮消失,肺泡間隔明顯增厚,部分肺間質被纖維細胞替代,有明顯的肺間質纖維化形成,并伴有炎性細胞浸潤,肺泡炎癥評分相比空白組明顯升高(P<0.01);與模型組相比,Sch-B組小鼠肺泡破壞和間隔增厚程度較輕,炎癥細胞浸潤較少,肺間質纖維化程度較輕,肺泡結構破壞程度和炎癥程度明顯減輕(P<0.01),但Sch-B組的炎癥程度和纖維化程度明顯高于空白組(P<0.01)。見表1、圖1。
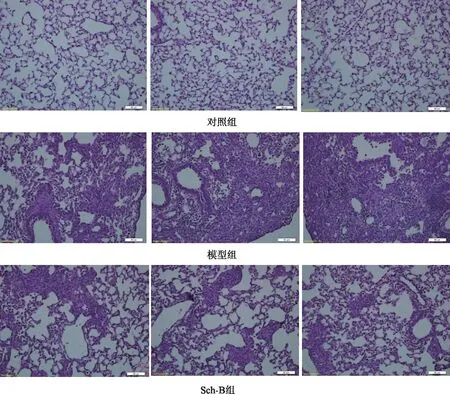
圖1 各組小鼠肺組織HE染色情況(×200)
2.2 各組小鼠肺組織Masson染色纖維化定量分析
空白組小鼠肺組織肺泡結構正常,藍染區域較少;與空白組相比,模型組小鼠的肺組織肺泡結構明顯被破壞,伴有肺泡融合,肺間質、支氣管壁和肺泡隔被藍染區域的面積明顯增加,間質膠原增生沉積呈彌漫性、片狀、束狀樣改變,有明顯的膠原纖維形成,肺纖維化程度明顯(P<0.01);與模型組相比,Sch-B組小鼠肺組織肺泡結構破壞程度較輕,肺間質、支氣管壁和肺泡隔被藍染區域的面積有所減少,膠原纖維的形成和膠原沉積面積均減少(P<0.01),但Sch-B組的膠原沉積面積明顯高于空白組(P<0.01)。見下表1、圖2。

圖2 各組小鼠肺組織Masson染色情況(×200)
表1 各組小鼠肺泡炎性評分和肺纖維化面積百分比比較
2.3 各組小鼠SOD和HO-1水平測定結果
與空白組小鼠相比,模型組小鼠SOD和HO-1水平均明顯降低(P<0.01);與模型組相比,Sch-B組小鼠SOD和HO-1水平均明顯升高,差異具有統計學意義(P<0.01),與空白組小鼠相比降低均不明顯(P>0.05),表明五味子乙素可以提高SOD和HO-1水平,具有抗氧化的作用,經干預后,Sch-B組小鼠的SOD含量和HO-1的相對表達量基本恢復至對照組水平。見表2。
表2 各組小鼠肺SOD和HO-1水平比較
2.4 各組小鼠HYP和8-iso-PGF水平測定結果
與空白組小鼠相比,模型組小鼠HYP水平明顯升高(P<0.01);與模型組相比,Sch-B組小鼠HYP水平明顯降低,差異具有統計學意義(P<0.01),表明五味子乙素能顯著抑制HYP的合成,減少肺間質膠原的形成,從而減輕纖維化的程度,但Sch-B組與空白組相比HYP水平明顯升高(P<0.01)。與空白組小鼠相比,模型組小鼠8-iso-PGF水平明顯升高(P<0.01);與模型組相比,Sch-B組小鼠8-iso-PGF水平明顯降低,差異具有統計學意義(P<0.01),表明五味子乙素能減少8-iso-PGF的含量,從而減輕氧化反應的程度,但Sch-B組與空白組相比8-iso-PGF水平明顯升高(P<0.01)。見下表3。
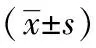
表3 各組小鼠HYP和8-iso-PGF水平比較
3 討論
目前研究認為肺纖維化的形成過程與肺泡上皮細胞的損傷有關,在氧化應激、炎癥反應、細胞凋亡等基礎之上,大量的細胞因子等活性物質被釋放,刺激肌成纖維細胞的增殖和分化,促使肺成纖維細胞灶形成和膠原蛋白沉積,然后大量合成ECM,最終形成IPF[11]。其中氧化與抗氧化關系的失衡通常被認為是導致細胞結構氧化損傷進而導致肺纖維化的重要因素之一[12],活性氧的增加可引起氧化損傷,還能激活纖維化的相關信號通路,最終導致肺結構細胞異常增生、新生血管形成、細胞外膠原沉積等纖維化樣改變,機體內的各種抗氧化大分子、小分子和酶的活性,可反映機體清除活性氧基團及分子的能力,能客觀反映抗氧化能力的強弱。
SOD和HO-1分別反映了機體清除氧自由基和對組織氧化損傷的保護能力[9,13],可通過抗氧化應激的機制減輕肺組織纖維化,這種保護作用可能與通過抑制活性氧基團及分子的產生、抑制促纖維化因子纖溶酶原激活物的表達有關,在延緩肺損傷、肺纖維化、肺腫瘤等肺部疾病的發病過程中有著重要的作用。HYP則直接反映肺纖維化的程度,肺間質纖維化的特征表現為成纖維細胞異常增殖和細胞外基質在肺組織內的過多沉積,肺纖維化初期各種生物活性因子誘導纖維母細胞合成、分泌大量膠原蛋白成分,使肺間質膠原明顯增加,構成了肺纖維化的病理學基礎,作為膠原特有成分的HYP可動態反應肺纖維化的病變進展情況。8-iso-PGF是前列腺素的異構體,是自由基對脂質(如脂膜的不飽和脂肪酸)造成自由基損傷后的特定產物,有研究證明8-異前列腺素可通過凝血酶/前列腺TP受體誘導大鼠氣道高反應性,是評價氧化應激程度的生物學指標[14-15]。
本研究的病理切片結果表明,與模型組相比,五味子乙素可以減輕小鼠肺泡炎癥程度和肺纖維化程度,表明其具有一定的抗纖維化作用。實驗結果顯示五味子乙素能明顯升高肺組織中SOD和HO-1水平、降低HYP和8-iso-PGF水平,表明其可能通過減輕氧化反應和提高抗氧化水平的作用來發揮抗肺纖維化的作用。
周平安教授根據幾十年的臨床經驗總結,認為五味子在治療肺纖維化等方面有較好的療效,在此基礎上查閱文獻得知,其主要成分五味子乙素具有抗炎、抗氧化等多種藥理作用,此前關于五味子乙素的研究多是集中在肝纖維化、腎纖維化等方面,尚未從抗氧化的角度研究對肺纖維化的干預作用,因此,本課題組選用五味子乙素作為研究對象,探討其對肺纖維化的干預作用。
綜上所述,五味子乙素可能通過提高組織抗氧化水平、減輕氧化應激反應,從而抑制膠原纖維的合成,達到抑制和延緩肺纖維化進展的目的,減輕肺纖維化的程度,深入研究其作用機制可為五味子的臨床應用奠定理論和實驗基礎。

