截斷逆挽方對慢加急性肝衰竭大鼠cyclin D-E2F1信號通路及轉錄因子活化的機制研究
方嫻 姜雪嬌 侯偉欣 房鵬 張秋云
慢加急性肝衰竭(acute-on-chronic liver failure,ACLF)是在引起急性肝損傷誘因的作用下,肝功能相對穩定的慢性肝病患者急速惡化并發生肝衰竭的綜合征[1]。該病目前沒有特異性治療手段,臨床上多以抗病毒、人工肝支持治療,療效不理想,短期病死率為50%~90%[2]。肝移植是目前唯一能提高患者長期生存率的手段,但由于肝源嚴重不足,故使用受限。ACLF的發病機制被認為可能與肝細胞大量凋亡和肝細胞再生障礙不足有關[3]。相關研究結果顯示,ACLF患者肝臟中缺乏有效的肝細胞復制是其死亡率較高的原因之一[4],ACLF中肝祖細胞(hepatic progenitor cell,HPC)的激活能誘導肝臟進行再生二級反應,從而誘導肝細胞增殖,改善肝臟損傷,避免ACLF進一步惡化[5]。因此恢復肝臟的正常再生能力在急性發作期肝衰竭的治療中具有廣闊的前景。截斷逆挽方是由全國名中醫錢英教授創制的臨床治療ACLF的有效方劑,本課題組前期研究結果提示:本方能減輕ACLF模型大鼠肝組織炎性損傷、抑制肝細胞過度凋亡,并能預防給藥后促進肝細胞代償性增殖[6-7]。本研究在此基礎上觀察截斷逆挽方對ACLF大鼠肝功能、凝血酶原活動度及肝臟病理的改善情況,考察肝細胞再生過程中的關鍵基因cyclin D1、cyclin D2、cyclin D3、細胞周期蛋白依賴性激酶4(cyclin-dependent kinase 4,CDK4)、CDK6及關鍵蛋白DP1表達量的影響,進一步探討證核該方通過調節cyclinD-E2F1肝細胞增殖通路相關轉錄因子治療ACLF大鼠肝損傷及修復機制。
1 材料與方法
1.1 實驗動物
選用SPF級Wistar雄性大鼠105只,體重(180±20)g,由北京維通利華實驗動物技術有限公司提供,動物許可證編號SCXK(京)2016-0006。飼養置首都醫科大學動物房,相對恒溫(25℃),恒濕(55%),每隔12小時光照明暗交替,每籠3只,自由攝食飲水。
1.2 干預治療藥物與主要試劑
截斷逆挽方(組成:苦味葉下珠30 g、瓜蔞30 g、金錢草30 g、黃芪30 g、槲寄生30 g、三七6 g、生地黃20 g、莪術6 g、丹參20 g、炮附子先煎15 g)購于北京同仁堂中醫醫院中藥房,根據課題組前期研究,水煎及濃縮至4.34 g/mL,保存于滅菌玻璃瓶內,4℃冰箱保存,使用前水浴加熱。
人血清白蛋白(貨號:A9731-5G,美國,Sigma);D-氨基半乳糖(貨號:G0500-25G,美國,Sigma);脂多糖(貨號:109K4075,美國,Sigma);Anti-DP1(美國,abcam);β-actin(美國,abcam);RNA Prep Pure動物組織總RNA提取試劑盒、TIAN Script cDNA、Real Master Mix(SYBR Green)均購于天根生化科技有限公司;引物序列cyclin D1、cyclin D2、cyclin D3、CDK4、CDK6(TaKaRa)。
1.3 主要實驗儀器
低溫離心機(Hettich,Universal 320R);全自動多功能酶標儀(MULTISKAN MK3,美國Thermo);梯度RT PCR儀(Bio-Rad,美國);垂直電泳儀(Bio-Rad,美國);Fujifilm成像系統(LAS3000,日本);超細勻漿器(Fluko,F6/10);高速離心機(Sigma,1-14,美國);全自動生化分析儀(Hitachi,7600);凝血分析儀(Beckman Coulter,ACL-TOP700)。
1.4 實驗方法
1.4.1 分組、ACLF大鼠模型的建立及給藥 隨機選擇5只大鼠作為正常組,其余100只Wistar大鼠根據文獻[8]方法建立ACLF大鼠模型,予皮下注射人血清白蛋白(human serum albumin,HSA)0.5 mL,4次后眼眶采血檢測是否致敏,取人血白蛋白抗體陽性大鼠予尾靜脈注射HSA,每只0.5 mL,一周兩次,連續注射6周,正常組每次予等量生理鹽水注射。隨后對100只造模組大鼠行肝活檢,取肝纖維化Ⅲ級以上大鼠繼續尾靜脈注射,2周后肝硬化模型成功60只。將60只同時予以D-氨基半乳糖(D-galactosamine,D-GalN)(400 mg/kg)聯合脂多糖(lipopolysaccharide,LPS)(100 μg/kg)腹腔注射,死亡30只,最終ACLF大鼠成模30只。將30只成模大鼠分為截斷逆挽方5、10、15天組及模型5、10、15天組,每組5只。截斷逆挽方組在成模24小時后予截斷逆挽方濃煎劑連續灌胃5、10、15天,1次/天,依照課題組前期研究將給藥體積定為5 mL/kg,模型組與正常組予等量生理鹽水,各組灌胃后于5、10、15天分別平行摘取右葉統一部份置10%福爾馬林,其余肝組織剪碎于液氮中凍存,放入-80℃冰箱保存。
1.4.2 各組大鼠血漿凝血酶原活動度(prothrombinase activity ,PTA)、血清肝功能檢測 大鼠腹主動脈取血12 mL,3 mL置于肝素鈉抗凝管內,4℃,3000 r/min,離心20分鐘分離血漿,靜置1小時后于凝血分析儀檢測血漿PTA,上層血清置于10 mL真空采血管全自動生化分析儀測定谷丙轉氨酶(alanine aminotransferase,ALT)、谷草轉氨酶(aspartate aminotransferase,AST)、總膽紅素(total Bilirubin,TBIL)含量。
1.4.3 觀察肝組織病理改變 每組選擇5只大鼠取肝右葉相同部位組織,磷酸緩沖鹽溶液涮洗后放置10%福爾馬林溶液中固定12~24小時,進行石蠟包埋、切片、HE染色。Pannoramic scan全自動切片掃描儀進行明場下全幅圖像掃描,利用CaseViewer2.3導出圖片,觀察各組大鼠肝組織的結構和病理改變。
1.4.4 Real-Time PCR法檢測cyclin D1、cyclin D2、cyclin D3、CDK4、CDK6 mRNA的表達 根據動物組織總RNA提取試劑盒的說明書驟將肝組織稱量、裂解、研磨提取總RNA。取2 μL樣品在酶標儀上檢測其純度及濃度,保留A260/A280在1.8~2.2的樣品繼續逆轉錄,方法依照cDNA第一鏈合成試劑盒說明書進行。將逆轉錄所得cDNA作為擴增模板,在反應體系中加入所得目的基因cyclin D1、cyclin D2、cyclin D3、CDK4、CDK6和內參對照基因β-actin的引物,在反應條件為95℃(15分鐘)、95℃(10秒)、60℃(20秒)、72℃(30秒)下循環40次進行目的基因的擴增。將該模板和內參的CT值拷貝并存為線性關系,數據采用2-△△CT法進行分析。各基因引物序列,詳見表1。

表1 各基因引物序列
1.4.5 蛋白免疫印跡法檢測各組組織DP1蛋白表達 -80℃冰箱取出肝組織,按比例加入配制好的蛋白裂解液(由蛋白提取液、蛋白酶抑制劑、PMSF按比例混合),充分勻漿。30分鐘后,4℃,12000 r/min離心15分鐘取上清液,按照BCA蛋白提取試劑盒說明書進行蛋白定量,并測定蛋白濃度,水浴至蛋白變性。每支取30 μg上樣,進行SDS-PAGE電泳,將蛋白轉膜至PVDF膜上,5%脫脂奶粉封閉1小時,一抗(1∶100)4℃過夜,TBST洗膜后,二抗(1∶10000)室溫孵育1小時,洗膜后顯影成像,Image J計算灰度值比值。
1.5 統計學處理
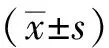
2 結果
2.1 截斷逆挽方對各組大鼠血漿PTA檢測結果比較
結果顯示,與正常組相比,模型組大鼠血漿PTA隨時間演進明顯降低,且有顯著差異(P<0.01),在15天時達到最低點。與同一時間模型組相較,截斷逆挽方組大鼠血漿PTA均有上調趨勢,且截斷逆挽方10天、15天組差異明顯(P<0.05)。結果見表2。
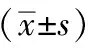
表2 截斷逆挽方對各組大鼠血漿PTA結果比較
2.2 截斷逆挽方對各組大鼠血清肝功能檢測結果比較
結果顯示,與正常組相較,模型組大鼠血清肝功能ALT、AST、TBIL隨時間進展顯著升高(P<0.01),符合ACLF大鼠模型表現。與同一時間模型組相較,截斷逆挽方組血清ALT、AST、TBIL均有不同程度下調,且差異有統計學意義(P<0.05)。結果見表3。
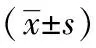
表3 截斷逆挽方對各組大鼠血清肝功能結果比較
2.3 截斷逆挽方對各組大鼠肝組織HE染色病理的影響
正常組大鼠肝臟組織 HE 染色顯示肝小葉結構清晰,匯管區形態完整,肝細胞排列整齊,細胞核居中,未見炎細胞浸潤和間質反應性增生。模型5天組大鼠肝組織可見匯管區纖維組織增生,肝細胞胞漿疏松化氣球樣變,肝竇受壓變窄,門管區和肝小葉內有不同程度的炎細胞浸潤和嗜酸性小體形成,且肝細胞壞死灶隨時間延長范圍逐漸擴大。模型10天組可見點狀、碎屑狀壞死,庫普弗細胞增生。模型15天組可見彌漫性大塊壞死,纖維組織將肝小葉分割包繞成假小葉,纖維間隔變寬且薄厚不均,網狀纖維支架塌陷。與同一時間點模型組相比,截斷逆推方組肝組織損傷程度較輕,截斷逆挽方10天組可見壞死細胞鄰近有再生的肝細胞,核大且染色較深,假小葉內細胞排列較規則。截斷逆挽方15天組可見大面積的肝細胞溶解但網狀纖維支架尚存。見圖1。
2.4 截斷逆挽方對各組大鼠肝組織中cyclin D1、cyclin D2、cyclin D3、CDK4、CDK6 mRNA表達的影響
PCR檢測結果顯示:與正常組相比,模型組5天組cyclin D1、cyclin D2、cyclin D3、CDK4、CDK6 mRNA表達量升高,隨著時間的進展,表達量逐漸降低,差異無統計學意義(P<0.05)。與同一時間模型組相比,截斷逆挽方組cyclin D1、cyclin D2、cyclin D3、CDK4、CDK6 mRNA表達量均有不同程度的上調,其中截斷逆挽方10天組差異最為顯著(P<0.01),且截斷逆挽方15天組各基因表達量與正常組相比差異有統計學意義(P<0.05)。結果見表4。
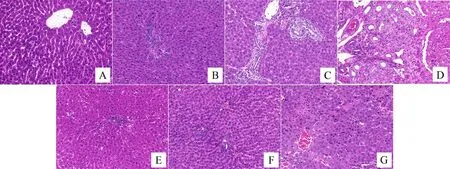
注:A:正常組;B:模型5天組;C:模型10天組;D模型15天組;E:截斷逆挽方5天組;F:截斷逆挽方10天組;G:截斷逆挽方15天組。
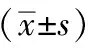
表4 截斷逆挽方對各組大鼠cyclin D1、cyclin D2、cyclin D3、CDK4、CDK6 mRNA的相對表達量
2.5 截斷逆挽方對各組大鼠肝組織中DP1蛋白表達的影響
蛋白免疫印跡法檢測結果顯示,與正常組相較,模型5天組DP1蛋白表達升高,差異具有統計學意義(P<0.05),隨時間進展模型組表達量呈逐漸降低趨勢。與同一時間點模型組相較,截斷逆挽方10天組DP1的表達量明顯上調 (P<0.05),截斷逆挽方15天組DP1的表達量較10天組有所降低,但與同一時間點的模型組比較差異仍然具有統計學意義(P<0.05)。結果見表5、圖2。

注:A:正常組;B: 截斷逆挽方5天組;C: 截斷逆挽方10天組;D:截斷逆挽方15天組;E:模型5天組;F:模型10天組;G:模型15天組。
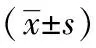
表5 截斷逆挽方對各組大鼠DP1蛋白相對表達量灰度值比較
3 討論
ACLF發病機制十分復雜,目前被認為其與機體內的特殊的免疫、炎癥反應,免疫系統失衡等相關,受到損傷的肝細胞釋放損傷相關模式分子,進一步釋放促炎癥因子等因素,造成肝臟過度的炎癥反應導致肝細胞的過度凋亡[9]。但慢加急性肝衰竭具有潛在可逆性,有研究表明肝祖細胞與星狀細胞存在顯著相關性,具有干細胞功能所需的信號傳導途徑,可誘導肝細胞再生,逆轉ACLF惡化[10]。
全國名中醫錢英教授認為:ACLF的中醫病機多為“濕熱疫毒”損傷機體,充斥三焦,氣機不暢,久則生瘀,肝絡瘀阻,正虛邪陷,具有“毒瘀與正虛交織”的特點,并創立了截斷逆挽方[11],意在清熱祛濕、解毒散瘀以治標,調補肝脾腎以治本,扶正與祛邪并用,同調肝體與肝用。方中生黃芪、槲寄生補氣益衛,滋補肝腎,顧護正氣,提高機體免疫力,從而激發肝細胞再生復制;苦味葉下珠、瓜蔞、金錢草具有抗病毒、抗炎等作用,可有效降低ALT、AST水平,保護肝細胞膜正常流動性與完整性[12-13],從而起到保肝功效;丹參、莪術可化瘀通絡,改善外周循環,具有調節組織恢復與再生能力[14];三七、生地、黑附片可以調節細胞免疫和體液免疫,調補陰陽,補腎以調肝,幫助恢復肝組織形態及功能。
既往研究表明,肝臟細胞在處于非病理狀態下為靜止期(G0)。細胞周期中的第一個間隔期(G1)為確定細胞是否要啟動DNA復制的關鍵期。cyclin D作為G1期調節因子可成為生長因子的靶標,它依賴于細胞外信號進行表達,可將細胞外的信號整合到核心細胞周期調節劑中,并激活CDK4/6,形成cyclin D-CDK復合物,誘導細胞過渡至S期。且cyclin D為不穩定蛋白(半衰期約10~20分鐘),當細胞受到生長因子刺激時,cyclin D的表達才能得以維持[15-16]。cyclin D由三個不同但密切相關的亞家族(D1,D2和D3)組成,每種D型細胞周期蛋白都可以激活CDK4和CDK6,D2和D3也可以與CDK2功能性相互作用,且D1和D2基因的啟動子包含典型的E2F家族識別位點[17]。當細胞被提示進入增殖期時,cyclin D-CDK4與cyclin D -CDK6復合物的最重要功能是在G1中期至晚期磷酸化視網膜母細胞瘤蛋白(pRb),并中和pRb的抗增殖活性[18],同時隔離p27(CDK抑制劑)。在靜止期時DP1-E2F DNA異二聚體與pRb結合處于轉錄失活狀態,cyclin D-CDK4/6復合物在磷酸化pRB的同時,DP1-E2F異二聚體的轉錄活性得以釋放,成功誘導細胞進入S期[19]。可以說,E2F1增殖通路介導的cyclin D-CDK4/6復合物釋放DP1轉錄因子引發了肝細胞從G1期過渡到S期特異性轉錄模式的分子開關,啟動了肝細胞再生復制。
本研究結果顯示:在療效評價指標方面,與同一時間模型組大鼠相較,各治療組大鼠ALT、AST、TBIL顯著下降,PTA明顯升高;肝組織HE染色病理觀察,可見炎細胞浸潤、肝細胞壞死情況均較輕,雖然有間質反應性增生和假小葉形成,但網狀纖維結構尚存,有利于肝細胞復制及恢復組織形態及功能。在機制研究指標方面,模型組5天時cyclin D1、cyclin D2、cyclin D3 、DP1表達量較正常組明顯升高,但隨時間進展,表達量逐漸降低,15天組表達量基本趨于正常組。截斷逆挽方10天、15天組cyclin D1、cyclin D2、cyclin D3、CDK4、CDK6、DP1表達量較同一時間模型組均有不同程度上調(P<0.05)。推測其原因是因為由于急性攻擊后肝細胞大量損傷,刺激肝細胞開始短暫的代償性增殖,但D型細胞周期蛋白為不穩定蛋白,在缺乏生長因子的長期刺激下,cyclin D逐漸降低表達,減緩釋放E2F家族蛋白DP1,細胞周期停滯。此時肝細胞代償增殖的能力不足于抵抗肝細胞過度凋亡則會導致肝衰竭。有研究表明cyclin D-CDK4/6復合物的活性首先在G1中期被檢測到,在G1/S轉變附近達到最大值,并在增殖細胞中保持高值[20]。因此截斷逆挽方10天、15天組各轉錄因子的高表達表明截斷逆挽方連續給藥能加快ACLF大鼠肝細胞從G1期向S期的過渡,幫助肝細胞進入持續增殖狀態從而扭轉肝衰竭的進程。截斷逆挽方組方較為復雜,有效藥理成分尚不完全清楚,推測其作用可能與該方刺激D型周期蛋白上游生長因子有關,有待進一步研究。
綜上,截斷逆挽方可通過上調cyclin D-E2F1信號通路上cyclin D1、cyclin D2、cyclin D3、CDK4、CDK6基因的表達及轉錄因子DP1表達量,加速肝細胞再生復制,保持持續穩定的增殖,從而改善肝功能,減輕凝血障礙,扭轉肝衰竭進程,為臨床推廣運用該方提供了新的理論依據。

