乳香、沒藥揮發油促九分散方中生物堿類成分的HaCaT細胞攝取及其機制研究
高 玲,黃詩雨,陳麗華,李瑛瑛,管詠梅,劉麗麗,朱衛豐
乳香、沒藥揮發油促九分散方中生物堿類成分的HaCaT細胞攝取及其機制研究
高 玲,黃詩雨,陳麗華*,李瑛瑛,管詠梅,劉麗麗,朱衛豐
江西中醫藥大學 現代中藥制劑教育部重點實驗室,江西 南昌 330004
研究九分散中乳香、沒藥揮發油促進角質形成細胞HaCaT攝取馬錢子堿、士的寧及鹽酸麻黃堿的作用及其機制。采用CCK-8法檢測乳香、沒藥揮發油單用/藥對與九分散方中馬錢子堿、士的寧、鹽酸麻黃堿配伍對HaCaT細胞存活率的影響;采用液相色譜串聯質譜(LC-MS/MS)定量分析法結合BCA蛋白試劑盒測定在乳香、沒藥揮發油作用下HaCaT細胞對3種生物堿(馬錢子堿、士的寧及鹽酸麻黃堿)細胞攝取的影響;以DiBAC4(3)為熒光探針,利用流式細胞儀測定乳香、沒藥揮發油對HaCaT細胞膜電位的影響。不同乳香、沒藥揮發油均對3種生物堿有一定促透作用,且對脂溶性成分馬錢子堿、士的寧的促透效果較水溶性成分鹽酸麻黃堿好。乳香、沒藥揮發油分別作用于DiBAC4(3)標記的HaCaT細胞后,可降低HaCaT細胞膜電位,隨著乳香、沒藥揮發油濃度增加,細胞膜電位熒光強度逐漸增強,具有濃度相關性,表現出類似氮酮的作用方式。九分散中乳香、沒藥揮發油均可促進HaCaT細胞攝取3種生物堿,促進機制可能通過影響皮膚表面負電荷而改變皮膚活性表皮屏障作用,從而有利于藥物透過皮膚活性表皮層,其具體機制有待進一步探明。
九分散;乳香揮發油;沒藥揮發油;馬錢子堿;士的寧;鹽酸麻黃堿;細胞膜電位
九分散出自清代費山壽《急救應驗良方》,歷版《中國藥典》均有收載,其處方由馬錢子、麻黃、乳香、沒藥以1∶1∶1∶1配比組成[1],具有活血散瘀、消腫止痛之功效,內服或外用治療跌打損傷、瘀血腫痛。臨床研究表明,九分散用于治療痹癥療效顯著[2-4],但由于處方中馬錢子有毒性,用量較大,且久服易引起中毒,而外用則可降低毒性,且藥物不經胃、腸、肝可直接到達病灶部位而發揮療效,但九分散外用時以酒調敷于患處,其有效成分不易溶出且不易透過皮膚被吸收[5]。為了將九分散處方制成合適的經皮給藥制劑,需對其透皮吸收機制進行深入研究,以選擇適合的劑型。
人永生化角質形成細胞HaCaT是由成人表皮細胞自發轉化而來的細胞系,具有永生性,并與角質形成細胞具有相似的增殖、分化特性,遺傳特性穩定[6],常被用于構建組織工程皮膚進行皮膚屏障功能的評價,同時已成為研究外用透皮用藥經皮滲透能力的一種重要的細胞模型。
現代研究表明乳香、沒藥中的揮發油類成分具有一定的促滲作用[7]。課題組前期研究已發現乳香、沒藥揮發油對川芎中阿魏酸成分具有一定的透皮促滲作用[8],且體外Franz擴散池法及在體微透析透皮實驗均表明乳香、沒藥揮發油對于馬錢子堿、士的寧、鹽酸麻黃堿的經皮滲透確實存在良好的促透作用,且在體給藥時,其促透作用表現得更加明顯。本實驗以表皮角質形成細胞HaCaT為皮膚活性表皮模型,選擇馬錢子中馬錢子堿、士的寧與麻黃中鹽酸麻黃堿作為研究對象,從細胞和分子水平多層次系統探討乳香、沒藥揮發油與3種生物堿配伍的透皮作用及其機制,為九分散經皮轉運機制及新劑型的深入研究提供依據。
1 材料
1.1 細胞
人永生化人永生滑角質形成細胞系HaCaT(上海富衡生物科技有限公司)。
1.2 藥材
乳香、沒藥藥材購于江西江中中藥飲片有限公司(批號分別為181028、181217,于2019年3月20日購買),由江西中醫藥大學中藥鑒定教研室吳志瑰副教授分別鑒定為橄欖科植物乳香樹Birdw.樹皮滲出的樹脂及橄欖科植物地丁樹Engl.的干燥樹脂。
1.3 藥品與試劑
無水硫酸鈉(分析純,批號20180322,西隴化工股份有限公司);馬錢子堿對照品(質量分數≥98%,批號17121401)、士的寧對照品(質量分數≥98%,批號19032003),成都普菲德生物技術有限公司;鹽酸麻黃堿對照品(質量分數100%,批號7U9X-XPOG,中國食品藥品檢定研究院);氮酮(質量分數97%,批號RH137670,上海羅恩化學技術有限公司);CCK-8溶液(批號MAO218-L- Apr-25E,大連美侖生物科技有限公司);胎牛血清(批號11G187,上海伊科賽生物制品有限公司);0.25% EDTA-胰蛋白酶、DMEM高糖培養基、二甲基亞砜(dimethyl sulfoxide,DMSO)、無鈣鎂HBSS、非必需氨基酸購于北京索萊寶科技有限公司;BCA蛋白分析試劑盒(批號20200602,北京索萊寶科技有限公司);TritonX-100(批號20190723H,范德北京生物科技有限公司);DiBAC4(3)熒光探針(批號519A0101,金克隆北京生物技術有限公司);乙腈(色譜純,批號75-05-8,上海羅恩化學技術有限公司);甲酸(色譜純,質量分數98%,批號LR40U51,北京百靈威科技有限公司);細胞培養板(6孔板、96孔板)、T-25培養瓶。
1.4 儀器
SW-CJ-2F超凈工作臺,蘇州凈化設備有限公司;Forma3111二氧化碳培養箱,美國Thermo公司;TS100-F倒置顯微鏡,日本Nikon公司;BD FACSVerse高速分選型流式細胞儀,美國BD公司;MK3酶標儀,美國Thermo公司;AB Sciex Triple Quad? 4500液相色譜-三重四級桿質譜聯用儀,美國AB Sciex公司;HH-2型數顯恒溫水浴鍋,常州朗越儀器制造有限公司;十萬分之一電子天平,德國Sartorius公司;KQ3200E超聲波清洗器,昆明市超聲儀器有限公司;TDZ4A-WS低速臺式離心機,長沙湘儀離心機有限公司;3-18K高速冷凍離心機,德國SIGMA公司。
2 方法
2.1 HaCaT細胞培養
將HaCaT細胞接種于T-25細胞培養瓶中,用含10%胎牛血清、1%非必需氨基酸、1%雙抗(100 U/mL青霉素、100 μg/mL鏈霉素)的高糖型DMEM培養基培養,并置于37 ℃、相對濕度95%,含5% CO2的培養箱中培養。細胞傳代數在50代以內。
2.2 揮發油的提取
乳香、沒藥揮發油均采用《中國藥典》2020年版四部揮發油提取甲法[9]提取,得淡黃油狀溶液,無水硫酸鈉脫水后密封避光保存。混合揮發油為等體積乳香、沒藥揮發油物理混合物;藥對揮發油為等質量乳香、沒藥生藥材混合后采用上述方法提取,得淡黃油狀溶液,無水硫酸鈉脫水后密封避光保存,備用。
2.3 溶液的配制
2.3.1 對照品溶液的配制 分別精密稱取馬錢子堿、士的寧、鹽酸麻黃堿對照品1 mg于1.5 mL離心管中,加入0.1% DMSO超聲溶解,再加入適量DMEM潤洗轉移至量瓶中,并用DMEM定容,混勻,分別配制成40、100、40 μg/mL的儲備液,使用0.22 μm的微孔濾膜濾過除菌,4 ℃避光保存。用DMEM培養基將馬錢子堿儲備液稀釋成質量濃度依次為36、18、9、4.5、2.25、1.125 μg/mL的溶液,將士的寧儲備液稀釋成質量濃度依次為48、24、12、6、3、1.5 μg/mL的溶液,將鹽酸麻黃堿儲備液稀釋成質量濃度依次為40、20、10、5、2.5、1.25 μg/mL的溶液,備用。
2.3.2 乳香、沒藥揮發油溶液的配制 分別精密稱取乳香、沒藥揮發油10 mg于1.5 mL離心管中,加入1% DMSO超聲溶解,再加入適量DMEM潤洗轉移至量瓶中,并用DMEM定容,混勻配制成1 mg/mL的儲備液,使用0.22 μm的微孔濾膜濾過除菌,4 ℃避光保存。用DMEM培養基將乳香、沒藥揮發油儲備液稀釋成質量濃度依次為0.80、0.40、0.20、0.10、0.05、0.02 mg/mL的溶液,備用。
2.3.3 乳香、沒藥藥對/混合揮發油溶液的配制 精密稱取乳香、沒藥藥對/混合揮發油10 mg于1.5 mL離心管中,加入1%DMSO超聲溶解,再加入適量DMEM潤洗轉移至量瓶中,并用DMEM定容,混勻配制成1 mg/mL的儲備液,使用0.22 μm的微孔濾膜濾過除菌,4 ℃避光保存。用DMEM培養基將乳香、沒藥藥對/混合揮發油儲備液稀釋成質量濃度依次為0.32、0.16、0.10、0.08、0.04、0.02 mg/mL的溶液,備用。
2.3.4 氮酮溶液的配制 精密稱取氮酮1 mg于1.5 mL離心管中,加入1% DMSO超聲溶解,再加入適量DMEM潤洗轉移至量瓶中,并用DMEM定容,混勻配制成0.1 mg/mL的儲備液,使用0.22 μm的微孔濾膜濾過除菌,4 ℃避光保存。用DMEM培養基將氮酮儲備液稀釋成質量濃度依次為96、48、24、12、6、3 μg/mL的溶液,備用。
2.3.5 混合生物堿溶液的配制 根據馬錢子堿、士的寧經皮中毒劑量及九分散中馬錢子堿、士的寧、鹽酸麻黃堿這3種成分的比例[1],設置混合生物堿中馬錢子堿、士的寧、鹽酸麻黃堿的比例為1∶2∶1。取“2.3.1”項下馬錢子堿、士的寧、鹽酸麻黃堿儲備液按照1∶2∶1比例,以士的寧的安全濃度為參比,用DMEM培養基將混合生物堿稀釋成質量濃度依次為12、6、3、1.5、0.75、0.375 μg/mL的溶液,備用。
2.3.6 不同揮發油及氮酮與3種生物堿混合溶液的配制 乳香含揮發油3%~8%,沒藥含揮發油2.5%~9%[10],按照九分散中馬錢子、麻黃、乳香、沒藥的比例,設置乳香/沒藥、馬錢子堿、士的寧、鹽酸麻黃堿的比例為3∶1∶2∶1。精密稱取不同揮發油及氮酮3 mg于1.5 mL離心管中,加入0.1% DMSO超聲溶解,再加入適量DMEM潤洗轉移至量瓶中,并用DMEM定容,混勻配制成120 μg/mL的儲備液。按照3∶1∶2∶1的比例與3種生物堿混合,再用DMEM培養基依次稀釋成“2.3.1”“2.3.5”項下含生物堿質量濃度溶液,備用。
2.4 CCK-8法測定HaCaT細胞存活率
待T-25培養瓶中HaCaT細胞生長至80%~90%時,除去上層培養液,用無鈣鎂HBSS清洗2次,待1 mL 0.25%胰酶消化后加入4 mL完全培養液終止消化,離心收集細胞并加入新鮮完全培養液制成HaCaT細胞懸浮液,以10×104/mL細胞密度S型接種于96孔培養板,每孔200 μL,并設置不含細胞的完全培養液空白組和含細胞懸液對照組,待細胞在培養箱中培養24 h后,棄去培養基,HBSS溶液清洗2次后,給藥組分別加入“2.3”項下不同質量濃度及種類的藥物溶液200 μL,空白組加入200 μL DMEM培養基,對照組加入含0.1%(生物堿與揮發油混合配制)或1%(單獨的揮發油及氮酮)DMSO的DMEM培養基。每個濃度設置6個復孔,置于培養箱繼續培養4 h,吸去培養液后,每孔再加入100 μL的10% CCK-8溶液,繼續培養2 h,取出,用酶標儀在450 nm處測定吸光度(),計算細胞存活率,當存活率大于90%時,可認為該藥物濃度對細胞無毒性作用。
細胞存活率=(給藥-空白)/(對照-空白)
2.5 LC-MS/MS結合BCA蛋白試劑盒測定HaCaT細胞對3種生物堿的攝取量[11]
LC-MS/MS定量分析法色譜條件:色譜柱為ACE UltraCore Super C18100A(100 mm×2.1 mm,2.5 μm),以0.1%甲酸水溶液(A)-乙腈(B)為流動相,梯度洗脫程序:0~1 min,6% B;1.0~2.5 min,6%~15% B;2.5~3.5 min,15%~17% B;3.5~3.6 min,17%~95% B;3.6~4.5 min,95% B;4.5~4.6 min,95%~6% B ;4.6~6 min,6% B。進樣量為2 μL,體積流量0.3 mL/min,柱溫30 ℃。
分別精密稱取3種生物堿1 mg,置于離心管中,加入0.1% DMSO助溶,用甲醇定容至10 mL,即得100 μg/mL各對照品儲備液。取各對照品儲備液用HBSS進行稀釋,加入內標(甲硝唑,1 ng/mL)得質量濃度為200、100、50、25、12.5、6.25、3.13、1.56、0.78、0.39、0.20、0.10 ng/mL的馬錢子堿、士的寧、鹽酸麻黃堿溶液;進樣量為2 μL。以馬錢子堿、士的寧、鹽酸麻黃堿和甲硝唑峰面積之比()為縱坐標,以質量濃度()為橫坐標,進行線性回歸,加權后得其回歸方程:馬錢子堿=0.150 2-0.108(2=0.999 6),士的寧=0.356 5-0.137 9(2=0.999 9),鹽酸麻黃堿=4.798+0.248 9(2=0.998 0)。結果表明,馬錢子堿在0.39~200 ng/mL、士的寧在0.2~200 ng/mL、鹽酸麻黃堿在0.2~100 ng/mL與峰面積之比呈良好的線性關系。
以細胞攝取的馬錢子堿、士的寧、鹽酸麻黃堿為指標,設置不同揮發油組、溶劑對照組(不含揮發油的等濃度的生物堿溶液),定量研究在不同揮發油作用下單獨給藥(含單一生物堿)、共同給藥(3種生物堿混合)時馬錢子堿、士的寧、鹽酸麻黃堿的細胞攝取量。調整HaCaT細胞密度為4×105/mL,接種于6孔細胞培養板中,每孔加入2 mL細胞懸液,置于細胞培養箱中培養24 h,待細胞生長至80%~90%時,用無鈣鎂的HBSS清洗2次,分別加入3 μg/mL馬錢子堿及其與9 μg/mL不同揮發油的混合溶液、6 μg/mL士的寧及其與9 μg/mL不同揮發油的混合溶液、3 μg/mL鹽酸麻黃堿及其與9 μg/mL不同揮發油的混合溶液,以及3種生物堿混合溶液與9 μg/mL不同揮發油的混合溶液各2 mL,同時設置溶劑對照組,給藥4 h后,吸去藥液,用無鈣鎂的HBSS清洗2次,加入1 mL HBSS,冰上操作,用細胞刮刀輕輕刮下細胞,再加0.5 mL HBSS清洗至1.5 mL離心管中,2500 r/min離心5 min,除去上清液,加入200 μL含0.1% TritonX-100的HBSS溶液裂解細胞,冰上裂解20 min,13 000 r/min高速離心10 min后,取上清液。一部分細胞裂解液用BCA蛋白試劑盒測定細胞蛋白含量;另外一部分采用LC-MS/MS測生物堿含量,精密吸取100 μL細胞裂解液于1.5 mL離心管中,加入2 ng/mL內標溶液100 μL,置于混合器中渦旋30 s混勻,16 000 r/min離心10 min,吸取100 μL上清液測定。計算單位蛋白中藥物攝取量,結果以ng藥物/mg蛋白表示。
2.6 細胞膜電位的測定[12]
采用流式細胞儀測定乳香、沒藥揮發油及陽性促透劑氮酮對HaCaT細胞膜電位的影響。將密度為4×105/mL細胞接種于6孔細胞培養板中,每孔加入2 mL細胞懸液,設置空白對照組(正常培養基)、對照組(含1% DMSO培養基)及低、中、高(0.05、0.10、0.20 mg/mL)質量濃度乳香揮發油組、沒藥揮發油組、藥對揮發油組及混合揮發油組和氮酮(0.001 5、0.003、0.006 mg/mL)組,待細胞貼壁24 h后分別加入2 mL對應藥物,置CO2培養箱孵育4 h后,用HBSS清洗2次,用0.5 mL胰蛋白酶消化、離心,用HBSS稀釋并調整細胞密度1×106/mL,離心去除上清液后加入500 μL DiBAC4(3)(5 μg/mL)熒光探針溶液,避光37 ℃水浴孵育0.5 h,離心后棄上清液,用HBSS清洗2次后再用0.5 mL HBSS分散,吹勻過細胞濾網,利用流式細胞儀進行細胞膜電位測定,參數設置:激發光波長488 nm,接收波長530 nm,用未經熒光物質孵育的HaCaT細胞調零。
2.7 統計學方法
3 結果
3.1 乳香、沒藥揮發油對HaCaT細胞存活率的影響
CCK-8實驗結果如圖1~3所示。乳香揮發油、沒藥揮發油、藥對揮發油、混合揮發油、氮酮、3種生物堿均對HaCaT細胞存在明顯細胞毒作用,且呈濃度相關性,對細胞無毒的質量濃度范圍:乳香揮發油為0~0.1 mg/mL,沒藥揮發油為0~0.2 mg/mL,藥對揮發油為0~0.1 mg/mL,混合揮發油為0~0.1 mg/mL,氮酮為0~0.003 mg/mL,馬錢子堿為0~18 μg/mL,士的寧為0~12 μg/mL,鹽酸麻黃堿為0~20 μg/mL。在揮發油的安全濃度下,3種生物堿與不同揮發油無論是單獨給藥還是混合給藥,乳香揮發油、沒藥揮發油、藥對揮發油、混合揮發油均使3種生物堿的無毒范圍呈不同程度地下降。根據毒性實驗結果,結合九分散的配伍,設置馬錢子堿、士的寧、鹽酸麻黃堿的質量濃度分別為3、6、3 μg/mL,乳香揮發油、沒藥揮發油、藥對揮發油、混合揮發油的質量濃度為9 μg/mL對細胞不產生毒性,以此質量濃度進行細胞攝取實驗。
3.2 不同揮發油對單獨給藥及共同給藥時馬錢子堿、士的寧、鹽酸麻黃堿在體外細胞攝取的影響
實驗結果如圖4~6所示,單獨給藥時,與溶劑組比較,乳香揮發油、沒藥揮發油、藥對揮發油及混合揮發油組細胞中3種生物堿的量均明顯增加(<0.01),說明不同揮發油均對3種生物堿有一定促透作用,促透倍數均大于2。共同給藥時,與溶劑組比較,乳香揮發油、沒藥揮發油、藥對揮發油及混合揮發油組細胞中3種生物堿的量均明顯增加(<0.01),促透倍數均大于1。與單獨給藥比較,共同給藥各揮發油促透倍數顯著性下降(<0.01),這與課題組前期體外擴散池、在體微透析的結果一致,說明3種生物堿共存時確實彼此間存在一定的影響。
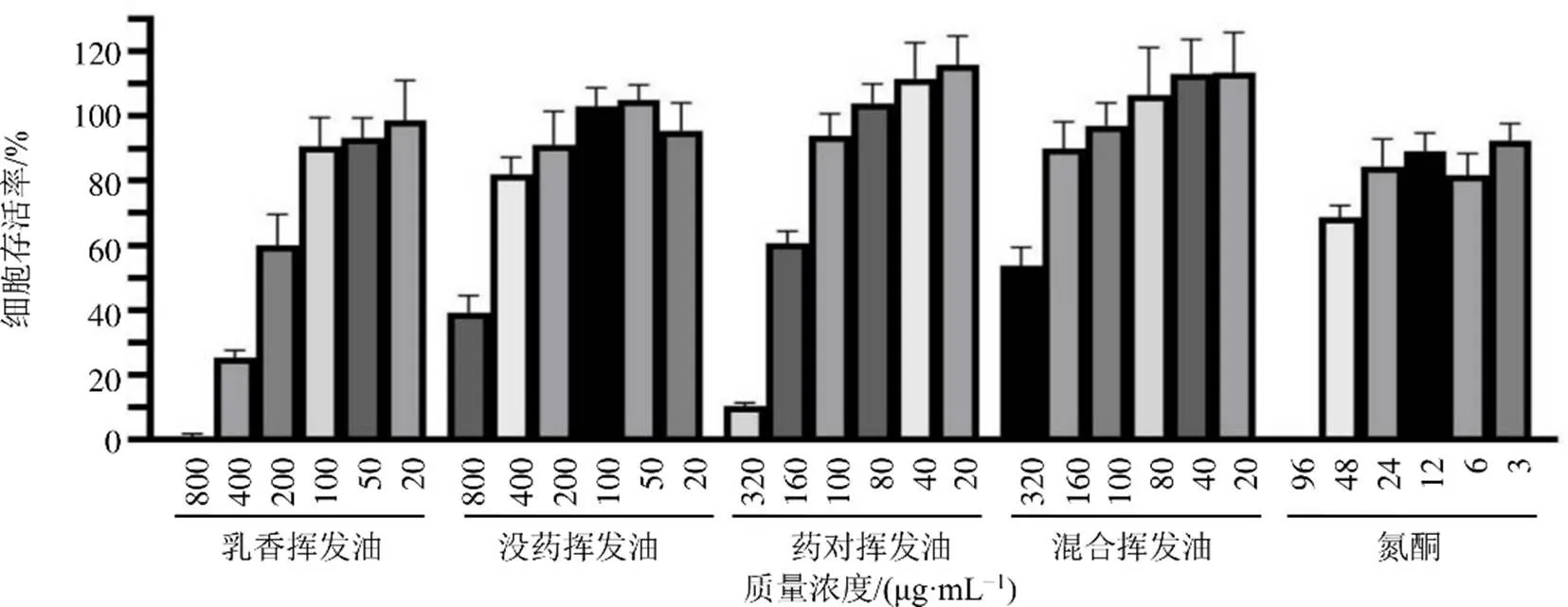
圖1 不同揮發油及氮酮對HaCaT細胞的毒性 (n= 6)
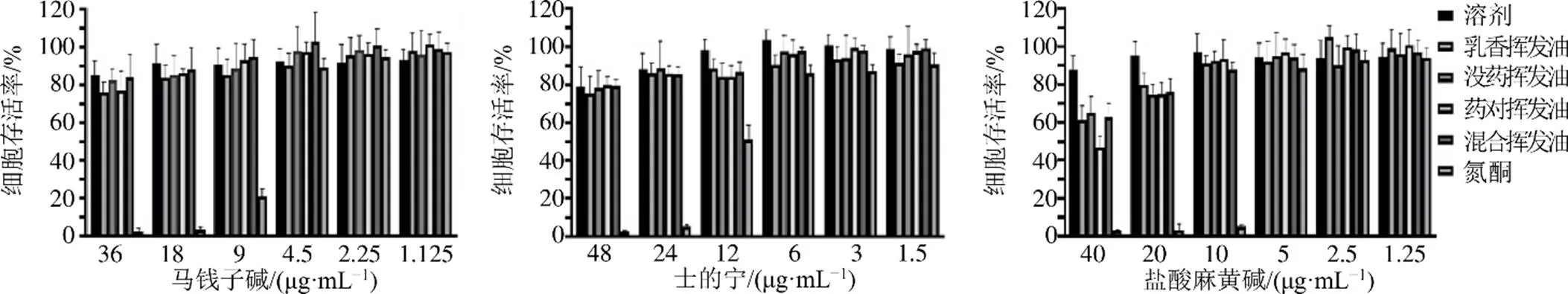
圖2 3種生物堿單獨與不同揮發油混合對HaCaT細胞的毒性(n= 6)
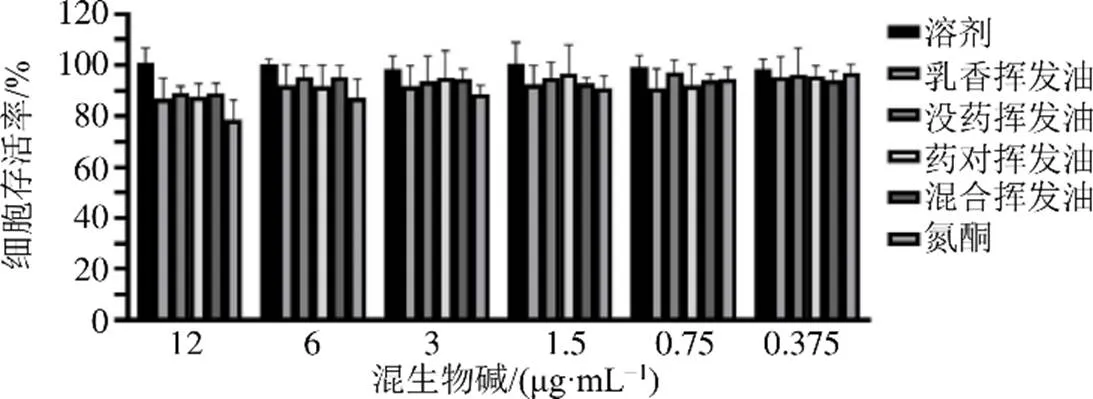
圖3 混合生物堿與不同揮發油混合對HaCaT細胞的毒性(n= 6)
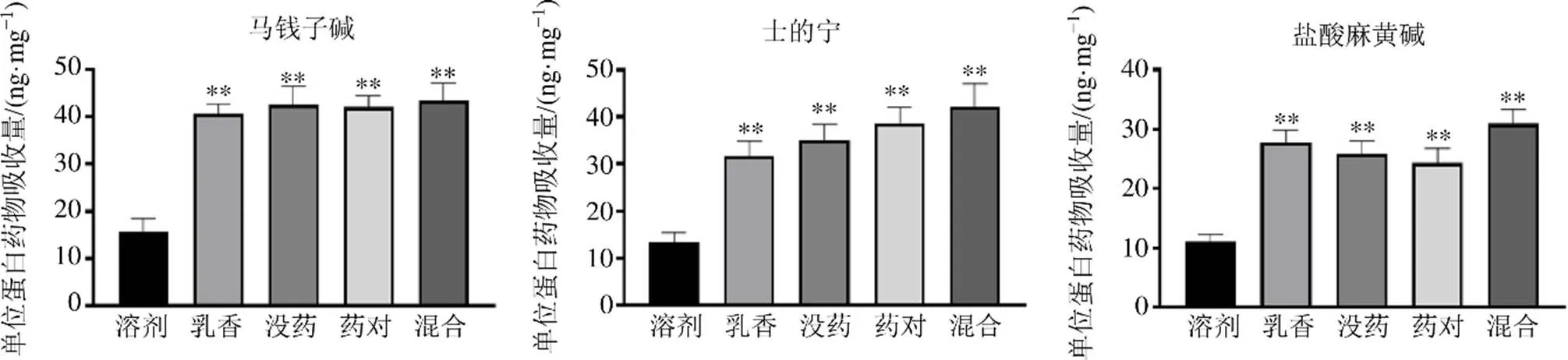
與溶劑組比較:**P<0.01,圖5同
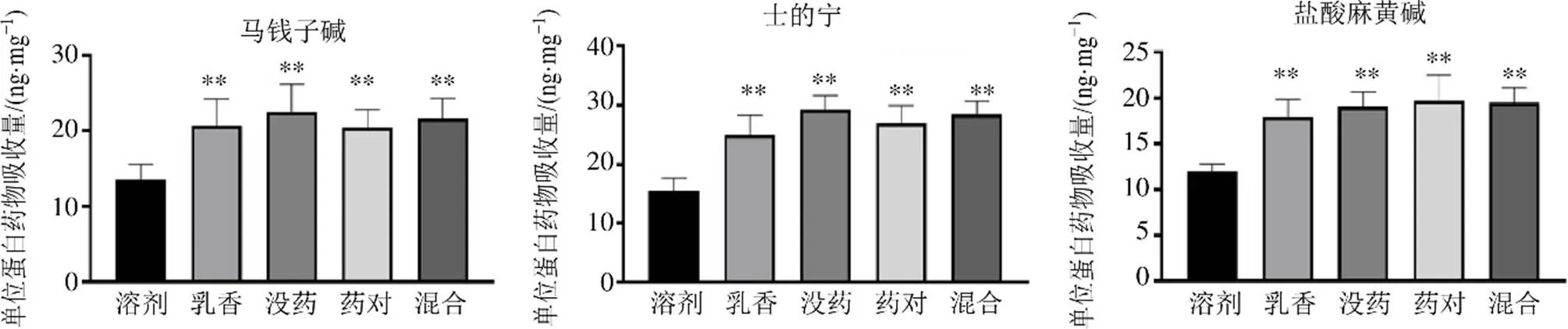
圖5 3種生物堿共同給藥時不同揮發油對其細胞攝取量的影響(n= 6)
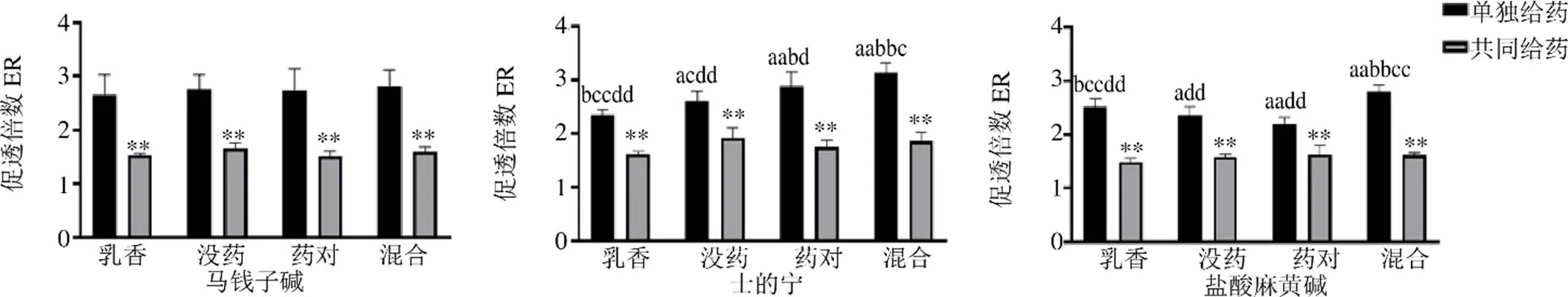
與乳香組比較:aP<0.05 aaP<0.01;與沒藥組比較:bP<0.05 bbP<0.01;與藥對組比較:cP<0.05 ccP<0.01;與混合組比較:dP<0.05 ddP<0.01;與單獨給藥方式比較:**P<0.01
3.3 不同揮發油對HaCaT細胞膜電位的影響
結果如圖7所示,空白組與對照組之間熒光強度未表現出明顯差異,說明1% DMSO(對照組)作為乳香揮發油、沒藥揮發油和氮酮的溶劑對HaCaT細胞膜電位沒有顯著影響。值得注意的是,角質細胞緊密連接外具有類似于上皮細胞的固定負電位,相關經皮促透劑可與這些負電荷發生相互作用,從而促進藥物向皮膚深層部位轉運[13]。乳香低濃度組對HaCaT細胞膜電位沒有顯著性影響,但隨著濃度增加,細胞膜電位熒光強度逐漸增強并表現出顯著性差異(<0.01),表明氮酮及乳香揮發油可以降低HaCaT細胞的膜電位。沒藥、藥對、混合的低、中、高濃度組均能顯著降低HaCaT細胞的膜電位(<0.01)。
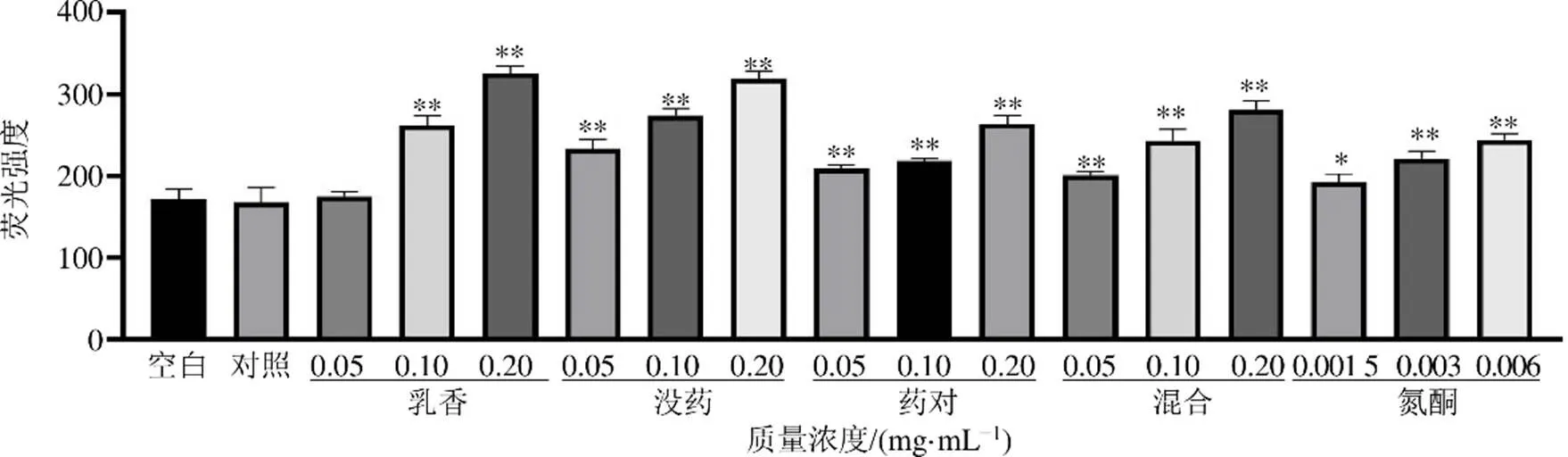
與對照組比較:*P<0.05 **P<0.01
4 討論
九分散是一種用于治療痹癥的中成藥,目前廣泛應用于類風濕關節炎、痛風等,具有確切療效,但久服易中毒,外敷透皮性差。將九分散處方制成合適的透皮制劑,可以直接用于局部發揮藥效,避免口服給藥發生的肝首過效應和胃腸道的影響,減少用藥次數以及靈活調節給藥劑量,從而降低藥物毒性作用[14],使其發揮出更好的療效,但方中各藥味相互作用機制和作用方式尚待探明。本研究選擇馬錢子中馬錢子堿、士的寧生物堿與麻黃中鹽酸麻黃堿生物堿作為研究對象,探討乳香、沒藥揮發油對這3種生物堿的HaCaT細胞攝取促進作用及其相關機制,從而為九分散外用制劑的開發提供參考。同時對乳香沒藥揮發油的促透機制進行了探討,為乳香、沒藥揮發油的使用提供依據。
揮發油類成分是乳香、沒藥的主要有效成分,乳香、沒藥含有烯類、醛類、酸類等揮發油,其主要揮發油成分乙酸辛酯具有顯著的促透作用[15]。揮發油屬天然物質,其毒性低于化學促透劑,對親水性和親脂性藥物均有較好的促滲效果,CCK-8毒性實驗及體外細胞攝取實驗也證實,乳香、沒藥揮發油單用及配伍的毒性均低于氮酮,對馬錢子堿、士的寧、鹽酸麻黃堿均具有一定的促滲透作用,且對脂溶性的馬錢子堿、士的寧促透效果好于水溶性的鹽酸麻黃堿,考慮乳香、沒藥揮發油為兩親性天然促透劑。對比生物堿單獨給藥與按處方比例共同給藥2種方式的揮發油促透倍數時,發現不同揮發油對馬錢子堿、士的寧、鹽酸麻黃堿的單獨給藥的促透倍數均在共同給藥時出現顯著性下降,推測這3種生物堿在共同經皮促透過程中或存在互相干擾。
皮膚角質細胞間連結處具有固定負電荷,文獻研究顯示[12],當一些經皮促透劑與這些負電荷發生相互作用時,可促進藥物向皮膚深層部位轉運而利于藥物的透皮吸收。乳香、沒藥揮發油單用及藥對混合均可降低HaCaT細胞的膜電位,表現出類似化學促透劑氮酮的作用方式,乳香、沒藥揮發油對3種生物堿的促透作用可能通過影響皮膚細胞表面負電荷而改變皮膚活性表皮屏障作用,從而有利于生物堿透過皮膚活性表皮層。研究表明乳香、沒藥混合組及藥對組呈現出的作用并不是乳香、沒藥揮發油作用的加和,有文獻報道乳香、沒藥配伍后的揮發油的化學成分及含量均有一定變化[16],具體涉及哪種化學成分的增減還有待進一步的實驗研究。
綜上所述,本研究采用HaCaT細胞模型,證實了九分散方中乳香、沒藥揮發油均能促進HaCaT細胞攝取九分散中馬錢子活性成分馬錢子堿、士的寧與麻黃活性成分鹽酸麻黃堿,同時利用流式細胞儀比較了乳香、沒藥揮發油作用前后細胞膜電位的變化,表明乳香、沒藥揮發油通過提高HaCaT細胞的細胞膜流動性促進3種生物堿透膜入胞,該機制為乳香、沒藥揮發油促進方中有效成分經皮滲透和皮膚滯留的機制之一。九分散經皮轉運機制的研究,可為更好地尋找作用強、毒性低的促透劑及設計促透劑復方提供理論依據,研究和開發出更多經皮給藥產品,滿足臨床對多種疾病治療的需要。
利益沖突 所有作者均聲明不存在利益沖突
[1] 中國藥典 [S]. 一部. 2020: 52-498.
[2] 王坤山. 推薦一個治痹良方“九分散” [J]. 河南中醫, 1984, 4(5): 49-50.
[3] 周世明. 九分散治療痛痹 [J]. 四川中醫, 1986, 4(2): 45.
[4] 張月華, 伊春錦, 陸霞, 等. 古方九分散加味治療痹病的觀察與實驗研究 [J]. 福建醫藥雜志, 1994, 16(5): 34.
[5] 孫亦群. 九分散經皮給藥制劑的研究 [D]. 廣州: 廣州中醫藥大學, 2001.
[6] Boukamp P, Petrussevska R T, Breitkreutz D,. Normal keratinization in a spontaneously immortalized aneuploid human keratinocyte cell line [J]., 1988, 106(3): 761-771.
[7] 朱小芳, 羅晶, 管詠梅, 等. 乳香沒藥揮發油對川芎體外透皮吸收的影響及其皮膚血流促透機制研究 [J]. 中國中藥雜志, 2017, 42(4): 680-685.
[8] 管詠梅, 陶玲, 朱小芳, 等. 乳香沒藥揮發油對川芎中阿魏酸促透機制的研究 [J]. 中國中藥雜志, 2017, 42(17): 3350-3355.
[9] 中國藥典 [S]. 四部. 2020: 233.
[10] 江蘇新醫學院. 中藥大辭典(上冊) [M]. 上海: 上海科學技術出版社, 1991: 1167.
[11] 張馨, 王莉芳, 陳佳琪, 等. 龍血竭酚類提取物主要成分在Caco-2細胞中吸收機制研究 [J]. 中國中藥雜志, 2020, 45(20): 4889-4895.
[12] 蘭頤, 李輝, 陳巖巖, 等. 花椒油對HaCaT細胞膜流動性及膜電位的影響及其機制研究 [J]. 世界科學技術—中醫藥現代化, 2015, 17(1): 44-51.
[13] 蘭頤, 王景雁, 劉艷, 等. 萜烯類經皮促透劑對皮膚活性表皮層的影響及其機制研究 [J]. 中國中藥雜志, 2015, 40(4): 643-648.
[14] 熊璐琪, 李國鋒, 蘇碧雅, 等. 醋酸地塞米松和地塞米松磷酸鈉的油水分配系數與其經皮滲透行為之間的相關性研究 [J]. 中國藥學雜志, 2011, 46(6): 439-446.
[15] 趙金鳳. 乳香和沒藥揮發性成分的分析及其經皮吸收研究 [D]. 濟南: 山東中醫藥大學, 2011.
[16] 王艷艷, 王團結, 宿樹蘭, 等. 乳香、沒藥藥對配伍揮發油成分的GC-MS分析 [J]. 現代中藥研究與實踐, 2011, 25(2): 31-34.
A preliminary study on promoting effect of frankincense and myrrh volatile oil on HaCaT cell uptake of alkaloids in Jiufen Powder and its mechanism
GAO Ling, HUANG Shi-yu, CHEN Li-hua, LI Ying-ying, GUAN Yong-mei, LIU Li-li, ZHU Wei-feng
Key Laboratory of Modern Preparation of Chinese Materia Medica, Ministry of Education, Jiangxi University of Chinese Medicine, Nanchang 330004, China
To study the effect and mechanism of the volatile oil of frankincense and myrrh in Jiufen Powder (九分散) in promoting keratinocyte HaCaT uptake of brucine, strychnine and ephedrine hydrochloride.The CCK-8 method was used to detect the effect of frankincense and myrrh volatile oil single use/drug pair on the survival rate of HaCaT cells when combined with brucine, strychnine, and ephedrine hydrochloride in Jiufen Powder prescriptions; LC-MS/MS quantified analytical method combined with BCA protein kit was used to determine the influence of the volatile oil of frankincense and myrrh on the uptake of HaCaT cells to three alkaloid cells; DiBAC4 (3) was used as a fluorescent probe to determine the effect of the volatile oil of frankincense and myrrh on HaCaT cell membrane potential.The volatile oils of different frankincense and myrrh all had a certain penetration promoting effect on the three alkaloids, and the penetration promoting effect on the lipid-soluble brucine and strychnine was better than the water-soluble ephedrine hydrochloride. After the volatile oil of frankincense and myrrh acted on the HaCaT cells labeled with DiBAC4(3), the volatile oil of frankincense and myrrh could reduce the membrane potential of HaCaT cells. As the concentration increased, the fluorescence intensity of the cell membrane potential increased and showed a significant concentration dependence, showing a similar mode of azone action.Both frankincense and myrrh volatile oil can promote the uptake of three alkaloids by HaCaT cells. The promotion mechanism may change the active epidermal barrier function of the skin by affecting the negative charge on the skin surface, thereby facilitating the penetration of the drug through the active epidermal layer. The mechanism needs to be further explored.
Jiufen Powder; frankincense volatile oil; myrrh volatile oil; brucine; strychnine; ephedrine hydrochloride; cell membrane potential
R285
A
0253 - 2670(2021)08 - 2357 - 08
10.7501/j.issn.0253-2670.2021.08.019
2020-12-19
江西省主要學科學術和技術帶頭人培養計劃(20204BCJL22048);江西省自然科學基金項目(20181BAB205078);江西省重大科技研發專項(S2019ZDYFB0027);江西中醫藥大學校級大學生創新創業訓練計劃(202010412182)
高 玲(1996—),女,在讀碩士研究生,研究方向為中藥新制劑與新技術研究。E-mail: 857728223@qq.com
陳麗華(1972—),女,教授,博士生導師,研究方向為中藥新制劑與新技術研究。E-mail: Chlly98@163.com
[責任編輯 潘明佳]

