N-乙酰半胱氨酸對PM2.5致支氣管上皮細胞損傷的保護作用體外實驗
郭 淼,閆 鵬,韓國鑫,朱 明,金 珊,肖 坤,解立新
1 解放軍醫學院,北京 100853;2 解放軍總醫院 呼吸與危重癥醫學部,北京 100853;3 戰略支援部隊特色醫學中心 急診科,北京 100101;4 美中宜和婦兒醫院 內科,北京 100101
可吸入顆粒物PM2.5對人體健康的影響受到全世界的廣泛關注。近年來的相關研究表明,PM2.5會加重慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)等肺疾。PM2.5被吸入后沉積于呼吸道上皮,進入細胞間空隙,促使生成白細胞介素(interleukin,IL)-1β、IL-6、腫瘤壞死因子等多種促炎性細胞因子,這些分子在短時間內釋放,促進呼吸系統的炎癥反應,從而加重患者的呼吸道癥狀,對呼吸系統造成不利影響[1-2]。因此有效控制炎癥反應,可以減輕PM2.5引起的呼吸系統功能障礙。N-乙酰半胱氨酸(N-acetyl-Lcysteine,NAC)是一種黏液溶解劑。相關研究發現NAC擁有較強的抗氧化作用,能夠有效減輕粉塵顆粒引起的氣道上皮細胞炎癥反應[3]。自噬作為COPD的發病機制之一,可以影響氣道黏液的分泌和氣道重構,但其是促進COPD的發展還是作為一種防御機制國內外仍然存在爭議[4-5]。在PM2.5誘導的氣道反應中,自噬的作用,以及如何抑制自噬的作用以達到緩解氣道炎癥反應,相關研究較少。近期的研究表明,NAC可以通過調節自噬,減輕氧化應激誘導的細胞損傷和衰老[6-7]。這為我們研究如何通過調控自噬,以達到抑制PM2.5誘導的氣道炎癥反應提供了新思路。本研究擬通過探討NAC對PM2.5致人支氣管上皮細胞凋亡和自噬反應的抑制作用,以期尋找新的方法來減弱PM2.5的肺毒性。
材料與方法
1 試劑和儀器 BEAS-2B細胞(上海斯信生物科技有限公司),RPMI Medium 1 640培養基(Gibco),胎牛血清(Gibco),Penicillin-Streptomycin Solution(HyClone),L-Glutamine、Sodium Pyruvate (Gibco),N-乙酰半胱氨酸(Sigma),LC3b抗體、P62抗體(CST),4%多聚甲醛(碧云天),Triton X-100(上海西唐生物科技有限公司),牛血清白蛋白溶液(Sigma),Alexa Fluor 488標記山羊抗兔IgG(碧云天),GAPDH (14C10) Rabbit mAb(CST),Immobilon Western HRP底物化學發光液(默克密理博),CO2培養箱(Thermoscientific),流式細胞儀(BD FACSCalibur),激光共聚焦顯微鏡 TCS-SP8(雙光子、FLIM;Leica徠卡),Sage creation化學發光凝膠 成像儀(北京賽智創業科技有限公司)。
2 霧霾顆粒的收集 依據中華人民共和國國家環境保護標準(HJ 92-2013)所述要求,選擇距離地面約20 m的露天平臺,使用型號為2025i型環境空氣顆粒物(PM2.5)采樣器[質(認)字No.2014-098,賽默飛世爾科技(中國)有限公司],當空氣質量指數(AQI)>200 m3/L時,采集PM2.5標本。選擇200 mm×250 mm高純度玻璃纖維膜(無膠黏劑)作為濾膜,連續采集24 h。在采集結束后,使用鑷子小心取下濾膜,在確認濾膜無破裂后,將濾膜的采樣面向里對折。在此過程中注意保持濾面平整,避免顆粒物脫落,以鋁箔包裹后放入密封袋中,然后放置于冰盒中帶入實驗室,在-20℃下 保存備用。
3 PM2.5顆粒的洗脫和配制 使用無菌手術剪把采集好的PM2.5濾膜剪成約1 cm2大小,置于裝有適量滅菌超純水的潔凈燒杯里,以保鮮膜封口后超聲振蕩,選擇功率為500 W,工作頻率40 kHz,超聲時間為15 min×3次,超聲過程中加冰使水溫保持在25 ℃以下。收集洗脫液,用6 ~ 8層無菌紗布濾過,濾出液-80 ℃冷凍下過夜,真空冷干燥成干粉,置于密閉的玻璃容器中,-80℃冰箱保存。稱取適量的PM2.5干粉,經紫外線照射30 min,在超凈臺中加入PBS溶液,配制成終濃度為100 mg/mL的PM2.5顆粒母液,充分混勻后置 于4℃冰箱保存。
4 細胞培養 將BEAS-2B細胞置于含10%胎牛血清、1% L-Glutamine、1% Sodium Pyruvate、1%Penicillin-Streptomycin Solution、87% RPMI Medium 1640培養基中,于 37 ℃、5% CO2條件下培養,每 天換培養基,隔天按 1∶2的比例傳代。
5 實驗分組 選取對數生長期的細胞制成單細胞懸液,接種于6孔板中,培養24 h待細胞貼壁。將實驗細胞按照不同暴露因素設為控制對照組、PM2.5組、PM2.5+NAC組。對照組為普通培養基處理16 h;PM2.5組用普通培養基預處理4 h后再用含有PM2.5的培養基處理12 h;PM2.5+NAC組用含有NAC的培養基預處理4 h再用含有PM2.5的培養基處理12 h。處理濃度為PM2.5:100 μg/mL,NAC:1 mmol/L,每組設2個復孔。處理濃度及時 間綜合國內外相關研究后設定[8-10]。
6 細胞凋亡檢測 收集細胞后,取ANNEXIN VFITC/PI凋亡檢測試劑盒包裝中的Binding Buffer稀釋至1×后重懸細胞,加入Annexin V-FITC輕柔混勻后,在室溫、避光環境下放置10 min,再加入PI,在室溫、避光環境下孵育5 min。加入磷酸鹽緩沖液(PBS)輕柔混勻,在1 h內使用流式細胞儀 進行檢測。
7 共聚焦顯微鏡檢測細胞自噬 收集、接種細胞,洗滌培養基,4%多聚甲醛孵育10 min,然后用0.5% Triton X-100孵育5 min,加入1%牛血清白蛋白處理1 h,再予LC3b抗體在4℃孵育16 h。然后用Alexa Fluor 488標記山羊抗兔IgG在室溫下避光標記0.5 h,染色,使用抗淬滅的封片劑進行封片,使用共聚焦顯微鏡捕捉熒光圖像,并進行 圖像分析。
8 免疫印跡雜交(Western blot) 細胞總蛋白樣品制備,SDS-聚丙烯酰胺凝膠電泳(SDS-PAGE),使用硝酸纖維素膜(NC膜)轉膜,放置在LC3b抗體、P62抗體和GAPDH (14C10) Rabbit mAb等一抗稀釋液4℃環境下孵育過夜。然后在Alexa Fluor 488標記山羊抗兔IgG的二抗稀釋液中,常溫環境下孵育1 h。在Immobilon Western HRP底物化學發光液中,室溫下孵育3 min。使用Sage creation化學發光凝膠成像儀進行曝光,處理圖像后 ,進行分析。
9 統計學分析 所有資料采用IBM SPSS Statistics 24軟件進行統計學分析。計量資料符合正態分布,以 xˉ±s 表示,多組間比較采用單因素方差分析,兩兩比較采用LSD檢驗。P<0.05為差異有統 計學意義。
結 果
1 三組支氣管上皮細胞凋亡率比較 與對照組和PM2.5+NAC組比較,PM2.5組細胞凋亡明顯增加(P均<0.05),而PM2.5+NAC組可明顯抑制PM2.5(100 μg/mL)引起BEAS-2B細胞凋亡(P=0.001)。見 圖1。
2 三組支氣管上皮細胞自噬比較 與對照組比較,PM2.5組LC3熒光量明顯增加;與PM2.5組比較,PM2.5 + NAC組LC3熒光量明顯減少。結果說明,PM2.5可以引起支氣管上皮自噬的明顯增加,而NAC可以明顯抑制PM2.5引起的支氣管上 皮細胞自噬 。見圖2A,圖2B。
3 Western Blot結 果 比 較 與 對 照 組 比 較,PM2.5組LC3Ⅱ/LC3Ⅰ明顯增加,P62明顯減少;與PM2.5組比較,PM2.5+NAC組LC3Ⅱ/LC3Ⅰ明顯減少,P62明顯增加。結果表明,NAC可以明顯抑制PM2.5引起的支氣管上皮細胞自噬。見 圖3。
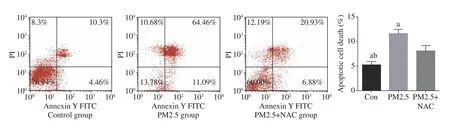
圖 1 流式細胞儀測定細胞凋亡及定量分析 (aP<0.05,vs PM2.5+NAC;bP<0.05,vs PM2.5F ig.1 Flow cytometry. Results of apoptosis and quantification analysis (aP<0.05, vs PM2.5+NAC; bP<0.05, vs PM2.5
討 論
慢性呼吸系統炎癥是由于呼吸道持續暴露于空氣中的微粒(包括PM2.5、香煙煙霧等污染物以及病原體)引起。作為對這些刺激的反應,肺采取許多防御機制,包括上皮屏障、先天及后天免疫。肺上皮是阻止顆粒物進入的主要屏障,因此氣道上皮細胞也是吸入有害顆粒物的主要目標。在體外實驗中培養支氣管上皮細胞,并以各種類型的環境和實驗室粒子處理細胞,已成為普遍接受的毒理學研究方法。研究表明,細顆粒物中的碳元素、過渡金屬及有機成分等,可通過氧化損傷等機制誘導人支氣管上皮細胞的毒性損傷[11]。香煙煙霧顆粒可通過氧化反應誘導人支氣管上皮細胞BEAS-2B細胞凋亡,而NAC可抑制香煙煙霧顆粒誘導的BEAS-2B細胞凋亡[12]。相關研究支持氧化應激是PM2.5誘導的炎癥反應、細胞毒性和癌變的重要機制這一觀點[13]。PM2.5刺激肺上皮A549細胞后,導致其發生氧化應激損傷和自噬激活,從而損害肺功能。
本研究中,以PM2.5刺激支氣管上皮細胞模擬患者的慢性炎癥和上皮功能受損。結果顯示,NAC可顯著減少炎癥刺激條件下支氣管上皮細胞的凋亡,并起到保護作用。NAC的抗氧化應激作用已經非常明確,其進入細胞后產生半胱氨酸,進一步促進細胞內谷胱甘肽的產生。谷胱甘肽是半胱氨酸殘基形式的活性巰基的載體,通過與活性氧/活性氮和親電試劑相互作用,作為各種酶的輔助因子發揮抗氧化作用,清除體內氧自由基和細胞毒性物質,從而減少有害物質對親核生物大分子的損傷[14]。而相關的臨床實驗和Meta分析也表明,NAC能夠預防COPD的加重[15]。
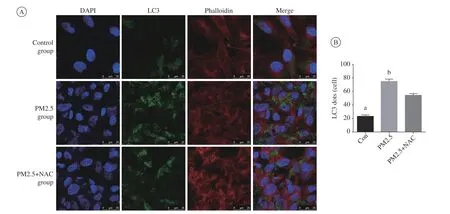
圖 2 細胞自噬熒光圖A:細胞核的DAPI染色(藍色)、細胞骨架的鬼筆環肽染色(紅色)作為背景染色,LC3熒光呈綠色;B:熒光定量分析(aP<0.05,vs PM2.5;bP<0.05,vs PM2.5+NAC)Fig.2 Measurement of autophagy by fluorescent microscopy A: DAPI staining of nuclei (blue) and Phalloidin staining of cytoskeleton (red) were set as the background stain, and LC3 fluorescence was green; B: Quantification analysis (aP<0.05, vs PM2.5; bP<0.05, vs PM2.5+NAC)

圖 3 LC3Ⅰ、LC3Ⅱ、P62、GAPDH定量分析(A。aP<0.05,vs PM2.5;bP<0.05,vs PM2.5+NAC)及化學發光結果(B)F ig.3 Quantification analysis (A. aP<0.05, vs PM2.5; bP<0.05, vs PM2.5+NAC) and chemiluminescence. Results of LC3Ⅰ, LC3Ⅱ, P62 (B)
有研究表明,自噬在肺的炎癥反應中起著至關重要的作用,對慢性肺部疾病的感染有較大影響[5,16-18]。自噬包括兩種主要類型:1)典型的自噬,是對細胞應力和(或)營養剝奪的一種穩態反應;2)非典型自噬(也被稱為特定自噬,包括線粒體自噬/異體自噬等),可以控制和抑制慢性炎癥[19]。在COPD發生發展過程中,有長期的炎癥和刺激,自噬作用更復雜。PM2.5暴露介導人支氣管上皮細胞BEAS-2B細胞自噬,可以促進細胞的炎癥反應,從而引起細胞的死亡。LC3是自噬標志物。在自噬過程中,LC3前體裂解形成胞質形式LC3Ⅰ,然后轉化生成脂質化形式的LC3,即LC3Ⅱ。LC3Ⅱ可以附著于自噬體的膜上,是自噬體的結構蛋白。P62是自噬蛋白。在自噬過程中,P62與泛素化的蛋白質結合,再與定位于自噬小體內膜上的LC3Ⅱ形成復合物,然后在自噬溶酶體內降解。在自噬增強時,細胞質中的P62不斷被降解;自噬減弱時,P62會在細胞質中不斷累積。因此,LC3Ⅱ/LC3Ⅰ增加,P62減少,提示自噬增強;LC3Ⅱ/LC3Ⅰ減少,P62增加,提示自噬減弱。本研究表明,PM2.5暴露可以引起人支氣管上皮細胞BEAS-2B自噬的增強,而NAC可以抑制PM2.5介導的人支氣管上皮細胞BEAS-2B的自噬。
本研究證明,可吸入顆粒物PM2.5可通過誘導人支氣管上皮細胞BEAS-2B的凋亡和自噬,致細胞損傷;NAC可通過調控人支氣管上皮細胞BEAS-2B的凋亡和自噬,減輕細胞損傷。對自噬途徑的選擇性操控,是調節免疫和抑制慢性阻塞性肺病慢性炎癥的一種新思路[20]。

